三类植物脂类转运蛋白家族研究进展
姜 雪,宋兴舜,孟 威
(东北林业大学生命科学学院/东北盐碱植被恢复与重建教育部重点实验室,哈尔滨150040)
0 引言
脂类是生物体内的重要物质之一,它不仅是生物膜的主要组分、为各种生理过程提供能量、作为信号分子参与信号转导,而且还能够构成生物体表面的保护层[1]。植物脂类物质的合成途径多种多样,包括发生在质体的脂肪酸从头合成和甘油脂合成和发生在内质网的磷脂合成、鞘酯合成以及三酰甘油合成等途径;而脂肪酸β氧化则主要发生在过氧化物酶体[2]。细胞内脂类物质的有效运输为细胞器和膜的生物发生提供了物质基础[2]。脂质运输方式可大致分为囊泡运输和非囊泡运输[2]。囊泡运输一般包括出芽、锚定和融合等过程,细胞内膜性细胞器之间的物质运输主要通过囊泡运输完成[3]。而非囊泡运输包括膜间脂质运输和细胞内脂质运输[3],参与的蛋白质家族主要包括脂质转移蛋白(lipid transfer proteins,LTPs)、三磷酸腺苷结合盒转运蛋白(ATP-binding cassette transporter,ABC transporter)和酰基辅酶A结合蛋白(acyl-coenzyme A-binding proteins,ACBPs)[2,4]。
近年来,关于以上三个蛋白质家族在植物脂质运输中的作用机制研究取得了较大进展,并且发现其中某些成员兼具调控脂质运输、生长发育和胁迫响应的功能。值得注意的是,与LTPs和ABC transporter相比,ACBPs具有更广泛的脂类底物结合能力,比如它们能够结合长链及超长链酰基辅酶A(acyl-CoA)和磷脂[5]。此外,ACBPs具有更多样化的亚细胞定位。综合以上因素可以推测ACBPs在脂类物质运输及相关方面具有的功能可能较LTPs和ABC transporter更加广泛。因此,本文在介绍LTPs和ABC transporter在植物脂类代谢及相关功能研究进展之外着重对ACBPs家族展开详细的介绍。
1 植物脂质转移蛋白(LTPs)
LTPs广泛分布于动物、植物和微生物中。目前已从多种植物(如马铃薯[6]、辣椒[7]、玉米[8]、小麦[9]和拟南芥[10]等)、哺乳动物(人类、牛和大鼠等)的肝脏以及一些物种的血浆和血淋巴中发现了LTPs[11-12]。总体来讲,LTPs被分为两种类型:第一类是在动物和酵母中发现的特异脂质转运蛋白(specific lipid transfer proteins,spLTPs),仅能特异性地转运一类或两类磷脂[13-14]。第二类是非特异性脂质转运蛋白(non-specific lipid transfer proteins,nsLTPs),它不仅没有特异性的底物要求,而且可以在体外与多种疏水分子发生可逆结合,如脂肪酸、脂酰辅酶A、磷脂、糖脂和角质单体[13-14]。高等植物中存在大量的nsLTPs,并且将它们进行进一步的细化分类。然而,尽管nsLTPs的分类方式经历了很多次的完善,但仍不能涵盖所有植物nsLTPs,需要进一步的改进。最新的nsLTPs分类方法是根据序列相似性、内含子的位置、糖基磷脂酰肌醇修饰位点和8CM(eight conserved cysteine motif)结构中半胱氨酸间距将其分为小分子量的类型I和大分子量的类型II及C-K亚家族[15]。现有报道的植物nsLTPs多数属于类型II。
体外研究显示,LTPs能够在体外促进微粒体和线粒体膜之间的磷脂交换,因此,最初认为LTPs在细胞内的膜生物发生和磷脂的跨膜交换等过程中发挥主要作用[6]。但是随后发现一些LTPs在N端都具有信号肽序列,并推测它们会进入分泌途径,最终定位于胞外[9]。事实证明,去除信号肽的小麦TaLTP40和TaLTP75定位于分泌途径中的内质网、高尔基体和液泡膜中[9]。免疫杂交显示咖啡(Cc-LTP2)、西兰花(WAX9)和无芒雀麦(BG-14)等多种植物的LTPs定位于细胞壁[16-18]。另外,在胡萝卜胚细胞培养产生的胞外蛋白中、葡萄和菊苣体细胞胚胎的培养基中也纯化出了几种LTPs的亚型[19-21],更加支持植物LTPs是定位于细胞外的蛋白质。2009年,Debono等发现拟南芥AtLTPG定位于蜡质分泌旺盛的茎表皮细胞膜,且在拟南芥花期茎表皮角质层的生物合成期间高度表达,同时ltpg突变体的茎表面蜡质含量减少,以上结果推测AtLTPG直接或间接地参与了表皮的蜡质沉积[22]。因此,定位于细胞外的LTPs非常有可能参与了植物细胞表面的脂质运输,如蜡质成分的跨壁转运[22]。这个研究发现为LTPs参与植物表皮脂质的合成提供了进一步的证据。然而,近期发现一些定位于细胞内的LTPs则再次支持其参与细胞内脂质运输的观点[23-24]。如豇豆种子中VuLTPs除了定位于细胞壁,还定位于蛋白贮藏液泡和脂质小泡中[23]。Ha-AP10在向日葵种子中,除了定位于质外体和细胞膜外,还定位于细胞内一些未知结构中[24]。
由LTPs介导的细胞外脂质运输在植物花粉和种子发育过程中发挥重要的作用[25-26]。在正常生长条件下,拟南芥ltpg2-1、ltpg2-2、ltpg4-1、ltpg4-2、ltpg6-1和ltpg6-2突变体的不育胚珠数量增加,且ltpg3-1、ltpg4-1和ltpg4-2突变体的花粉粒都发生了变形和收缩,推测LTPs与软木脂和孢粉质聚合物的生物合成有关[25-26](图1)。
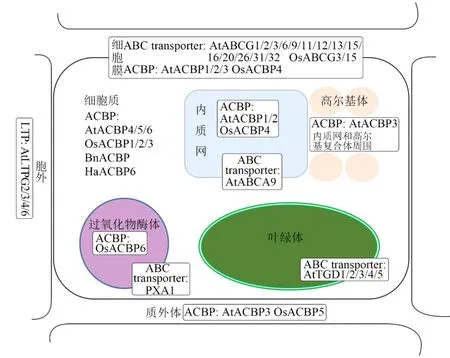
图1 与脂质运输相关的三类脂类转运蛋白亚细胞定位
然而,目前LTPs在其他植物生长发育或胁迫响应方面功能研究并未与其脂质运输能力直接联系起来。如烟草NtLTP1.6(TobLTP2)可能通过与细胞壁疏水化合物结合,导致细胞壁的非水解性破坏,进而促进细胞壁的扩张[27]。另外,通过在体外结合溶血磷脂(lysophospholipids)控制根瘤菌入侵根表皮细胞的能力,蒺藜苜蓿MtN5与根瘤的形成也密切相关[28]。此外,有些LTPs具有体外抑制细菌及真菌生长的能力而被注释为病程相关蛋白,但是其抑制微生物生长的作用机制尚未完全确定[29]。鉴于LTPs具有结合脂以及抑制病原菌生长的能力,LTPs的作用机制可能与改变病原菌的细胞膜通透性有关[16]。例如咖啡Cc-LTP2对菜豆炭疽病菌、胶孢炭疽菌、茄病镰刀菌、白术镰刀根腐病菌和刺盘孢菌的生长均有抑制作用[16]。环境胁迫如冷、干旱、重金属和盐胁迫等会破坏细胞膜完整性,同时也会诱导一些LTPs基因的表达[9,30-31]。例如,小麦TaLTP40和TaLTP75在盐胁迫处理后基因表达量升高,且过表达拟南芥耐盐性增强,并且转基因拟南芥总叶绿素含量、膜损伤指数、总生物量、发芽率、成活率和相对生长率方面均优于野生型[9]。因此,该研究推测TaLTPs表达量的提高可能是由膜流动性的变化所驱动的,并可能通过参与膜之间的脂质运输抵抗各种非生物胁迫[9]。类似的现象还存在于在水稻(OsDIL)以及苔藓(PpLTPG2、PpLTPG3、PpLTPG4、PpLTPG5、PpLTPG6、PpLTPG7、PpLTPG8、PpLTPG9)中[30-31]。
2 三磷酸腺苷结合盒转运蛋白(ABC transporter)
2.1 ABC transporter分类及亚细胞定位
ABC transporter是一个广泛分布于原核生物及真核生物中的庞大蛋白质家族。在植物拟南芥中有130个成员,水稻中有133个成员[32]。它利用ATP水解释放的能量来进行底物跨膜运输,其底物包括无机、有机小分子和各类有机大分子化合物,例如:氨基酸、脂类、无机离子、肽、糖类、金属离子、药物、维生素、蛋白质和细胞代谢产物等[33]。典型的ABC transporter由2个位于细胞质中的核苷酸结合域(nucleotide-binding domains,NBD)和2个嵌入双层膜中的跨膜结构域(transmembrane domains,TMD)组成[34]。NBD 序列高度保守,具有ATP水解酶的功能,为底物转运提供能量;而TMD负责识别并使底物通过磷脂双分子层,它的序列因底物不同而不同,具有多样性[35]。ABC transporter有很多种分类方式。比如:根据系统发生分析可分为ABCA-ABCG及ABCI 9个亚家族[36];根据蛋白质的大小等可分为全分子转运蛋白、半分子转运蛋白和可溶性转运蛋白三类[37];根据底物在细胞膜上的转运方向分为内向转运蛋白和外向转运蛋白[38]。植物中ABC transporter的亚细胞定位集中在细胞膜和各种细胞器膜上。例如在拟南芥中,全分子转运蛋白ABCB亚家族均定位于细胞膜[37,39],半分子转运蛋白ATM(ABC transporter of the mitochondria)亚家族定位于线粒体膜[37],TGD(trigalactosyldiacylglycerol)蛋白家族定位于叶绿体膜[40],全分子转运蛋白PXA1定位于过氧化物酶体膜[41],AtMRP2定位于液泡膜[42]。
2.2 ABC transporter与脂类代谢相关生物学功能
ABC transporter底物广泛,并具有多种多样的生物学功能。然而,在这个庞大的家族中,只有少部分成员在脂类代谢中发挥作用。拟南芥AtABCA9定位于内质网膜,负责调控细胞质中的脂酰辅酶A或脂肪酸向内质网内的运输[43]。过表达AtABCA9的拟南芥种子籽粒大小和籽油含量增加,而abca9突变体的种子表型则相反[43]。在脂类物质降解过程中发挥重要作用的拟南芥PXA1属于ABCD亚家族[32]。PXA1定位于过氧化物酶体膜,负责将三酰甘油水解后产生的长链脂肪酸转运至过氧化物酶体中完成后续的β氧化过程[44]。在拟南芥pxa1突变体中,由于脂肪酸无法进入过氧化物酶体,导致三酰甘油无法被正常利用产生能量用于种子萌发及后续的生长发育[44]。其他物种中的PXA1同源物也具有相同的亚细胞定位和类似功能,可见该蛋白的功能的保守性和重要性[45]。ABCG亚家族部分定位于细胞膜的成员在脂类代谢途径中也发挥了一定作用,比如AtABCG11、AtABCG12、AtABCG13、和AtABCG32参与调控拟南芥表皮蜡质和角质的运输[46-54];AtABCG1、AtABCG9、AtABCG16、AtABCG26、和AtABCG31则通过调控花粉中的脂质运输促进花粉壁发育,与花粉育性息息相关[55-58],而且水稻中OsABCG3和OsABCG15也具有相同的作用[59-63]。AtABCG2、AtABCG6和AtABCG20可能通过运输脂肪族聚合物前体调控植物根和种皮软木脂的形成[57]。拟南芥TGD家族属于ABCI亚家族,共有5个成员,TGD1、TGD2和TGD3定位于叶绿体的内膜,TGD4定位于叶绿体外膜,而TGD5在内膜和外膜之间架起桥梁(图1)。在这样一个复合体共同作用下完成内质网向叶绿体的脂质运输[40]。
2.3 ABC transporter非脂类代谢相关生物学功能
纵观ABC transporter 9个亚家族,目前与脂类代谢相关的基因出现在ABCA、ABCD、ABCG和ABCI四个亚家族,然而并不是以上四个亚家族中的所有成员都与脂质运输相关。最新研究表明,过表达ABCG亚家族OsABCG45会影响茉莉酸的生物合成,从而激活与防御相关的基因,增强水稻对白叶枯病的防御力[64]。同时,过表达OsABCG45还可以提高水稻的产量[64]。AtABCG36具有输送钠离子的能力,在干旱和盐胁迫下,拟南芥过表达AtABCG36能够提高地上组织鲜重,减少褪绿叶,表现出对两种胁迫的耐受性;相反,T-DNA插入突变体对干旱胁迫更敏感,并且地上组织鲜重降低[65]。
其他亚家族的生物学功能似乎没有与脂类代谢建立起直接的联系,且关于植物ABCE和ABCF亚家族的报道很少。例如,ABCB亚家族能够运输生长素和其他植物激素,并因此参与调控植物的生长发育过程[66-67]。拟南芥atabcb19突变体的不定根数量比野生型显著减少,且AtABCB19可以局部诱导IAA(indole-3-acetic acid)运输增强和积累,进而促进不定根的形成[66]。在拟南芥atabcb14突变体中,生长素运输的减少可能引起花序茎中维管束发育的轻微中断,导致花序轴中维管束和木质部发育不正常[67]。拟南芥AtABCC5及其同源物具有运输六磷酸肌醇的能力[68]。在atabcc5突变体植株中回补AtABCC5可以恢复保卫细胞对ABA(abscisic acid)的敏感性,推测其可能通过对六磷酸肌醇的转运参与了气孔调节[68]。葡萄中的ABCC亚家族的VvABCC1具有转运花青素的功能[69]。定位于液泡膜的VvABCC1在浆果发育和成熟过程的外果皮中持续表达,并且在成熟期开始时表达量最高[69]。从表达VvABCC1的酵母细胞中分离出的微粒体表明其可以通过ATP和谷胱甘肽转运氯化锦葵色素3-葡糖苷[69]。镉和铅处理使拟南芥根中ABCC亚家族的AtATM3基因表达上调,并且AtATM3过表达植株对镉的抗性增强,而atatm3突变植株对镉的敏感性高于野生型,并推测它可能介导谷氨酰胺合成酶-Cd(II)复合物跨线粒体膜的运输[70]。
3 酰基辅酶A结合蛋白(ACBPs)
3.1 植物ACBPs分类及亚细胞定位
作为酰基辅酶A的主要载体蛋白,ACBPs具有一个高度保守的酰基辅酶A结合域(acyl-CoA-binding domain,ACB),能够结合碳链长度区间为C12-C26的酰基辅酶A[71]。此外,ACB还具有结合磷脂酸(phosphatic acid,PA)、磷脂酰胆碱(phosphatidyl cholines,PC)、磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)、磷脂酰丝氨酸(phosphatidylserine,PS)、磷脂酰肌醇(phosphatidylinositol,PI)等磷脂的能力[71]。目前已经在几乎所有真核生物及一些原核生物和病毒中发现编码ACBPs的基因[71]。在植物中,根据功能域组成和分子量大小将ACBPs分成4类:第一类是只具有一个ACB的小分子量ACBPs(Small ACBPs);第二类是具有N端ACB和C端ankyrin结构域的大分子量ACBPs(ANK-ACBPs);第三类是只具有一个ACB的大分子量ACBPs(Large ACBPs);第四类是具有N端ACB和C端kelch结构域的大分子量ACBPs(Kelch-ACBPs)[5]。在模式植物拟南芥和水稻中,大量研究结果表明ACBPs不仅在维持细胞内脂类代谢稳态中发挥重要作用,而且通过其酰基辅酶A和磷脂结合能力来参与调控植物生长发育,包括早期胚胎发生和叶片衰老,以及响应各种生物胁迫和非生物胁迫,如重金属胁迫,氧化胁迫,低温胁迫和病原体感染等[5]。
与LTPs和ABC transporter一样,ACBPs发挥作用的机制也受制于它的亚细胞定位。在植物中,只有拟南芥和水稻中四类ACBPs的亚细胞定位已经全部明确(图1),其他物种中只有部分报道。在现有研究中,所有第一类ACBPs都定位于细胞质,包括拟南芥(AtACBP6)、水稻(OsACBP1-3)、甘蓝(BnACBP)、小球藻(ChACBP1)、巴西橡胶树(HbACBP1)和向日葵(HaACBP6)[72-77];第二类 ACBPs在拟南芥(AtACBP1、AtACBP2)和水稻(OsACBP4)中均定位于细胞膜和内质网[73,78-79],但是在巴西橡胶树(HbACBP2)中只定位于内质网[76];第三类ACBPs在拟南芥(AtACBP3)中具有多样的亚细胞定位,如质外体、细胞膜和内质网与高尔基复合体周围[80],而水稻OsACBP5只定位于质外体,油桐VfACBP3A、VfACBP3B定位于内质网[81-82],葡萄第三类VvACBP则主要分布在细胞边际和细胞骨架上[83];第四类ACBPs在拟南芥(AtACBP4、AtACBP5)中定位于细胞质[84],在水稻(OsACBP6)中定位于过氧化物酶体[73]。
从以上亚细胞定位分布来看,第一类小分子量ACBPs在包括低等植物以及单双子叶植物在内的多种植物中均定位于细胞质,可见其功能具有保守性。尽管第二类ACBPs在不同的植物中的亚细胞定位有差别,但是这些细胞器都属于内膜系统,因此可以推测第二类ACBPs发挥作用的位点是内膜系统。第三类和第四类ACBPs的亚细胞定位具有多样性,涉及多个细胞器,如内膜系统、质外体、细胞骨架、细胞质和过氧化物酶体。因此,综合考虑四类ACBPs在多种植物中的亚细胞定位可以发现,植物ACBPs作用位点分布广泛,几乎涉及到脂类代谢途径中的所有细胞器。
3.2 植物ACBPs参与植物生长发育过程
众所周知,脂类代谢是生物体内至关重要的代谢途径之一。由ACBPs介导的脂质运输途径除了在维持体内脂类代谢稳态中发挥重要作用之外还参与调控多种生理过程。到目前为止,植物ACBPs功能研究进展仍然是大部分来源于对模式植物拟南芥和水稻ACBPs家族的研究。
在胚发育过程中,第二类拟南芥AtACBP1和AtACBP2和第一类水稻OsACBP2都发挥了重要作用。尽管属于不同类别,但是它们的转录本在胚发育阶段大量积累[85-86]。拟南芥AtACBP1和AtACBP2共同缺失会破坏内质网和细胞膜之间18:0-CoA、MGDG(monogalactosyldiacylglycerol)和大部分磷脂运输,因此对胚的发育造成致死性效应[85-86]。此外,在ABA介导的种子休眠和萌发途径中,过量表达AtACBP1提高PA含量,促进ABA信号传导,进而调控种子休眠和萌发以及后续的幼苗生长发育[85]。过量表达水稻OsACBP2显著提高种子中三酰甘油和长链脂肪酸含量并促进籽粒生长和重量增加[87]。与之相对应的是OsACBP2缺失导致种子萌发率下降并延迟,同时籽粒生长和重量均下降[87]。在其他植物中也有关于ACBPs对种子脂类成分的影响的报道,比如过表达第一类甘蓝BnACBP拟南芥种子油中多不饱和脂肪酸增加,推测BnACBP可能参与了脂肪酸延伸和去饱和途径中酰基辅酶A库和PC库之间的酰基交换进而促进饱和脂肪酸和二十碳烯酸合成多不饱和脂肪酸[74]。第一类向日葵HaACBP6体外重组表达后与各种酰基辅酶A酯和磷脂在体外的特异性结合表明HaACBP6可能参与葵花籽油的合成[77]。
由于ACBPs功能缺失或增强引起的脂类代谢变化导致的生理效应不仅局限于种子发育,例如,AtACBP1与STEROL C4-METHYL OXIDASE1相互作用共同调节脂肪酸和固醇稳态,进而调控转录因子homeodomain-leucinezipperIV的表达变化[88]。AtACBP3通过与PE相互作用调节膜磷脂代谢和ATG8的稳定性,从而调节自噬介导的叶片衰老[89-90]。拟南芥同时缺失3个定位于细胞质的AtACBP4、AtACBP5和AtACBP6导致花粉中脂滴含量下降,同时伴随花粉萌发率下降[91]。水稻缺失OsACBP6导致18:3-CoA大量积累,并且破坏ROS(reactive oxygen species)稳态导致生长发育缓慢[92]。
3.3 植物ACBPs在胁迫响应中的重要作用
在胁迫响应中,由ACBPs介导的脂质运输途径也发挥了不容忽视的作用。过表达AtACBP1的拟南芥植株和过表达AtACBP1和AtACBP4的转基因油菜均对Pb(II)具有耐受性[93-94]。与此同时,过表达AtACBP2的拟南芥植株对Cd(Ⅱ)和氧化胁迫(如H2O2)的耐受力更强[86]。在这两项研究中,ACBPs利用结合膜修复前体18:2-CoA和18:3-CoA的能力,对重金属胁迫对细胞膜造成的脂质过氧化进行及时修复,从而提高对重金属的耐受性[86,93-94]。AtACBP3通过与长链脂肪酸结合调节糖基肌醇磷酰基神经酰胺(glycosylinositol phosphorylceramides)的合成,进而参与植物对低氧胁迫的响应[95]。AtACBP1和AtACBP6能够利用脂质运输能力响应低温胁迫[72,96]。过表达AtACBP1的拟南芥植株PC含量降低和PA含量升高,而过表达AtACBP6的拟南芥植株和atacbp1突变体与其相反,推测两者可能通过与PA的结合维持细胞膜的稳定性从而提高拟南芥的抗冻性[72,96]。
在大分子量ACBPs中,除了ACB功能域之外,还有ankyrin repeats和kelch motif这样的功能域[5]。这些额外的功能域赋予大分子量的ACBPs与其他蛋白质发生相互作用的能力[97]。例如,拟南芥过表达AtACBP2对ABA的敏感性增加,致使保卫细胞ROS的产生促进气孔关闭,从而减少水分流失和增强耐旱性[98]。另外,在低氧条件下,Ⅶ类乙烯响应因子与AtACBP1和AtACBP2发生解离进入细胞核激活低氧反应基因的表达,进而提高植株对低氧的耐受性[99]。拟南芥AtACBP2和AtACBP4分别通过ankyrin repeats和kelch motif与乙烯响应元件结合蛋白相互作用在植物防御方面发挥生物学功能[100-101]。在生物胁迫方面,也具有重要的作用。如在水稻中,植物病原菌可以诱导OsACBP5的表达,且过表达OsACBP5的拟南芥植株对部分细菌病害和真菌病害的抗病性增强,蛋白质组学分析表明OsACBP5通过上调生物胁迫相关蛋白的表达增强对多种植物病原菌的抗性[102]。拟南芥过表达AtACBP3对丁香假单胞菌引起的细菌性斑疹病的抗性增强[103],且AtACBP3与PE结合调节自噬体的形成和ATG8的稳定性参与真菌感染期间的防御反应[89]。
除拟南芥和水稻之外的植物ACBPs的功能研究也取得较大进展。尽管相关基因的作用机制并没有得到深入研究,但是大量的多物种证据进一步证实植物ACBPs参与了植物生长发育和胁迫响应,并发挥重要的作用。例如在小球藻[75]和葡萄[83]中,也发现ACBPs有抵抗低温胁迫的能力,且过表达相关基因可以提高植株对氧化胁迫的耐受性。此外,有些物种中ACBPs基因功能尚不明确,但是基因表达受到多种胁迫的诱导,如棉花GhACBP1、GhACBP3和GhACBP6[104]以及苹果MdACBP2[105]。
4 总结与展望
植物脂类代谢途径的研究进展主要依赖于对双子叶模式植物拟南芥中相关蛋白质的功能研究。拟南芥脂类代谢途径已经得到深度解析,从脂类物质合成到脂类物质降解,以及过程中的脂类物质运输,大部分环节涉及到的蛋白质功能已经明确。随着测序技术的不断提高,成本降低,大量的植物基因组已经公布。到目前为止,可以获取包括拟南芥在内的46种双子叶植物、包括水稻在内的28种单子叶植物以及多种裸子植物和低等植物的基因组序列。结合生物化学、分子生物学和遗传学等方法,拟南芥之外植物物种中脂类代谢相关基因逐渐走进大家的视野,然而它们的作用机制尚待深入研究。本文综述了不同植物中LTP、ABC transporter和ACBP三类脂类转运蛋白研究进展。基因组数据显示这三类转运蛋白在植物中都以多基因家族的形式存在。现有报道中前两者中只有部分成员直接参与到脂类代谢途径中,而ACBP家族成员几乎全部与脂类代谢相关。在不同的亚细胞位置上,这三类主要的脂类转运蛋白在脂类物质运输方面发挥了重要作用。在不同的植物中,除个别基因外,大部分基因的亚细胞定位和基因功能都是比较保守的。然而,正是由于这些亚细胞定位或功能不保守基因的存在让研究人员意识到植物脂类代谢途径在不同植物物种间是存在差异的,而这些差异基因必将会成为全面揭示植物脂类代谢途径的重点研究对象。
在今后的研究中,以下方面值得我们予以关注,首先,因为拟南芥和水稻在遗传转化和突变体资源方面具有优势,并且二者被认为是双子叶和单子叶的模式植物,所以大部分基因功能的研究都是基于以上两种植物展开,或者是在这两种植物中进行异源表达挖掘基因功能。随着CRISPR/Cas9技术的普及,在其他植物中进行本源基因功能研究也变得触手可及。因此,在比较单双子叶脂类物质代谢途径研究中应尽可能收集多物种基因功能证据进行归纳总结。其次,着重对在进化过程中发生功能分化的基因进行功能研究并挖掘其进化意义。单双子叶植物在100多个百万年前发生分化,如果能在功能分化基因当中挖掘出能反映进化历程的关键基因,那么将为单双子叶进化机制提供有力证据。最后,大多数脂类代谢相关基因都不同程度地参与了植物生长发育调控和胁迫响应,然而,只在少数研究中揭示了脂类代谢在这些过程中的作用机制。因此,在今后研究脂类代谢相关基因在生长发育或胁迫响应中的作用机制过程中,应同时考虑该基因对脂类代谢的影响,从而探明脂类代谢在生长发育和胁迫响应中的重要作用。

