MS培养基不同成分对马铃薯脱毒试管苗生长的影响
贾小霞,齐恩芳,刘 石,黄 伟,吕和平,文国宏,马 胜
(1甘肃省农业科学院马铃薯研究所,兰州730070;2甘肃省马铃薯种质资源创新工程实验室,兰州730070;3农业农村部西北旱作马铃薯科学观测实验站,甘肃渭源748201)
0 引言
随着马铃薯主粮化战略的推进,马铃薯种植面积日益增加[1]。然而,在马铃薯生产中,病毒病的普遍发生导致马铃薯的产量降低和商品性状退化,而且随着种植年限的增加逐年加重,严重制约着马铃薯产业的持续、健康发展[2-3]。马铃薯脱毒种薯的繁育和推广可以从根本上抑制病毒病的发生和蔓延,是马铃薯产业发展的重要保障[4-5],脱毒试管苗的扩繁是脱毒种薯繁育的一个重要环节[6-7],培养基是脱毒试管苗生产的基础[8]。目前,马铃薯(SolanumtuberosumL.)试管苗快繁大多采用MS培养基,培养基中营养成分是影响试管苗生长的重要因素,不同品种对营养元素的需求也有差异[9]。‘费乌瑞它’较适应含高氮、磷、钾的MS培养基,‘中薯3号’较适应常规含量的MS培养基[10],‘新大坪’在含9 mmol/L氯化钙的MS培养基上生长状态最佳[11],‘克新13号’和‘克新1号’在仅含大量元素的MS培养基上叶大色绿,株高和茎粗均与常规培养基上的脱毒苗无显著差异[12],生长在缺P培养基上的‘鄂马铃薯3号’脱毒苗的植株生长形态、生物产量均较缺N高[13]。在保证高质量的前提下,降低成本有利于脱毒种苗与种薯的产业化发展,不添加有机物(包括肌醇)的MS培养基与全量添加的MS培养基上生长的试管苗的农艺性状基本一致[14],本课题组的长期生产试验也证实了这一观点,为了节省成本,生产中大都用不添加有机物的MS培养基替代全量添加的MS培养基。可以看出,为了节省成本和简化试验,前人做了大量研究,但不同品种对营养元素的需求存在较大差异。‘陇薯7号’因为其抗病、高产、优质、广适的特点,被农业部确定为2014年主导品种,不仅在甘肃省每年种植面积超过13.33万hm2,在陕西、宁夏和青海等其他西北地区也有大面积种植[15],近几年在广东、广西、福建等南方冬作区也有较大面积的种植[16]。‘陇薯20号’是具有抗病、优质、高产等特性的早熟新品种,具有很好的应用前景,筛选这2个品种脱毒苗快繁的最佳培养基,是满足全国脱毒种薯全覆盖的重要基础,但关于这2个品种培养基的优化试验目前尚未见报道。因此,本研究以‘陇薯7号’和‘陇薯20号’脱毒试管苗为试验材料,以MS为基本培养基,研究缺钙、铁和微量元素对试管苗生长的影响,旨在筛选‘陇薯7号’和‘陇薯20号’脱毒苗高效低成本快繁培养基的同时,为马铃薯脱毒苗快繁生产中培养基的进一步优化提供一定的理论依据。
1 材料与方法
1.1 试验材料
供试材料马铃薯栽培品种‘陇薯7号’和‘陇薯20号’,为甘肃省农业科学院马铃薯研究所种质资源与生物技术研究室继代培养的脱毒苗,每25~30天在MS培养基上继代繁殖1次,培养温度为23±2℃,光照强度为2000~2500 lx,光照周期为16 h/d。
1.2 试验方法
1.2.1 试验设计 分别设含MS培养基不同成分的培养基8组,培养基成分见表1。所有处理均添加4.5 g/L琼脂,30 g/L白糖,调节pH 5.8~6.0。在无菌条件下,选取生长健壮的马铃薯试管苗,切成带1个腋芽的茎段,接种到上述8种培养基中,每瓶接10株,每个处理12瓶,3次重复。接种后将培养瓶放置于培养室,在23±2℃、光照周期为16 h/d的条件下培养,第30天时,进行相关指标的测定。试验于2020年2—8月份在甘肃省农业科学院马铃薯研究所组织培养室进行。

表1 培养基
1.2.2 测定项目 试管苗培养30天时进行取样调查,每个处理随机抽取3瓶,测定株高(cm)、活叶数(片/株)、茎粗(mm)、植株鲜重(mg/株)、植株干重(mg/株)。采用直尺测量植株株高(植株茎基部到生长点的高度,cm);采用数显游标卡尺测量茎基部的直径即为茎粗(mm)、根茎叶干重(mg)采用烘干法测定,即测完鲜重(mg)后,于105℃杀青30 min后,80℃烘干至恒重。
叶绿素含量的测定:取新鲜的试管苗0.25 g,加入少量CaCO3和石英砂,加入1 mL 80%的丙酮研磨成匀浆,转入15 mL离心管中,再用5~8 mL 80%的丙酮洗涤研钵,一并转入离心管,在避光环境下静置数小时,待组织变白后进行离心,离心后弃沉淀,上清液用80%的丙酮定容到10 mL后,使用UV-5800型紫外分光光度计测定663 nm和645 nm处的OD值,以80%的丙酮调零。
1.2.3 数据处理 数据整理采用Microsoft Excel 2010;单因素方差(One-way analysis,ANOVA)统计分析采用DPS V3.01软件;差异显著性采用Duncan’s法进行分析。
2 结果与分析
2.1 缺微量元素对试管苗生长的影响
与1号相比,2号培养基缺微量元素。接种13天时,两品种在1号和2号培养基上的试管苗都叶色浓绿,植株生长正常;培养30天时,两品种在2种培养基上的试管苗仍叶色浓绿,植株生长正常,‘陇薯7号’的株高、茎粗、叶片数、茎叶鲜干重和叶绿素含量在两处理间无显著差异(表2和图3);‘陇薯20号’的茎粗、叶片数、茎叶鲜干重和叶绿素含量在两处理间无显著差异,但1号培养基上试管苗的株高显著高于2号(表3和图3)。
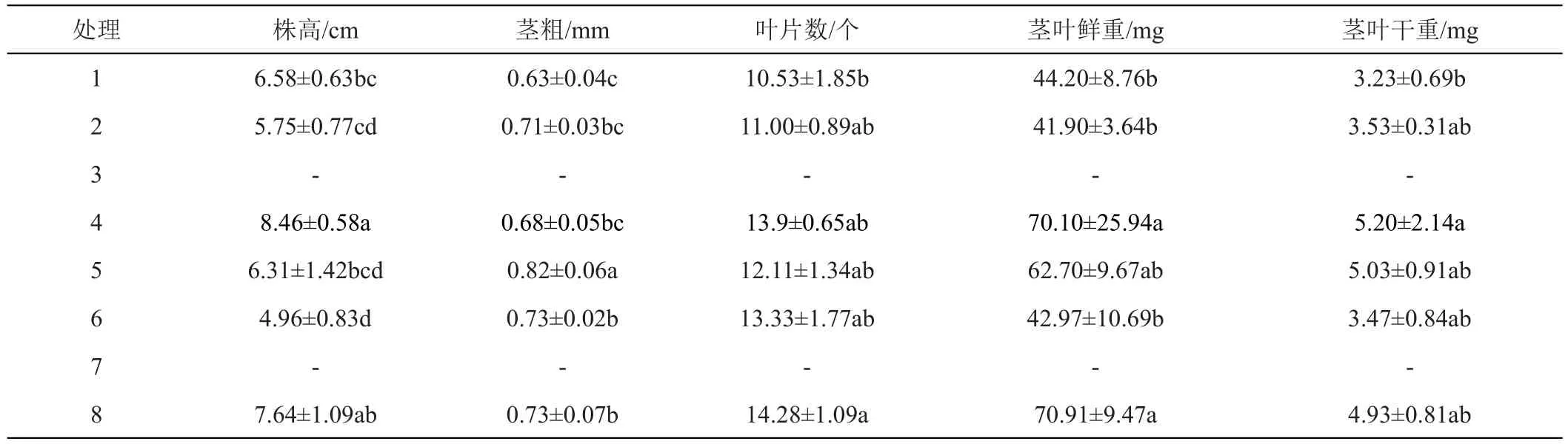
表2 MS培养基不同成分对‘陇薯7号’试管苗生长的影响
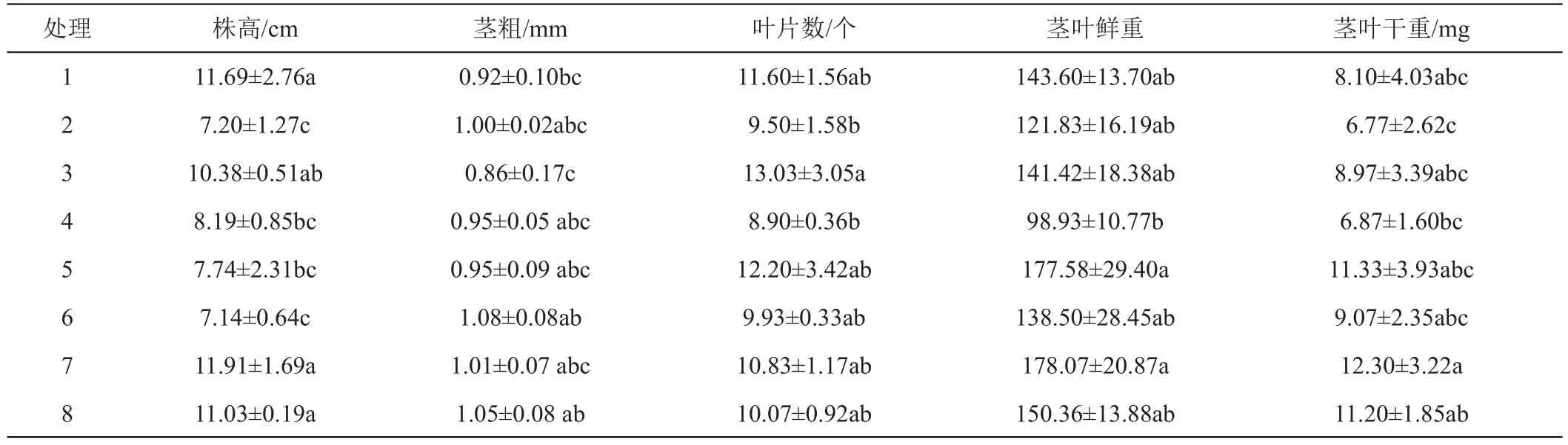
表3 MS培养基不同成分对‘陇薯20号’试管苗生长的影响
2.2 缺铁对试管苗生长的影响
与1号相比,3号培养基缺铁。接种13天时,‘陇薯7号’在1号培养基上的试管苗叶色浓绿、植株生长正常,3号培养基上的试管苗虽发出新芽,但叶片白化,植株生长受阻(图1 A);‘陇薯20号’在2种培养基上的试管苗叶色浓绿、植株生长正常(图2 A)。培养30天时,‘陇薯7号’在1号培养基上的试管苗仍叶色浓绿,生长正常,而3号培养基上的试管苗叶片白化,植株全部死亡(图1 B);‘陇薯20号’在2种培养基上的试管苗都叶色浓绿,植株生长正常,且株高、茎粗、叶片数、茎叶鲜干重和叶绿素含量在两处理间无显著差异(表3和图3)。

图1 ‘陇薯7号’试管苗

图2 ‘陇薯20号’试管苗
2.3 缺钙对试管苗生长的影响
与1号相比,4号培养基缺钙。接种13天时,2个品种在1号和4号培养基上的试管苗都叶色浓绿、植株生长正常(图1A、图2A)。培养30天时,2个品种在2种培养基上的试管苗仍叶色浓绿,植株生长正常。‘陇薯7号’植株的茎粗和叶片数在各处理间无显著差异,而4号培养基上的试管苗株高、茎叶鲜干重均显著高于1号(表2),叶绿素含量显著低于1号(图3);‘陇薯20号’植株的茎粗、叶片数和茎叶鲜干重在两处理间无显著差异,1号培养基上的试管苗株高显著高于4号(表3),但4号培养基上的试管苗叶绿素含量显著高于1号(图3)。
2.4 同时缺乏微量元素和铁盐对试管苗生长的影响
与1号相比,5号培养基同时缺乏微量和铁盐。接种13天时,‘陇薯7号’在5号培养基上的试管苗株高稍低于1号,但叶色浓绿、植株生长正常;‘陇薯20号’在2种培养基上都叶色浓绿、植株生长正常。培养30天时,两品种在2种培养基上的试管苗仍叶色浓绿,植株生长正常,‘陇薯7号’除株高和叶绿素含量在两处理间无显著差异外(表2、图3),5号培养基上试管苗的茎粗、叶片数和茎叶鲜干重均高于1号(表2);‘陇薯20号’植株的株高在5号培养基上显著低于1号,叶绿素含量显著高于1号,茎粗、叶片数和茎叶鲜干重在两处理间无显著差异(表3、图3)。
2.5 同时缺乏微量和钙盐对试管苗生长的影响
与1号相比,6号培养基同时缺乏微量和钙盐。接种13天时,两品种在2种培养基上的试管苗都叶色浓绿、植株生长正常,但6号培养基上的株高略低于1号(图1A和图2A)。培养30天时,两品种在2种培养基上的试管苗仍叶色浓绿,植株生长正常。‘陇薯7号’在6号培养基上的株高显著低于对照,茎粗显著高于1号,叶片数、茎叶鲜干重和叶绿素含量与1号无显著差异(表2和图2);‘陇薯20号’在6号培养基上的株高和叶绿素含量分别显著低于和高于1号(表3和图3),但茎粗、叶片数、茎叶鲜干重在两处理间无显著差异(表3)。

图3 MS培养基不同成分对试管苗叶绿素含量的影响
2.6 同时缺乏铁盐和钙盐对试管苗生长的影响
与1号相比,7号培养基同时缺乏铁盐和钙盐。接种13天时,‘陇薯7号’在1号培养基上的试管苗叶色浓绿、植株生长正常,7号培养基上的试管苗叶片白化,茎叶发黄,植株生长缓慢;‘陇薯20号’在2种培养基上的试管苗都叶色浓绿、植株生长正常(图1A、图2A)。培养30天时,‘陇薯7号’在1号培养基上的试管苗仍叶色浓绿,生长正常,而7号培养基上的试管苗叶片白化,植株全部死亡(图1B);‘陇薯20号’在2种培养基上的试管苗均叶色浓绿,植株生长正常,7号培养基上试管苗的株高、茎粗、茎叶鲜干重和叶绿素含量都高于1号(表3和图3)。
2.7 试管苗在只含MS大量元素培养基上的生长情况
与1号相比,8号培养基只含MS大量元素。接种13天时,2个品种在1号培养基上的试管苗叶色浓绿、植株生长正常,在8号培养基上的试管苗茎叶微黄;培养30天时,2个品种在2种培养基上的试管苗均叶色浓绿,植株生长正常,‘陇薯7号’在8号培养基上试管苗的株高、茎叶干重和叶绿素含量高于1号培养基,但未达到显著水平,而茎粗、叶片数和茎叶鲜重均显著高于1号(表2、图3)。‘陇薯20号’在8号培养基上的叶绿素含量显著高于1号(图3),株高、茎粗、叶片数和茎叶鲜干重与1号无显著差异(表3)。
3 讨论与结论
MS培养基是马铃薯组织培养中最为常用的基本培养基之一[17],培养基的成分主要包括大量元素(KNO3、NH4NO3、MgSO4·7H2O、KH2PO4)、钙盐(CaCl·2H2O)、微量元素(MnSO4·H2O、ZnSO4·H2O、H3BO3、KI、NaMoO4·2H2O、CoCL2·6H2O、CuSO4·5H2O)、铁盐(Na2EDTA、FeSO4·7H2O)、有机(烟酸、VB6、VB6和甘氨酸)和肌醇。培养基成分直接影响试管苗的生长[18]。铁是叶绿素形成不可缺少的元素,在植株体内很难转移,铁元素的缺乏会改变叶绿素的合成,使植物叶片黄化,表现为“失绿症”[19]。本研究中,2个参试品种(‘陇薯7号’和‘陇薯20号’)对铁元素缺乏的反应不一样。以除去有机的MS培养基为对照,接种在不添加铁盐培养基上的‘陇薯7号’试管苗茎叶白化,生长完全被抑制,这与陈永波[20]关于缺铁抑制鄂马铃薯3号脱毒试管苗生长的研究结果一致;而‘陇薯20号’在不添加铁盐的培养基上培养时,植株生长正常,且株高、茎粗、叶片数、茎叶鲜干重和叶绿素含量与对照无显著差异,这说明马铃薯不同品种对铁元素的需求量有很大的差异。
钙是植物生长发育必不可少的一种大量元素[21],适量浓度的钙对植物的生长是有益的,可增加植株鲜重、干物质含量、根冠比和形成壮苗,植物缺钙时,生长旺盛组织的生长会受到抑制,导致植株高度、叶片数量及生物产量下降[22]。本研究发现,接种在不添加钙盐的培养基上时,2个品种都能正常生长,‘陇薯7号’试管苗除叶绿素含量低于对照外,株高、叶片数、茎叶鲜干重均显著高于对照,这与杜强[11]等关于缺钙导致马铃薯栽培品种‘新大坪’试管苗的株高、叶片数、茎叶和根鲜干重均显著低于常规MS培养基上生长植株的结果不尽一致。‘陇薯20号’的株高显著低于对照,这与杜强[11]等关于缺钙不利于‘新大坪’试管苗生长的研究结果基本一致。这表明钙元素对马铃薯试管苗的生长有促进作用,缺钙对生长的影响因品种各异。有趣的是,‘陇薯20号’在同时缺乏铁盐和钙盐的培养基上培养时,株高、茎粗、茎叶鲜干重和叶绿素含量都高于对照,意味着铁盐和钙盐在‘陇薯20号’试管苗的生长过程中有相互协同作用,这还有待进一步研究。
微量元素在植物的生长发育中需求较少,但对植物的生长发育却产生重要作用,特别是在植物的光合作用、呼吸作用、能量代谢等重要生理过程中起着至关重要的作用。陈永波[20]等采用不完全营养液法研究微量元素的缺乏与过量对脱毒马铃薯苗生长的影响时发现营养液中缺乏锰元素时,会表现出叶片较小,舒展不开,且出现卷曲,缺少Cu、Zn、Mo时无明显症状表现。本研究发现,以除去有机的MS培养基为对照,全量省去微量元素对‘陇薯7号’没有产生明显的不利影响,试管苗的株高、茎粗、叶片数、茎叶鲜干重和叶绿素含量等各指标与对照无显著差异,这与刘卫平[12]以‘克新13号’和‘克新1号’为材料的研究结果一致。‘陇薯20号’在全量省去微量元素或同时省去钙盐和微量元素的培养基上培养时,除株高显著低于对照外,茎粗、叶片数和茎叶鲜干重与对照无显著差异,这与陈永波[13]以‘鄂马铃薯3号’脱毒试管苗为研究对象时,缺乏微量元素导致植株叶片先出现褐色斑点直至最后形成烂叶的研究结果不同,这种不同可能来源于品种的差异;在只含MS大量元素的培养基上培养时,‘陇薯7号’和‘陇薯20号’在前期均出现茎叶微黄的现象,但随着培养时间的延长,微黄现象逐渐消失,培养30天时,‘陇薯7号’的株高、茎粗、叶片数、茎叶鲜干重和叶绿素含量都高于对照,‘陇薯20号’的各指标与对照无显著差异。为了保证试管苗质量,通过比较所设8种培养基上试管苗的生长指标,发现‘陇薯7号’和‘陇薯20号’分别可以在MS大量元素+4.5 g/L琼脂+30 g/L白糖和MS大量元素+微量元素+4.5 g/L琼脂+30 g/L白糖的培养基上高效快繁。
本研究只对‘陇薯7号’和‘陇薯20号’的快繁培养基进行了研究,但马铃薯不同品种对培养基中营养成分的需求存在较大差异,为了达到高效低成本的快繁目的,在实际生产中应针对不同品种进行进一步优化。与生产中普遍用常规MS全量培养基快繁试管苗相比,用只含大量元素的MS培养基快繁全国主导品种‘陇薯7号’脱毒试管苗,不仅操作简单、而且大幅度降低了成本,为满足国家马铃薯脱毒种薯全覆盖的需求奠定了基础。

