接种平滑白蛋巢菌对蒿柳根系分泌物代谢组的影响
马晓东,李 霞,2,邹竣竹,白媛媛,孙振元,韩 蕾*
(1. 中国林业科学研究院林业研究所国家林业局林木培育重点实验室,北京 100091;2. 菏泽学院农业与生物工程学院(牡丹学院),山东,菏泽 274000)
多环芳烃(PAHs)是一类具有致癌、致畸、致突变效应的有机污染物,可在水体、土壤或沉积物中积累,被植物吸收而进入食物链中,通过生物富集作用对人类健康产生极大威胁[1-2]。在PAHs污染的诸多修复方法中,生物修复具有绿色环保、成本低、大面积应用等优点[3-4],是目前最具潜力的方法之一。一般来说,PAHs的环数越高,其化学结构越稳定、疏水性越高,单一利用植物或白腐真菌对PAHs去除能力有限[5-7]。近来的研究表明,植物-白腐真菌联合修复是一种高效的PAHs污染土壤的生物修复方法,能有效去除高分子量PAHs[8]。但目前植物-白腐真菌联合修复策略的作用机理尚不完全清楚。
虽然植物从土壤中吸收和积累PAHs的能力有限,但植物能促进根际土壤环境中PAHs的降解,学者推测可能是植物和根际微生物相互协作的结果[9]。据报道,植物约20%的光合产物用于根部合成有机分子,并以根系分泌物的形式释放到土壤中[10]。根系分泌物主要成分有低分子量有机酸(LWMOAs)、氨基酸、糖、酰胺、脂族酸、芳香酸、醇、酮和烯烃等,这些代谢物为植物根际土壤微生物提供碳源和氮源,包括PAHs降解菌,增加微生物的生物量和活性[11-13],从而提高PAHs的降解率。此外,LWMOAs、氨基酸、糖类均在PAHs脱附方面有显著效果,从而提高了PAHs的溶解度和生物可利用度,加速土壤中PAHs的降解[14-16]。研究表明[17],低分子量PAHs处理下玉米的光合作用增强,玉米根系分泌物组分及其含量也趋于增加。目前尚不清楚接种平滑白蛋巢菌对蒿柳根系分泌物的影响,后者是影响根际PAHs降解菌生长的重要因素。
近来,在环境学科中使用的非靶向代谢组学引起了生物学者们的广泛关注,代谢组技术的进步使研究人员能够在短时间内分析一个样品中的数百种化合物。植物产生的代谢物范围比其他任何一类生物体都要广,代谢组学在植物科学中的重要性也相应更高[18]。利用非靶向代谢组学进行植物组织内代谢产物的研究日渐增多,但针对植物根系分泌物的代谢组学研究相对较少[13,19-22]。根际代谢组学的关键在于如何收集原生状态的根系分泌物。大多研究利用霍格兰营养液、石英砂等基质对植物进行培养并收集根系分泌物,这些方法的好处在于有效消除土壤环境的噪音干扰,但生长介质能影响根系形态、分泌的方式和代谢物组分[23]。同时,由于考虑到污染土壤修复实际情况,以及需要满足白腐真菌的定殖、生长和产酶条件时,需选择土壤作为培养基质。
基于此,本研究在温室中设置了为期60天的盆栽试验,选择蒿柳(Salix viminalisL.)和平滑白蛋巢菌(Crucibulum laeve)作为试验材料,试验材料的选择以及该组合体系的研究价值在先前研究[24]中有详细表述,利用自然衰减(NA),真菌修复(M),植物修复(P)和植物-微生物联合修复(PMR)等4种策略修复PAHs污染土壤,利用非靶向代谢组学定性和定量分析蒿柳的根际土壤代谢物,从根系分泌物的角度研究了PAHs污染土壤中蒿柳对平滑白蛋巢菌刺激的应答机理,以期为植物-白腐真菌联合修复的作用机理研究提供理论依据。
1 材料与方法
1.1 污染土壤、植物与真菌接种物
试验土壤取自北京郊区的农场(40°10′59″ N;116°27′21″ E),取样深度为场地0~20 cm内。该农场常年种植蔬菜和谷物,土壤是中国北方常见的黄褐色土。土壤运送至实验室后拌匀并室温下阴干,过2 mm网筛。土壤性质按国标测定,测得pH:8.7,CEC:23.1 cmol·kg-1,有机质:20.1 g·kg-1,总氮:972.0 mg·kg-1,菲:36.6 μg·kg-1,芘:17.4 μg·kg-1,苯并[a]芘:28.5 μg·kg-1,总PAHs:280.3 μg·kg-1。土壤中加入高纯度的菲、芘、苯并[a]芘(溶于丙酮,10%土壤质量)混合液并置于通风柜中,待丙酮完全蒸发后,将污染土壤和无污染土壤均匀混合,使土壤中菲、芘、苯并[a]芘的初始含量分别为约4 000 μg·kg-1、4 000 μg·kg-1、2 000 μg·kg-1,随后将污染土装入塑料箱中置于室温下老化6周,并再次过2 mm网筛。
植物修复材料为蒿柳,选取种植于中国林科院苗圃的蒿柳无性系一年生枝条,按直径1.0 ± 0.3 cm的规格,在水中剪成长度为12 cm的插条,随后将插条插入清水中吸足水分,再扦插于φ8 cm × 10 cm的营养钵中,栽培基质为草炭土∶珍珠岩=6∶1(v/v),定时浇水。发芽后在温室中继续培养4周,选择长势均匀良好的蒿柳扦插苗用于试验。
平滑白蛋巢菌(Crucibulum laeve)从中国普通微生物菌种保藏管理中心获取,将其接种到麦芽提取物培养基上,24℃下静置培养2周获取新鲜的接种物。随后,按照Reina等人[25]描述的方法进行固态发酵并做修改:选大麦种子作为纤维素基质载体,在1 000 mL锥形瓶中加72 g大麦种子和120 mL无菌水高压灭菌,然后将4个真菌琼脂板在80 mL无菌水(55% v/w)中混匀,取40 mL真菌接种物接种到大麦培养基,在24℃下静置培养4周。接种前将所有真菌接种物置入塑料桶中并混匀。
1.2 有机污染试剂
本试验中用到的甲醇、乙腈、乙酸铵与氨水购自德国CNW Technologies公司(ANPEL Laboratory Technologies(Shanghai)Inc.),均为LC-MS级别试剂。所用到的水是双重去离子后的超纯水,超纯水仪纯化系统为Millipore产品(Millipore, Bedford,MA)。内标:L-2-氯苯丙氨酸(2-Chloro-Lphenylalanine,纯度 ≥ 98%),购自上海恒柏生物科技有限公司。菲、芘、苯并[a]芘纯品(纯度高于分析级)为本试验的模式PAHs化合物。
1.3 试验设计
PAHs污染土壤修复试验在中国林业科学研究院科研温室中进行,温室温度20~28℃,16/8 h的光/暗周期。取若干相同规格的聚丙烯盆,总容积为5 L,每盆中单独堆放约5 kg受污染的土壤,4种处理分别为:a. 自然衰减(土壤不额外引入其他生物)(NA);b. 真菌强化(将大麦种子混入土壤中并移栽蒿柳,接种微量(0.05 g·pot-1)含有大麦培养基的平滑白蛋巢菌接种物)(M);c. 植物修复(土壤中种植蒿柳)(P);d. 植物-微生物联合修复(将大麦种子混入土壤中并移栽蒿柳,接种微量(0.05 g·pot-1)含有大麦培养基的平滑白蛋巢菌接种物(PMR)。应用于污染土壤的大麦种子:土壤质量比为0.6∶10。土壤水分保持在60%的田间持水量,需要定期称量,并添加蒸馏水,试验每周随机改变聚丙烯盆位置一次。在试验第60天进行土壤取样:取P和PMR处理蒿柳的根际土壤,取样方法是用手大力摇动蒿柳根部,在保持根部完整性的同时除去未附着在根部的外部土壤,留取附着在根部的土壤进行非靶向代谢组学分析;对NA和M处理的土壤样本也进行非靶向代谢组学分析,目的是剔除土壤环境噪音对根系分泌物分析的干扰,取样方法是用螺旋状取土钻从各处理的土壤剖面中抽取5个小样本,将小样本混合后过2 mm网筛。各处理均取6个重复,样品保存在-80℃用于代谢物的提取和检测。
1.4 代谢物的提取与检测
取超低温冷冻保存的土壤样本,对样本进行真空冷冻干燥。样本冷冻干燥后称取 100 mg样品,加入 1 000 μL提取液(甲醇∶乙腈∶水 = 2∶2∶1(v/v),含同位素标记内标混合物)后涡旋混匀30 s,在35 Hz条件下研磨4 min,冰水浴中超声提取5 min,在-40℃下静置 1 h。随后将样品在4℃下12 000 r·min-1离心15 min,取上清于进样瓶中用于液相色谱-质谱联用(LC-MS)分析。同时,所有样品另取等量上清混合成QC样品上机检测。在分析过程中,每6~10个检测分析样本中插入一个质控样本,以监测试验的重复性。
样品的检测使用了Vanquish (Thermo Fisher Scientific)超高效液相色谱仪,方法参照Wang,et al.[26]的描述。通过Waters ACQUITY UPLC BEH Amide (2.1 mm × 100 mm, 1.7 μm)液相色谱柱对目标化合物进行色谱分离。液相色谱A相为水相,含25 mmol·L-1乙酸铵和25 mmol·L-1氨水,B相为乙腈。梯度洗脱:0~0.5 min,95% B; 0.5~7 min,95%~65% B;7~8 min, 65%~40% B;8~9 min,40% B;9~9.1 min,40%~95% B;9.1~12 min,95% B。流动相流速:0.5 mL·min-1,柱温:25℃,样品盘温度:4℃,进样体积3 μL。
Thermo Q Exactive HFX质谱仪能够在控制软件(Xcalibur,Thermo)控制下进行一级、二级质谱数据采集。详细参数如下:鞘气流速:50 Arb,辅助气流速:10 Arb,毛细管温度:320℃,一级分辨率:60 000,二级分辨率:7 500,碰撞能:10/30/60 NCE 模式,喷射电压:3.5 kV (正离子)或-3.2 kV (负离子)。在进行LC-MS/MS检测时,同时结合使用了正离子模式(POS)和负离子模式(NEG)两种电离方式,这样可使代谢物覆盖率更高,检测效果更好。
1.5 代谢物的定性与定量
原始数据经ProteoWizard软件转成mzXML格式后,使用R包XCMS (3.2版本)进行峰识别、峰提取、峰对齐和积分等处理。然后对数据进行过滤,在一组样本(QC样本也是作为一组样品)中检测出该物质的样本数 ≥ 50%,就保留该物质(minifrac = 0.5)。对数据进行内标归一(即每个样本中,其它物质的峰面积除以(内标的峰面积/所有样品内标峰面积均值)[27]。与BiotreeDB(V2.1)自建二级质谱数据库匹配进行物质注释,对代谢物进行定性,算法打分的Cutoff值设为0.3。
1.6 数据分析
利用主成分分析(PCA)反映各处理间总体代谢物的差异以及组内样本间的变异度大小,对样品的代谢表型进行聚类。结合多元统计分析OPLSDA的变量投影重要性(VIP)和单变量统计分析t检验、p值来筛选各组样本间的显著差异代谢物[28]。显著差异的阈值设置为:VIP ≥ 1 且 t检验的p< 0.05。
2 结果与分析
2.1 LC-MS分析
试验第60天时,通过POS模式检测并鉴定了各处理样品中881种化合物,通过NEG模式检测并鉴定了各处理样品中828种化合物。将所有代谢物进行数据min-max标准化后进行聚类分析并绘制热图(图1),可直观展示各处理样品的代谢物组成和含量有明显差别。已鉴定的化合物包括丙酸、琥珀酸、苯甲酸、戊酸、庚酸、癸酸、山楂酸等有机酸,半胱氨酸等氨基酸,松二糖、蔗糖、葡萄糖、海藻糖等糖类,15-棕榈酸甲酯、5-羟基水杨酸酯等酯类;此外还有醇、酮、腺苷、酰胺、生物碱、醛等小分子代谢物。
2.2 蒿柳潜在根系分泌物组分的模式识别分析
采用主成分分析法(PCA)和正交偏最小二乘判别分析法(OPLS-DA),将已鉴定的代谢物进行聚类,以区分各处理间代谢物的变化,并鉴定潜在的根系分泌物组分。本研究利用PCA对P处理、NA处理样品的代谢表型进行了聚类,在PCA评分图(图2)中,每个数据点代表一个样品,聚集在一起的点具有比分开的点更相似的生化组成。图2A显示POS模式下P处理和NA处理间的样品能显著区分,表明蒿柳显著影响了根际土壤代谢物的组分和含量。随后应用OPLS-DA最大化各处理样品间差异,如图2所示,在POS模式和NEG模式下P处理和NA处理的样品均有明显的分离。应用OPLS-DA生成的载荷图和VIP评分(表1)来解释代谢模式,在POS和NEG模式下总共筛选到18种化合物并将其假定为根系分泌物组分,包括丙二酸、乙醛酸、邻苯二甲酸、4-甲基-2-氧戊酸、癸酸、十五烷酸、十六烷二酸、蓖麻油酸、棕榈油酸、反式亚油酸等有机酸,半胱氨酸等氨基酸,葡萄糖、海藻糖、松二糖等糖类,5-羟基水杨酸酯等酯类,此外还有脯氨酸甜菜碱、L-抗坏血酸2-磷酸钠、5′-甲硫腺苷等小分子代谢物。

表1 NA和P处理条件下土壤样品间差异显著的潜在根系分泌物组分Table 1 Potential root exudate components of soil samples between NA and P treatment (n = 6)
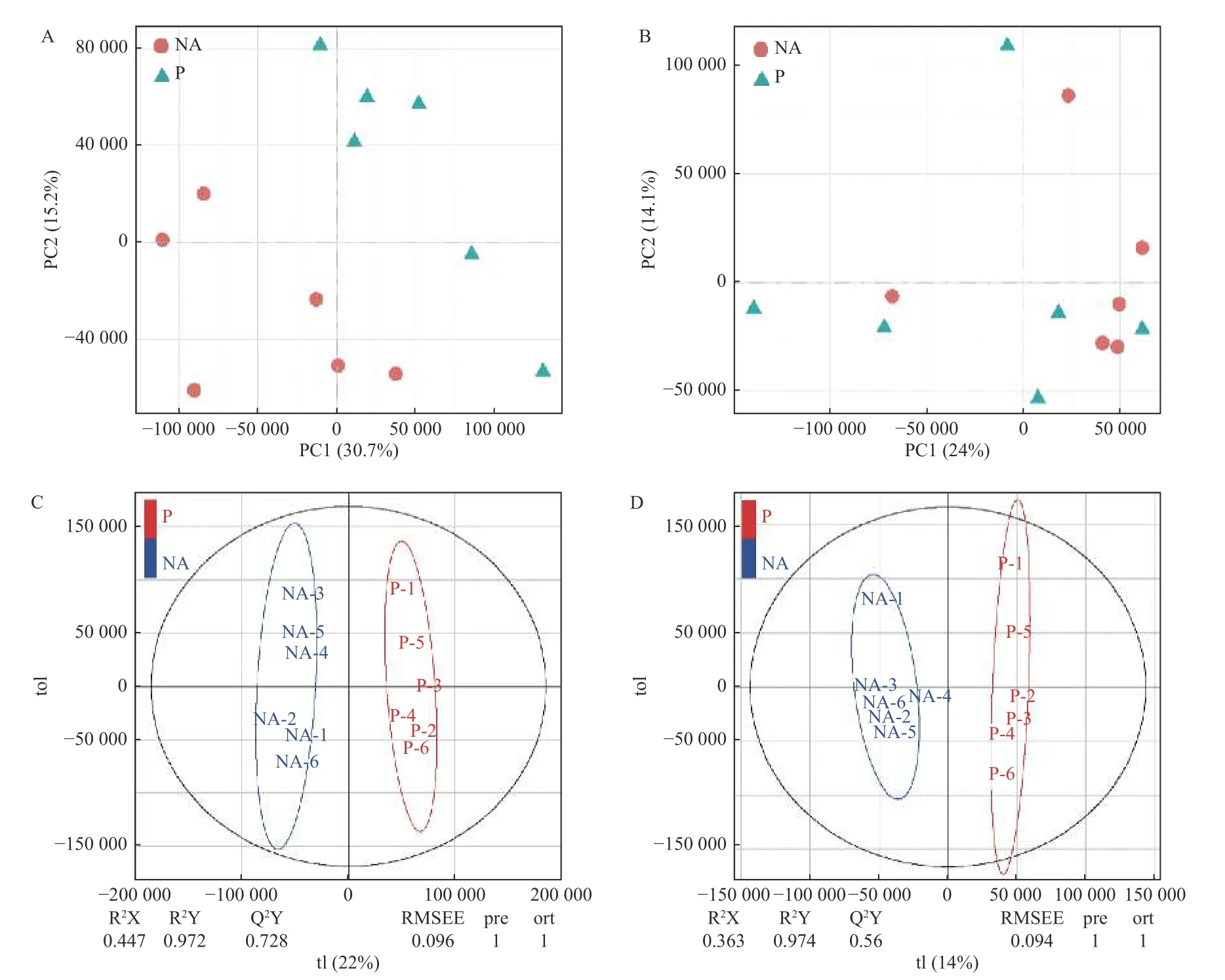
图2 蒿柳根际土壤代谢物的多元分析。POS模式下的(A)PCA评分图,(C)OPLS-DA评分图;NEG模式下的(B)PCA评分图,(D)OPLS-DA评分图Fig.2 Multivariate analysis of rhizosphere soil metabolites from S. viminalis. (A) PCA scores plots and (C) OPLS-DA scores plots of OPLS-DA under POS mode; (B) PCA scores plots and (D) OPLS-DA scores plots of OPLS-DA under NEG mode
2.3 各处理对土壤代谢物组分和含量的影响
采用PCA对NA、M、P、PMR处理样品的代谢表型进行分类,图3显示POS模式和NEG模式下各处理间的样品均能明显区分,表明各处理对土壤代谢物组分和含量均有不同影响。随后,采用OPLS-DA对各处理间样品两两比较生成的载荷图,结合VIP评分筛选差异代谢物。由图4可知,在POS模式下M处理、P处理相较于NA处理相对含量上调和下调的差异代谢物数量相当(相差 < 15),但在NEG模式下相对含量上调的代谢物数量远大于(相差 > 150)下调的代谢物数量;两种模式下,M处理相较于P处理样品相对含量上调的代谢物数量大于(相差 ≥ 50)下调的代谢物数量;两种模式下,PMR处理相比其它处理样品相对含量下调的代谢物数量都大于(相差32-186)上调的代谢物数量。
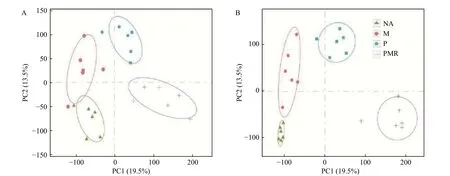
图3 各处理土壤样品代谢物的PCA评分图。(A)POS模式;(B)NEG模式Fig.3 PCA scores plots of soil metabolites among NA, M, P, and PMR treatments. (A) POS mode; (B) NEG mode
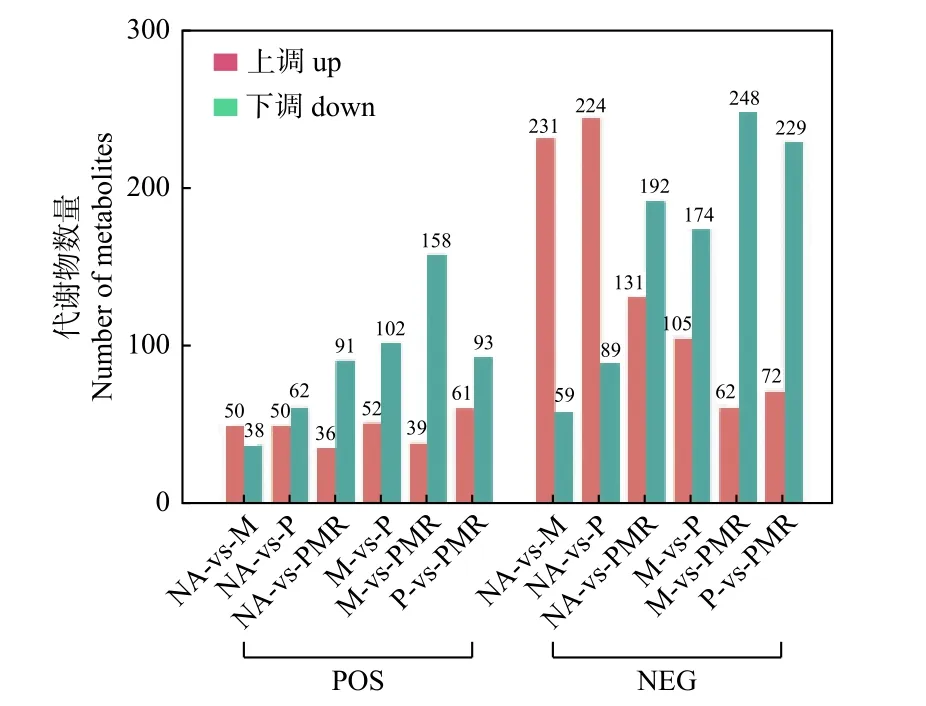
图4 各处理组间两两比较的差异代谢物统计Fig.4 Differential expression metabolites statistics for the pairwise comparison between treatments
2.4 各处理对18种潜在根系分泌物组分的影响
各处理对18种潜在根系分泌物组分的影响如图5所示。相比NA处理,M处理提高了十六烷二酸、半胱氨酸、5-羟基水杨酸酯、葡萄糖、4-甲基-2-氧戊酸、5′-甲硫腺苷、反式亚油酸、邻苯二甲酸、十五烷酸、棕榈油酸、癸酸、乙醛酸、蓖麻油酸、海藻糖、松二糖、L-抗坏血酸2-磷酸钠等16种代谢物的相对含量;PMR处理提高了十六烷二酸、半胱氨酸、5-羟基水杨酸酯、葡萄糖、4-甲基-2-氧戊酸、5′-甲硫腺苷、反式亚油酸、邻苯二甲酸、十五烷酸、棕榈油酸、癸酸等11种代谢物的相对含量,而其它代谢物的相对含量下降或变化不明显。PMR处理相较于P处理仅提高了葡萄糖和十五烷酸等2种代谢物的相对含量,相较于M处理提高了十六烷二酸、半胱氨酸、5-羟基水杨酸酯、葡萄糖、十五烷酸、棕榈油酸、癸酸和丙二酸等8种代谢物的相对含量。
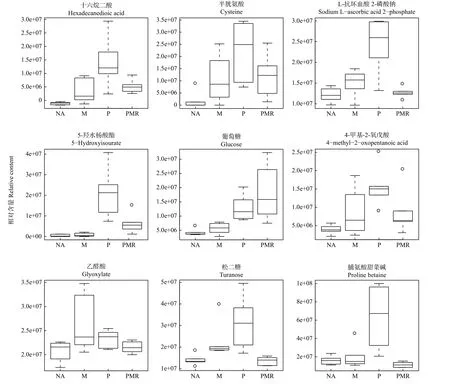

图5 18种根系分泌物组分的箱线图Fig.5 Box and whisker plot of 18 compounds from root exudates.
3 讨论
根际代谢组学旨在分析根土交互界面的全部代谢物,包括了植物根系分泌的诸如初生代谢物、化学信号分子等植物天然产物,以及根际土著微生物、外源微生物分泌的代谢产物[23]。本研究利用非靶向代谢组学对各处理的土壤样品进行了检测,在POS模式下鉴定了881种化合物,NEG模式下鉴定了828种化合物,但有许多色谱峰未被鉴定。在此基础上,本研究采用PCA和OPLS-DA两种方法对P处理蒿柳根际土壤样品和NA处理土壤样品的代谢物组成和含量进行了比较,结果显示蒿柳根际土壤的代谢谱发生明显变化,并鉴定了18种差异代谢物作为潜在根系分泌物组分。
与其它类似研究一致的是,本研究筛选的18种根系分泌物组分大多为有机酸[13,17]。其中,丙二酸、乙醛酸、邻苯二甲酸、4-甲基-2-氧戊酸等LMWOAs对释放固着在有机质上的PAHs有积极影响,从而提高PAHs的生物利用度;它们还为微生物提供额外的营养源或改善土壤化学环境,从而提高PAHs降解微生物的数量和活性[29-30]。癸酸、十五烷酸、十六烷二酸、蓖麻油酸、棕榈油酸、反式亚油酸等脂肪酸是疏水性化合物,它们可通过提高PAHs的溶解度进而提高植物、微生物对PAHs的可利用度[17]。与其它研究不同的是,本研究中测得的氨基酸数量较少,仅半胱氨酸一种。由于植物根系主要通过扩散等被动形式释放氨基酸,推测该结果可能与速生植物的自身生长需要消耗大量氨基酸有关[31]。氨基酸,葡萄糖、海藻糖、松二糖等糖类同LMWOAs一样,均为易分解化合物,可作为微生物群落的营养来源,对PAHs降解菌群生长有促进作用[17]。刘世亮等人[32]在研究苯并[a]芘的微生物共代谢修复时发现,向土壤中添加水杨酸、邻苯二甲酸等化合物能缩短微生物驯化期和提高微生物酶活性,从而促进苯并[a]芘的共代谢降解。本研究虽未检测到水杨酸,但检测到了邻苯二甲酸和5-羟基水杨酸酯,这印证了蒿柳根系分泌物可促进苯并[a]芘的生物降解的观点。此外,在植物的乙烯合成过程中,5′-甲硫腺苷由S-腺苷甲硫氨酸(SAM)经酶催化作用合成,SAM参与了植物的逆境生理调节[33];L-抗坏血酸2-磷酸钠是一种性质稳定、水溶性的抗坏血酸,后者具有抗氧化能力[34];脯氨酸甜菜碱作为可配伍溶质在盐胁迫等逆境条件下可参与渗透势调节的过程[35],因而上述3种代谢物可能参与了蒿柳在PAHs污染逆境环境中的生理调节。
同样,PCA对NA、M、P、PMR处理样品的代谢表型进行分类的结果表明M、P和PMR处理对土壤代谢谱影响显著。与P处理相同,M处理相较于NA处理也显著提高了土壤代谢物的组分和含量,该结果的可能原因如下:首先,平滑白蛋巢菌或土著真菌具备分泌胞外酶的能力,如漆酶、锰过氧化物酶、木质素过氧化物酶等,可分解土壤环境中的木质素和PAHs等有机物,从而产生多种中间代谢产物[7];其次,平滑白蛋巢菌和土著菌群间存在营养竞争或拮抗效应,能同时刺激双方产生代谢物质介导微生物间的相互作用[30]。M处理相较于P处理含量上调代谢物明显更多,表明平滑白蛋巢菌对土壤代谢组的影响大于蒿柳,因而其对土壤微生物的生物量、活性和群落结构的影响可能更大。PMR处理相比其它处理含量上调的代谢物明显更少。上述结果表明,蒿柳受平滑白蛋巢菌影响加强了对多数土壤化合物的吸收,致使PMR处理样品中代谢物的积累量普遍降低。这种促进作用能加速PAHs通过集流和扩散在植物体内积累的进程,因而与接种平滑白蛋巢菌能增强蒿柳的吸水动力和PAHs提取能力[24,36]的现象相吻合。此外,蒿柳-平滑白蛋巢菌联合体系对土著微生物生长的刺激可能会加速土壤中代谢物的分解[37],平滑白蛋巢菌对蒿柳生长的抑制效应也不容忽视[36],上述因素均可能导致土壤中代谢物含量的减少。
18种根系分泌物组分中,M处理增加了其中16种组分的含量,这与土壤总代谢物情况相同,表明活性接种物或大麦种子中富含多种根系分泌物组分。PMR处理相较于NA增加了11种组分的含量,相较于M增加了8种组分的含量,该结果与土壤总代谢物情况不同,表明了蒿柳对根系分泌物的释放和吸收过程同步发生。接种平滑白蛋巢菌促进根际土壤中葡萄糖和十五烷酸的积累,由于平滑白蛋巢菌对蒿柳生长有抑制作用,且M处理能提高葡萄糖和十五烷酸的含量,因而这种促进作用可能仅仅是M处理和P处理的加和效应。但PMR处理导致了绝大多数根系分泌物组分含量的减少,部分组分降到NA水平之下,表明平滑白蛋巢菌能促进蒿柳对多数根系分泌物组分的吸收,然而,这种促进作用弱化了植物的根际降解(植物与微生物协作降解PAHs)过程。从这个角度看来,接种平滑白蛋巢菌对植物修复的强化作用可能在于加强了植物提取过程,而非根际降解过程。
4 结论
本研究重点讨论了PAHs污染土壤中接种平滑白蛋巢菌对蒿柳根际土壤代谢组的影响。首先,鉴定了18个潜在根系分泌物组分,讨论了它们的功能和在PAHs污染修复中的潜在作用。接种平滑白蛋巢菌导致根际土壤代谢物组分和含量的明显减少,其中有16种根系分泌物组分的含量明显降低,推测这种现象可能是由于平滑白蛋巢菌促进了蒿柳根系对土壤代谢物的吸收,从而降低了根系分泌物在土壤中的积累。本研究中,接种白腐真菌促进了植物根系对多数土壤代谢物的吸收,进而加速了土壤PAHs通过集流和扩散作用在植物各组织中的积累,这对强化植物对土壤PAHs的修复效能有重要意义。综上,本研究从根系分泌物的角度阐明了接种白腐真菌对蒿柳的生理影响,从而为揭示PAHs污染土壤植物-白腐真菌联合修复的作用机理提供了新证据。

