储藏条件对‘凤丹’籽粒酶活性及籽油品质的影响
吕长平,秧拯民,孙田娇,陈梦洁,陈海霞b,,李炎林b,
(湖南农业大学 a.风景园林与艺术设计学院;b.湖南省中亚热带优质花木繁育与利用工程技术研究中心;c.园艺学院,湖南 长沙 410128)
‘凤丹’Paeonia ostii为芍药科Paeoniaceae芍药属Paeonia多年生木本落叶小灌木,是我国传统的药用和观赏植物,其栽培历史悠久,种植面积广泛[1]。牡丹籽因具有不饱和脂肪酸含量高,出油率高,且富含多种人体必需的微量元素和活性物质等优点被开发为油用[2-3]。2011年3月22日,牡丹籽油被原中华人民共和国卫生部批准为新资源食品[4]。作为油用开发的主要品种为‘凤丹’(江南牡丹品种群)和‘紫斑牡丹’(西北牡丹品种群)2 大类,在湖南栽培的油用牡丹以‘凤丹’为主[5-6]。
近年来,有关牡丹籽油的研究主要集中在籽油的提取方法和成分分析等方面[1,3,7-9]。孙海燕等[10]对‘凤丹’种子层积过程中营养物质的代谢变化进行了研究;史国安等[11]对自牡丹新籽粒和陈化籽粒提取出的籽油品质进行了对比。‘凤丹’籽油为高不饱和脂肪酸油脂类型,在储藏和加工过程中极易被氧化,油脂的稳定性降低,同时酸败会导致大量氢过氧化物生成,形成具有致癌性的醛、酮类等物质[12]。在长时间自然存放的过程中,‘凤丹’籽粒自身种子特性、储藏时间以及储藏环境会对储藏后籽粒的生理活性、出油率、籽油油脂品质及其脂肪酸含量造成不同程度的影响[11]。其中,储藏环境中温度和氧气含量的影响最大[13-15]。低温储藏环境会使‘凤丹’籽粒的呼吸速率下降,从而使酶的活性降低,对油脂酸败有抑制效果。氧气含量的降低对油脂氧化也有抑制作用,能够更好地保证油脂品质[16-17]。而关于牡丹籽粒的储藏条件与储藏后所提取籽油品质关系的研究鲜见报道。为给‘凤丹’籽粒的储藏和采后加工利用提供参考,完善‘凤丹’籽粒储藏加工体系,本研究中对‘凤丹’籽粒采后储藏条件进行了探讨,对不同储藏条件和储藏时间处理下‘凤丹’籽粒的酶活性和出油率以及所提取籽油的品质和脂肪酸含量进行了比较。
1 材料与方法
1.1 试验材料
2018年7月上旬,在湖南省邵阳市郦家坪乡蔡家田村‘凤丹’种植基地,于果荚蟹黄色时采集‘凤丹’籽粒。釆后进行脱粒,去杂质和霉粒,筛除秕粒,然后置于通风阴凉处自然阴干,使其含水率至8%~10%。
1.2 试验方法
1.2.1 籽粒储藏
2018年9月—2019年9月,将阴干的‘凤丹’籽粒置于4 种条件下储藏,每种储藏条件下5 kg籽粒。储藏条件A,尼龙网眼袋散装储藏于通风阴凉的室内;储藏条件B,PE 真空袋密封储藏于通风阴凉的室内;储藏条件C,尼龙网眼袋散装储藏于4 ℃冰箱中;储藏条件D,尼龙网眼袋散装储藏于-20 ℃冰箱中。设置储藏条件B 为研究氧气对‘凤丹’籽粒采后储藏的影响,设置储藏条件C、D 为研究温度对‘凤丹’籽粒采后储藏的影响,模拟实际生产中一般冷库储藏和较为极端的冻库储藏。
1.2.2 籽粒酶活性测定
所测酶活性包括过氧化物酶(POD)活性、脂肪酶(LPS)活性和脂肪氧合酶(LOX)活性,分别使用苏州科铭生物技术有限公司的POD 测试盒(POD-2-Y)、LPS 测试盒(LPS-2-W)和LOX测试盒(LOX-2-W)进行测定。每隔30 d,在各储藏条件处理中随机取选20 g 籽粒,去壳后粗磨碎,称取0.1 g 于研钵中,加入1 mL 相应的提取液进行冰浴匀浆提取。各酶活性的测定均重复3 次。
1.2.3 籽油提取
参照洪晴悦等[7]的方法并略作修改,采用超声波辅助提取法提取‘凤丹’籽油。每隔30 d,在各储藏条件处理中随机选取80 g 籽粒,手工去壳,经粉碎机粉碎后过50 目筛。准确称取籽粒粉末50 g,置于500 mL 带塞三角瓶中,加入300 mL石油醚(沸点60~90 ℃)浸泡1 h。然后,进行超声波辅助处理1 h,超声条件为180 W、30 ℃。超声处理后,在8 000 r/min 条件下离心10 min,取上清液,使用旋转蒸发仪分离提取试剂和籽油,将分离得到的‘凤丹’籽毛油置于30 ℃鼓风干燥箱中过夜烘干,得‘凤丹’籽油。出油率为籽油质量占籽粒质量(50 g)的百分比。
1.2.4 籽油品质测定
采用油脂酸值、碘值和过氧化值作为‘凤丹’籽油品质评价指标。酸值参照文献[18]中的第1法进行测定,碘值参照文献[19]中的方法进行测定,过氧化值参照文献[20]中的第1 法进行测定。各指标的测定均重复3 次。
1.2.5 籽油脂肪酸组成及含量测定
使用气相色谱仪对籽油组成及含量进行测定,重复3 次。
甲酯化反应:取100 mg 籽油置于10 mL 具塞试管中,加入1 mol/L 的KOH-甲醇溶液1 mL,在40 ℃水浴中振摇30 min,静置15 min。置入70 ℃水浴中将其蒸干,加入5%的H2SO4-甲醇溶液2 mL,在70 ℃水浴中振摇60 min,加入2 mL 正己烷,静置10 min。取上清液,加入少许无水硫酸钠,取上层清液1 μL 作为进样。
气相色谱条件:毛细管柱型号HP-88,规格100 m×0.25 mm×0.2 μm;载气为氮气(99.99%),流速1.04 mL/min,进样量为1 μL,分流比20∶1;进样口温度250 ℃;检测器温度280 ℃;H2流量30 mL/min;尾吹气流量30 mL/min,空气流量30 mL/min;升温程序为柱初温120 ℃保持1 min,以10 ℃/min 的速率升到175 ℃,再以5 ℃/min的速率升到终温230 ℃,保持15 min。
1.3 数据处理
使用Microsoft Excel 2019 软件统计数据并制作图表,使用SPSS Statistics 26.0 软件进行相关性分析和差异显著性分析。
2 结果与分析
2.1 储藏条件对籽粒酶活性的影响
2.1.1 储藏条件对籽粒POD 活性的影响
POD 是重要的植物氧化还原酶,能氧化各种氢供体,如酚类物质、胺、抗坏血酸和某些无机离子[21],因而POD 活性高的籽仁色泽较白[22]。使籽粒中POD 活性保持在较高的水平有利于减缓籽粒的氧化程度,从而保证所提取籽油质量。不同储藏条件下‘凤丹’籽粒POD 活性的变化如图1所示。
由图1可知,在储藏期内,4 种储藏条件下籽粒POD 活性均呈下降趋势。籽粒初始POD 活性为588.21 U/g,储藏12月后,A 处理的籽粒POD活性为128.35 U/g,B 处理的籽粒POD 活性为364.78 U/g,C 处理的籽粒POD 活性为216.75 U/g,D 处理的籽粒POD 活性为247.96 U/g,A 处理与其他3 种处理的籽粒POD 活性呈极显著差异(P<0.01)。在储藏前期(0~120 d),A 处理的籽粒POD 活性下降较为迅速,B 处理与C 处理的籽粒POD 活性呈显著差异(P<0.05),D 处理与B、C 处理的籽粒POD 活性无显著差异(P>0.05)。储藏中后期(120~360 d),B 处理与其他3 种处理的籽粒POD 活性呈极显著差异(P<0.01),C 处理与D 处理的籽粒POD 活性呈显著差异(P<0.05)。综上所述,储藏环境对‘凤丹’籽粒POD活性变化有较为显著的影响,储藏条件B 最有利于保持‘凤丹’籽粒POD 活性,这可能与PE 真空袋密封相对于其他储藏环境中氧含量较少有关。
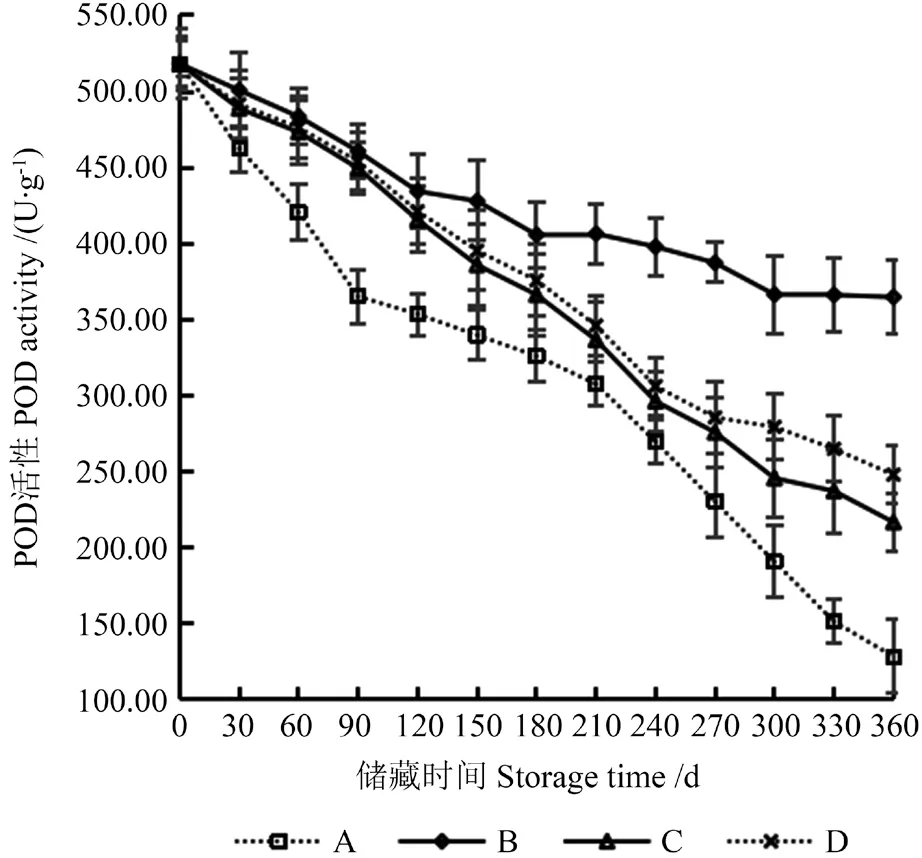
图1 不同储藏条件下‘凤丹’籽粒过氧化物酶(POD)活性的变化Fig.1 Changes of peroxidase (POD) activity in ‘Fengdan’seeds under different storage conditions
2.1.2 储藏条件对籽粒LPS 活性的影响
LPS可以将油脂水解成游离的脂肪酸和甘油,具有对油水界面的亲和力,并能在油水界面上以高催化速率水解不溶于水的油脂。常见的油料作物种子均富含LPS,LPS 活性越高越易促进籽油油脂的氧化[13,23]。因此通过测定LPS 活力可以了解‘凤丹’籽粒的水解酸败程度[24]。不同储藏条件下‘凤丹’籽粒LPS 活性的变化如图2所示。
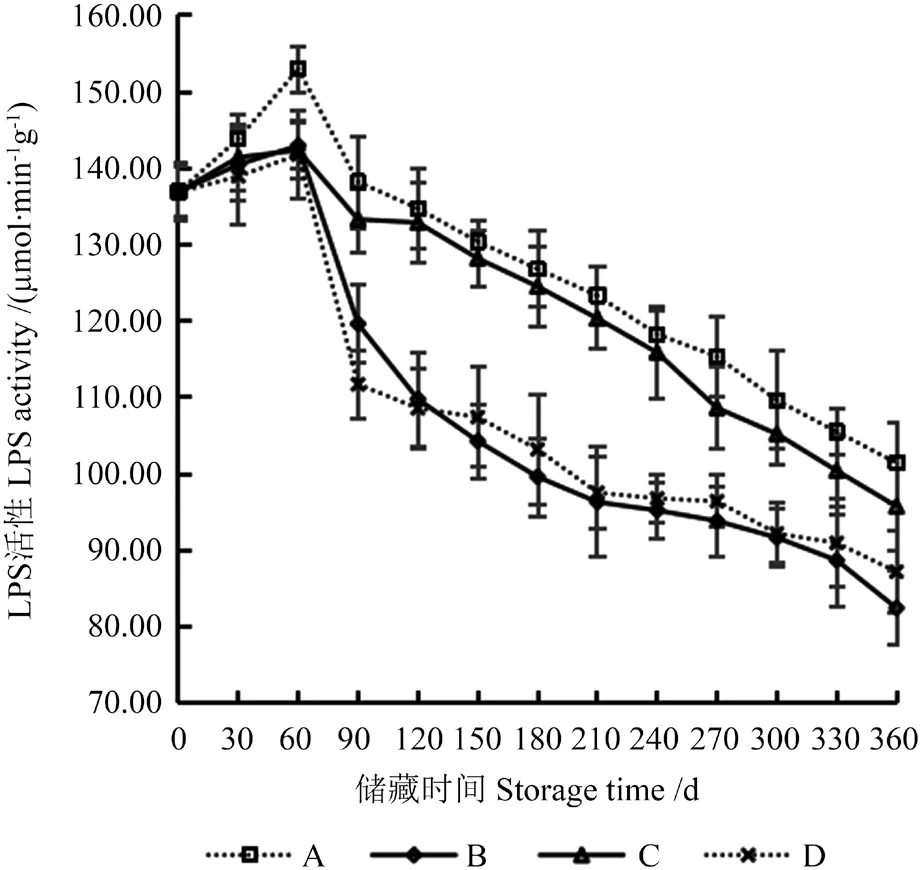
图2 不同储藏条件下‘凤丹’籽粒脂肪酶(LPS)活性的变化Fig.2 Changes of lipase (LPS) activity in ‘Fengdan’ seeds under different storage conditions
由图2可知,4 种储藏条件下‘凤丹’籽粒LPS活性在储藏60 d 内均呈上升趋势,储藏60~90 d时LPS 活性迅速下降,储藏90 d 后LPS 活性缓慢下降。整个储藏期间,LPS 活性最大为A 处理的152.98 μmol/(min·g),最小为B组的82.76 μmol/(min·g),总体波动不大。在储藏60 d 后,A、B、C、D 处理的籽粒LPS 活性由136.92 μmol/(min·g)分别上升至152.98、142.98、142.36、141.80 μmol/(min·g),达到整个储藏期间的最大值,此时A 处理与其他3 种处理的籽粒LPS 活性呈极显著差异(P<0.01),其他3 种处理的籽粒LPS 活性间无显著差异(P>0.05)。储藏90~360 d 时,4 种处理的籽粒LPS 活性均呈下降趋势,除在储藏120、210、300 d 时,B 处理与D 处理的籽粒LPS 活性间无显著差异(P>0.05),其他储藏时间点4 种处理的籽粒LPS 活性间均呈显著差异(P<0.05)。在整个储藏期间,B 处理的籽粒LPS 活性均处于较低水平,且在储藏360 d 时达最低值,整个变化趋势与D 处理相似。因此,-20 ℃与真空环境有利于维持LPS 活性的稳定,并使其处于较低的水平。
2.1.3 储藏条件对籽粒LOX 活性的影响
LOX 会导致籽粒中的亚油酸、亚麻酸氧化,降低油脂中不饱和脂肪酸的含量,继而影响油脂的营养价值,并且会产生酸败的味道,严重的还会产生有毒的氢过氧化物[13]。因此,籽粒LOX 活性对籽油的不饱和脂肪酸含量有重要影响,使籽粒LOX 活性维持在较低的水平有利于提高所提取籽油的不饱和脂肪酸含量。不同储藏条件下‘凤丹’籽粒LOX 活性的变化如图3所示。
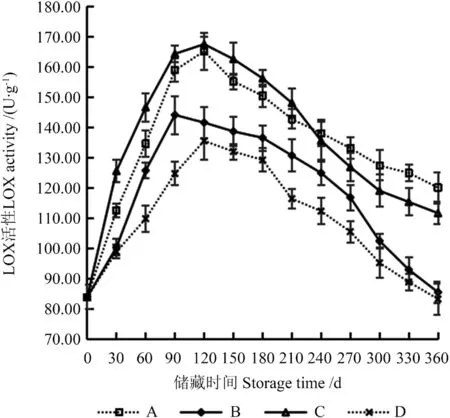
图3 不同储藏条件下‘凤丹’籽粒脂肪氧合酶(LOX)活性的变化Fig.3 Changes of lipoxygenase (LOX) activity in ‘Fengdan’seeds under different storage conditions
由图3可知,在整个储藏期间,4 种储藏条件下‘凤丹’籽粒LOX 活性均呈先较为迅速上升、后缓慢下降的变化趋势。在储藏90~120 d 时‘凤丹’籽粒LOX 活性较高,在此期间所提取‘凤丹’籽油的品质可能不太理想。籽粒初始LOX 活性为83.84 U/g,储藏360 d 后,A、B、C、D 处理的籽粒LOX 活性分别为120.11、85.45、111.66、83.20 U/g。储藏30 d 时,B 处理与D 处理的籽粒LOX 活性间无显著差异(P>0.05),但与其他2 种处理呈极显著差异(P<0.01)。在贮藏90 d 时,B 处理的籽粒LOX 活性达到最大值,与其他3 种处理呈显著差异(P<0.05)。储藏120 d 时,其他3 种处理的籽粒LOX 活性达到最大值,A 处理与C 处理间无显著差异(P>0.05),但与其他2种处理呈极显著差异(P<0.01)。储藏360 d 时,B 处理与D 处理的籽粒LOX 活性间无显著差异(P>0.05),但B、D 处理与A、C 处理间呈极显著差异(P<0.01),A 处理与C 处理的籽粒LOX 活性间呈显著差异(P<0.05)。综上所述,储藏条件B、D 较A、C 更利于‘凤丹’籽粒的长期储藏。
2.2 储藏条件对籽粒出油率的影响
‘凤丹’籽粒的出油率直接影响其经济效益。不同储藏条件下‘凤丹’籽粒出油率的变化如图4所示。
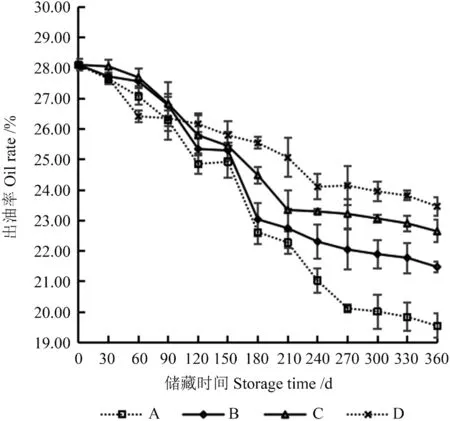
图4 不同储藏条件下‘凤丹’籽粒出油率的变化Fig.4 Changes of seed oil yield of ‘Fengdan’ under different storage conditions
由图4可知,在整个储藏期间,4 种储藏条件下‘凤丹’籽粒的出油率均随着储藏时间的延长呈不同程度下降趋势。‘凤丹’籽粒的初始出油率为28.11%,储藏360 d 后,A、B、C、D 处理的籽粒出油率分别为19.55%、21.48%、22.65%、23.80%,与储藏前相比分别下降了30%、23%、19%、15%。与A 处理相比,B、C、D 处理籽粒出油率的下降趋势较缓和,并且出油率始终在20%以上。在储藏210 d 内,各储藏条件下籽粒的出油率间无显著差异(P>0.05)。储藏240~270 d,A 处理与B 处理的出油率间无显著差异(P>0.05),但与C、D 处理间呈显著差异(P<0.05)。储藏300~360 d,A 处理的籽粒出油率与B、C、D 处理的出油率呈极显著差异(P<0.01),C 处理与B、D 处理间无显著差异(P>0.05),B 处理与D 处理的籽粒出油率间呈显著差异(P<0.05)。综上所述,储藏条件B、C 和D 均能减缓籽粒出油率的降低,且储藏条件D的减缓效果最为明显,与其他储藏条件差异显著。
2.3 储藏条件对籽油品质的影响
2.3.1 储藏条件对籽油酸值的影响
酸值是评价油脂品质的重要指标,能为‘凤丹’籽粒的储藏提供参考。根据文献[25]中的规定,食用植物油的酸值应不大于3 mg/g,植物原油的酸值应不大于4 mg/g。根据文献[26]中的规定,一级牡丹籽油的酸值(以KOH 记)应不大于2 mg/g,二级牡丹籽油的酸值(以KOH 记)应不大于3 mg/g。不同储藏条件下‘凤丹’籽油酸值的变化如图5所示。
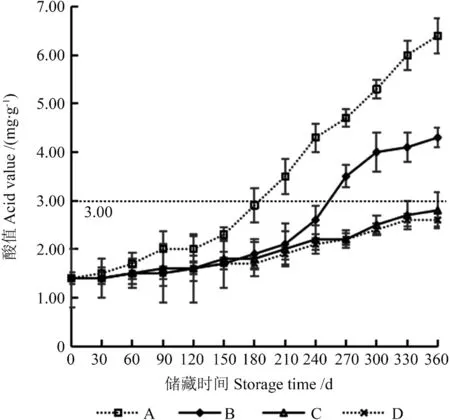
图5 以不同储藏条件下‘凤丹’籽粒为原料所提取籽油酸值的变化Fig.5 Changes of acid value of seeds oil extracted from‘Fengdan’ seeds under different storage conditions
由图5可知,由4 种储藏条件下‘凤丹’籽粒所提取籽油酸值均随着储藏时间延长呈上升趋势。由A 处理籽粒所提取籽油酸值上升最为迅速,在储藏180 d 时(2.90 mg/g)已经接近二级牡丹籽油酸值标准(≤3 mg/g)。由B 处理籽粒所提取籽油酸值上升趋势次之,但在储藏270 d 时(3.50 mg/g)超出了二级牡丹籽油酸值标准。由C、D 处理籽粒所提取籽油酸值在整个储藏期间变化趋势较为一致,且在储藏360 d 时所提取籽油酸值仍符合二级牡丹籽油酸值标准,分别为2.80 和2.60 mg/g。在储藏30 d 时,由4 种处理籽粒所提取籽油的酸值无显著差异(P>0.05),之后由A处理籽粒与由B、C、D 处理籽粒所提取籽油酸值均呈显著差异。由B 处理籽粒与由C、D 处理籽粒所提取籽油酸值在储藏0~210 d 时无显著差异(P>0.05),在储藏240~360 d 时呈显著差异(P<0.05)。在整个储藏期间,由C 处理与由D处理籽粒所提取籽油的酸值始终无显著差异(P>0.05)。上述结果表明,室温储藏的籽粒在180 d后不能作为油用。低温和真空环境均对‘凤丹’籽油酸值上升有较为明显的减缓作用,且由在低温环境储藏的籽粒所提取籽油的酸值始终未超出二级牡丹籽油的酸值标准。
2.3.2 储藏条件对籽油碘值的影响
碘值是判断油脂中不饱和脂肪酸含量的重要指标,根据碘值可以判断油脂的不饱和程度[8]。根据文献[26]中的规定,牡丹籽油的碘值(以I 记)范围为1 620.0~1 900.0 g/kg。由不同储藏条件下‘凤丹’籽粒所提取籽油碘值的变化如图6所示。
由图6可知,由4 种储藏条件下‘凤丹’籽粒所提取籽油的碘值均呈下降的趋势,在储藏60 d 时均低于文献[26]中规定的最低碘值(1 620.0 g/kg)。但整个储藏期间,由A 处理籽粒所提取籽油的碘值下降速度最快,尤其在储藏270~300 d 时迅速下降,且自储藏60 d 起,始终与由其他3 种处理籽粒所提取籽油的碘值有显著差异(P<0.05)。其次,由B 处理籽粒所提取籽油的碘值下降速度也相对较快。由C、D 处理籽粒所提取籽油碘值的变化趋势相似,均较为平缓,且在储藏90 d 后,与由B 处理籽粒所提取籽油的碘值有显著差异(P<0.05)。上述结果表明,低温和少氧环境均能减缓由储藏籽粒所提取籽油碘值的降低,且低温环境对碘值降低的抑制更为有效。

图6 以不同储藏条件下‘凤丹’籽粒为原料所提取籽油碘值的变化Fig.6 Change of iodine value of seed oil extracted from‘Fengdan’ seeds under different storage conditions
2.3.3 储藏条件对籽油过氧化值的影响
过氧化值是评定油脂品质的重要指标之一。油脂在氧化酸败过程中会生成氢过氧化物,氢过氧化物含量越高,过氧化值越高[27-28]。因此,过氧化值能够直接反映籽油的酸败程度。根据文献[26]中的规定,一级牡丹籽油的过氧化值应不大于6.0 mmol/kg,二级牡丹籽油的过氧化值应不大于7.5 mmol/kg。由不同储藏条件下‘凤丹’籽粒所提取籽油过氧化值的变化如图7所示。
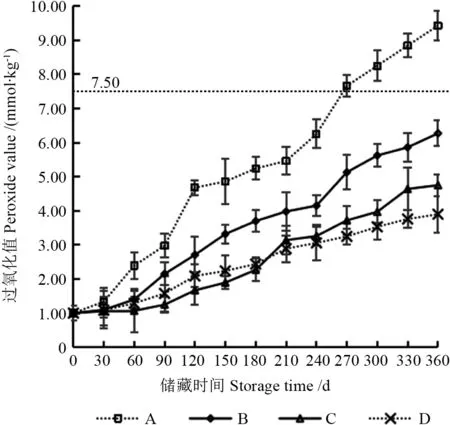
图7 以不同储藏条件下‘凤丹’籽粒为原料所提取籽油过氧化值的变化Fig.7 Change of peroxide value of seed oil extracted from‘Fengdan’ seeds under different storage conditions
由图7可知,过氧化值的变化趋势与酸值相似,均随着储藏时间延长呈上升趋势。其中,由A 处理籽粒所提取籽油的过氧化值上升最为迅速,始终大于其他处理,且差异极显著(P<0.01),储藏270 d 后其过氧化值超过了二级牡丹籽油的过氧化值标准。由其他3 种处理籽粒所提取籽油的过氧化值在整个储藏期间均不大于7.5 mmol/kg,储藏0~60 d 时由B、C、D 处理籽粒所提取籽油的过氧化值无显著差异(P>0.05),均保持在较低的水平,之后由B 处理籽粒所提取籽油的过氧化值高于C、D 处理,且差异显著(P<0.05)。除储藏0、60、180、210 d 外,由C、D 处理籽粒所提取籽油的过氧化值在其余储藏时间均呈显著差异(P<0.05)。综上,储藏条件D 对抑制由储藏籽粒所提取籽油的过氧化值升高最为有效。
2.4 储藏条件对籽油脂肪酸的影响
对由未进行储藏的‘凤丹’籽粒所提取籽油的脂肪酸组成进行分析,结果见表1。由表1可知,‘凤丹’籽油所含脂肪酸主要为亚麻酸、亚油酸、油酸、棕榈酸、硬脂酸等,这与前人的研究结果一致[3,9,29-30]。
根据文献[26]中的规定,在牡丹籽油脂肪酸组成中,亚麻酸(C18:3)含量应不小于38.0%,亚油酸(C18:2)含量应不小于25.0%,油酸(C18:1)含量应不小于21.0%。由不同储藏条件下‘凤丹’籽粒所提取籽油脂肪酸组分含量的变化如图8所示。
由图8可知,由4 种处理籽粒所提取籽油的亚麻酸含量均呈下降趋势。其中,由A 处理籽粒所提取籽油的亚麻酸含量的下降最为迅速,在储藏60 d 时亚麻酸含量即略低于文献[26]中规定的标准(≥38.0%)。由A、C、D 处理籽粒所提取籽油的亚麻酸含量分别在储藏150、120、300 d 时略低于该标准。由图8可知,在整个储藏期间,亚油酸和油酸的含量呈不同的变化趋势,但其含量始终在规定的标准值范围内。
牡丹籽油的不饱和脂肪酸和饱和脂肪酸含量显著高于常见的食用植物油,尤其是亚麻酸和油酸含量[29,31-32],因此也更容易被氧化[33]。由图8可知,整个储藏期间,‘凤丹’籽油的不饱和脂肪酸相对含量高达91.28%,储藏90 d 内和储藏270 d 后由籽粒所提取籽油的不饱和脂肪酸相对含量下降较为迅速,少氧和低温环境均能有效抑制不饱和脂肪酸相对含量降低,储藏条件B、D 均优于储藏条件C。
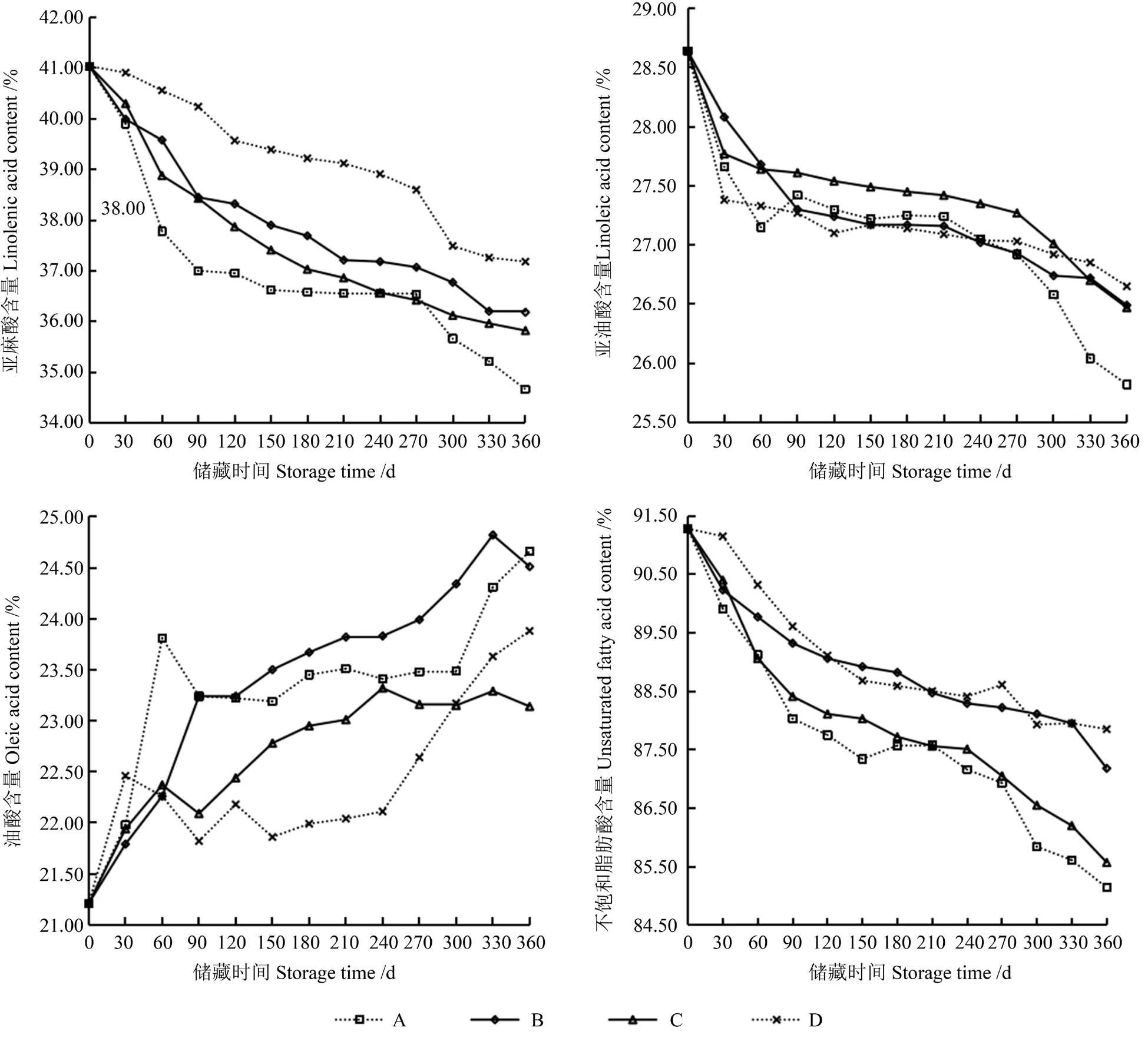
图8 由不同储藏条件下‘凤丹’籽粒所提取籽油脂肪酸组分含量的变化Fig.8 Changes of fatty acid components in seed oil extracted from ‘Fengdan’ seeds under different storage conditions
2.5 籽粒酶活性与籽油品质的相关关系
不同储藏条件下‘凤丹’籽粒酶活性与所提取籽油品质的相关系数见表2。从表2中可以看出,由不同储藏条件下‘凤丹’籽粒所提取籽油的品质和籽粒POD、LPS 活性均呈显著相关,与LOX活性无显著相关关系。提取籽油的酸值、过氧化值与籽粒POD、LPS 活性呈显著负相关,碘值与籽粒POD、LPS 活性呈显著相关。说明储藏期间籽粒所含油脂的氧化程度与POD、LPS 活性的变化是密不可分的。
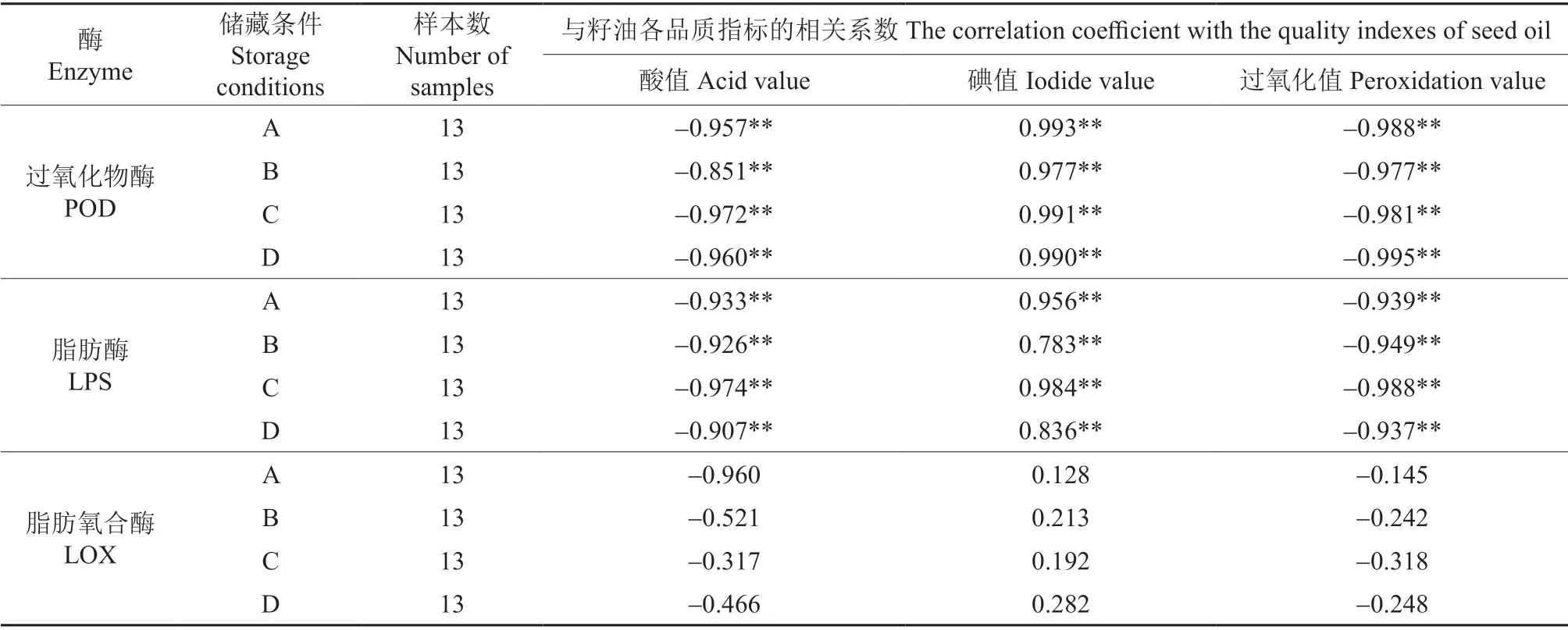
表2 不同储藏条件下‘凤丹’籽粒酶活性与所提取籽油品质的相关系数†Table 2 Correlation coefficient between enzyme activity and quality of ‘Fengdan’ seed oil under different storage conditions
储藏籽粒POD、LPS 活性与提取籽油的酸值、碘值、过氧化值的相关系数较大,酶活性降低,酸值和过氧化值大幅度升高,碘值大幅下降。籽粒LOX 活性与籽油酸值、碘值、过氧化值均无显著相关关系,说明LOX 活性的变化对籽油品质无显著影响。
3 结论与讨论
从采收到加工‘凤丹’籽粒需要经过一定的储藏期,储藏条件会影响籽粒品质,进而影响所加工籽油的品质。本研究中测定了不同储藏条件下‘凤丹’籽粒的酶活性和出油率,所提取籽油的油脂品质和脂肪酸含量变化,以期探寻适宜油用加工的‘凤丹’籽粒储藏环境以及各储藏环境下籽粒的最长储藏期限。研究结果表明,室温储藏‘凤丹’籽粒的保质期约为60 d,真空储藏籽粒的保质期约为150 d,4 ℃储藏籽粒的保质期约为120 d,-20 ℃储藏籽粒的保质期约为300 d。真空和-20 ℃的储藏条件有利于籽粒的储藏,无氧和低温环境均能有效延长籽粒的保质期。在实际生产中,可将籽粒储藏于低温少氧环境,且应在半年内提取籽油,以避免所提取油脂品质降低。
虽然较高的POD 活性和较低的LPS、LOX 活性有利于‘凤丹’籽粒的储藏,但在整个储藏期间POD 活性呈下降趋势,LPS、LOX 活性呈不同程度的倒“U”形变化趋势,这与前人的研究结果一致[10,34]。适宜的储藏条件使籽粒LPS、LOX 活性在储藏360 d 时达到整个储藏期间的最低水平,但此时POD 活性和出油率也处于整个储藏期间的最低水平,油脂品质及其脂肪酸含量也在持续下降。由室温储藏籽粒所提取籽油在储藏180 d 时即出现了酸败,由真空储藏籽粒所提取籽油在240 d后出现了酸败。在储藏后期LPS、LOX 活性处于较低水平是由籽粒劣变所导致,此时储藏籽粒的品质已经远不如储藏初期,严重影响了‘凤丹’籽粒的经济价值及其油脂品质。因此,‘凤丹’籽粒在储藏期间的品质不能以单一指标进行衡量,应综合各指标进行评价。相关性分析结果表明,LOX 活性的变化对所提取籽油品质无影响。
根据文献[25-26]中对牡丹籽油酸值(≤3 mg/g)和过氧化值(≤7.5 mmol/kg)的规定,室温储藏籽粒的保质期为180 d,真空储藏籽粒的保质期为240 d,在360 d 储藏期内4 ℃和-20 ℃储藏籽粒这2 个指标均在规定值范围内。根据文献[26]中规定的碘值(1 620.0~1 900.0 g/kg)和亚麻酸含量(≥38.0%),由4 种储藏条件下籽粒所提取籽油的碘值在储藏30 d 后均低于规定值,亚麻酸含量分别在储藏60、150、120、300 d 后低于规定值。亚油酸和油酸含量始终在规定值范围内,而且油酸含量呈上升趋势。碘值也是衡量油脂中不饱和脂肪酸含量的重要指标[31],碘值的降低主要由亚麻酸含量降低导致,这与‘凤丹’籽油中亚麻酸为含量最高的不饱和脂肪酸这一结论相符合[32]。为了提高籽油品质,今后可围绕提高或保持亚麻酸含量等方面进行研究。
本研究中仅对果荚蟹黄色时采收的‘凤丹’籽粒进行了研究,不同成熟期‘凤丹’籽粒采后储藏质量的变化差异有待进一步研究,‘凤丹’籽粒采后储藏品质变化与油用牡丹另一主栽品种‘紫斑牡丹’的差异值得探讨,添加符合食品安全标准的抗氧化防腐类物质对籽粒劣变或籽油品质的作用也是下一步的研究方向。

