超声造影参数在糖尿病肾病K-W结节形成中的评估价值
王一茹,李 楠,赵 萍,林 林,田晓琦,董哲毅,刘娇娜,王 倩,李秋洋,唐 杰,罗渝昆
中国人民解放军总医院第一医学中心 1超声诊断科 2肾脏病学部,北京 100853
糖尿病(diabetes mellitus,DM)发病率在全球范围内呈上升趋势,随着我国人口老龄化与生活方式的变化,DM患病率从1980 年的0.67%迅速增长至2013年的10.40%[1]。糖尿病肾病(diabetic nephropathy,DN)已成为我国尿毒症的第2位原发疾病,仅次于原发性肾小球疾病[2]。DN早期症状隐匿,病程进展快、不可逆,治疗较为困难,易进展为慢性肾功能不全。K-W结节是DN的特征性病理改变之一,病理表现为肾小球系膜基质重度增生,形成结节状硬化,该结节在过碘酸六胺银(periodic acid-silver metheramine,PASM)染色下呈同心圆状排列。研究认为,微血管损伤是K-W结节形成的重要因素[3-5]。Tervaert等[6]研究认为,K-W结节是DN预后的重要指标,其形成往往预示着肾小球病理分期进入Ⅲ期。本课题组前期研究显示,超声造影(contrast enhanced ultrasound,CEUS)能够评估DN肾脏微血流灌注[7]。DN患者中,K-W结节形成与否其微血流灌注如何变化尚不明确。本研究探讨了CEUS能否对K-W结节的形成提供无创评估参数,以期为进一步阐述DN进展中血流微灌注提供依据。
对象和方法
对象及分组2017年3月至2020年1月在中国人民解放军总医院第一医学中心超声诊断科行CEUS检查且行肾脏穿刺活检、病理诊断为DN的患者62例,根据有无K-W结节形成分为无K-W结节组(n=19)和有K-W结节组(n=43)。DN肾脏病理诊断参照2010年肾脏病理学会研究委员会标准[6]。纳入标准:(1)年龄>18岁;(2)临床确诊为2型DM;(3)出现微量白蛋白尿(尿白蛋白肌酐比30~300 mg/g)或大量白蛋白尿(尿白蛋白肌酐比≥300 mg/g)或肾小球滤过率估计值(estimated glomerular filtration rate,eGFR)下降[<60 ml·min-1·(1.73 m2)-1];(4)肾脏病理诊断明确为DN。排除标准:(1)病例资料不全(如无DM病史等);(2)合并泌尿系感染;(3)合并其他急性感染性疾病(如呼吸系统、消化系统等感染);(4)合并系统性疾病(如过敏性紫癜混合型、系统性血管炎、Goodpasture综合征等);(5)病理诊断为DN合并非糖尿病肾病患者;(6)合并恶性肿瘤。本研究经中国人民解放军总医院医学伦理委员会批准,所有患者均签署知情同意书(S2017-152-02)。
数据收集收集患者的性别、年龄、身高、体质量、体质量指数、血压、DM病史、DM视网膜病变、有无镜下血尿等;实验室检查指标:24 h尿蛋白、eGFR、血浆尿素氮、血肌酐、血糖、总胆固醇、三酰甘油、胱抑素C等。
CEUS采用Siemens S2000超声诊断仪(德国西门子公司),探头为C6-2,频率为2~6 MHz。显示左肾长轴切面。超声造影剂以六氟化硫冻干粉剂(意大利Bracco公司)与生理盐水5 ml溶液配制成微泡混悬液,震荡摇匀。经肘静脉团注0.5 ml造影剂,后团注5 ml生理盐水。造影剂达到肾门处嘱患者屏气,后缓慢平稳呼吸。图像采集由2名高年资超声医师(具有5年以上肾脏超声评估经验及3年以上CEUS评估经验)完成。
CEUS图像分析图像分析采用Vuebox 7.0软件(德国博莱科公司)。在左肾中部至下部距包膜1 cm内放置肾皮质感兴趣区(region of interest,ROI)1,在邻近皮质的髓质区放置感兴趣区(ROI2),尽量避开弓状动脉,ROI面积为0.3 cm2。每次测量重复3次,取平均值。开启运动补偿条件,自动获得时间-强度曲线(time intensity curve,TIC)及造影参数。参数包括:峰值强度(peak enhancement,PE)、流入相曲线下面积(wash-in area under the curve,WiAUC)、上升时间(rise time,RT)、局部平均渡越时间(mean transit time,mTT)、达峰时间(time to peak,TTP)、流入相比率(最大斜率)(wash-in rate,WiR)、流入相灌注指数(wash-in perfusion index,WiPI)、流出相曲线下面积(wash-out AUC,WoAUC)、流入相和流出相曲线下面积(wash-in and wash-out area under curve,WiWoAUC)、下降时间(fall time,FT)和流出相比率(wash-out rate,WoR)。
组织病理学检查超声引导下行左肾穿刺活检,活检位置选取左肾下极,由肾脏科医生完成。每例样本采用HE染色、Masson染色,行光镜检查。肾脏病理读片由至少2位肾脏病理学医师进行判读。
统计学处理采用SPSS 19.0统计软件,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采Mann-WhitneyU检验;分类变量用率或比表示,组间比较采用卡方检验;P<0.05为差异有统计学意义。
结 果
两组间一般资料比较无K-W结节组和K-W结节组患者在年龄(t=4.473,P=0.039)和总胆固醇(t=5.747,P=0.023)方面差异有统计学意义,其余各项临床指标间差异无统计学意义(P均>0.05)(表1)。无K-W结节组患者的典型病例超声及病理图像见图1,K-W结节组患者的典型病例超声及病理图像见图2。
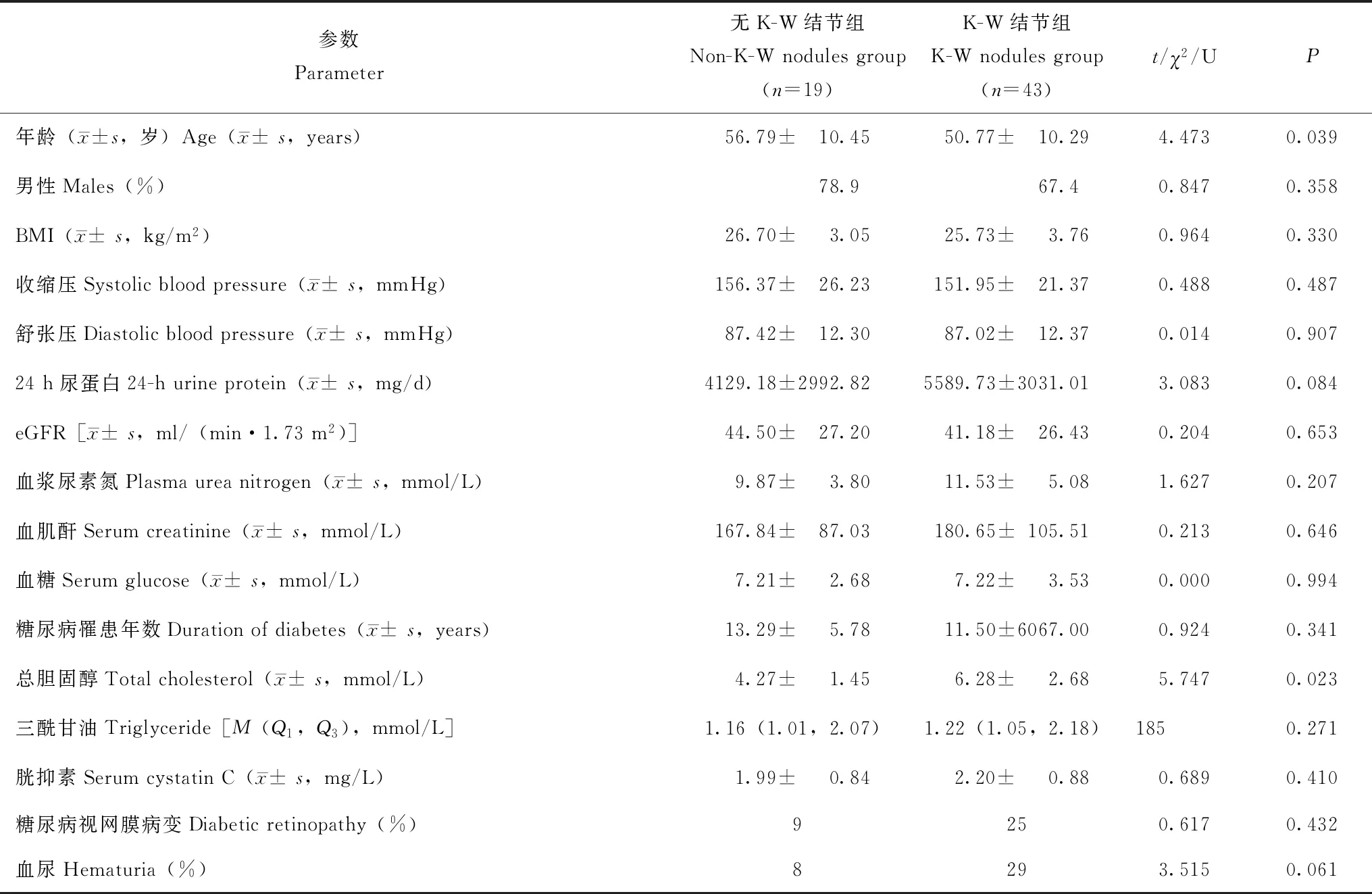
表1 两组患者一般资料的比较Table 1 Comparison of general data between two groups
两组间CEUS参数的比较皮质CEUS参数中,K-W结节组的时间相关参数中位RT和FT分别为6.87 s和20.74 s,明显长于无K-W结节组的5.30 s(U=209,P=0.013)和11.40 s(U=197,P=0.007);血流灌注相关参数中位WiR和WoR分别为820 a.u和250 a.u,明显小于无K-W结节组的1506 a.u(U=228,P=0.031)和617 a.u(U=229,P=0.032)(表2)。
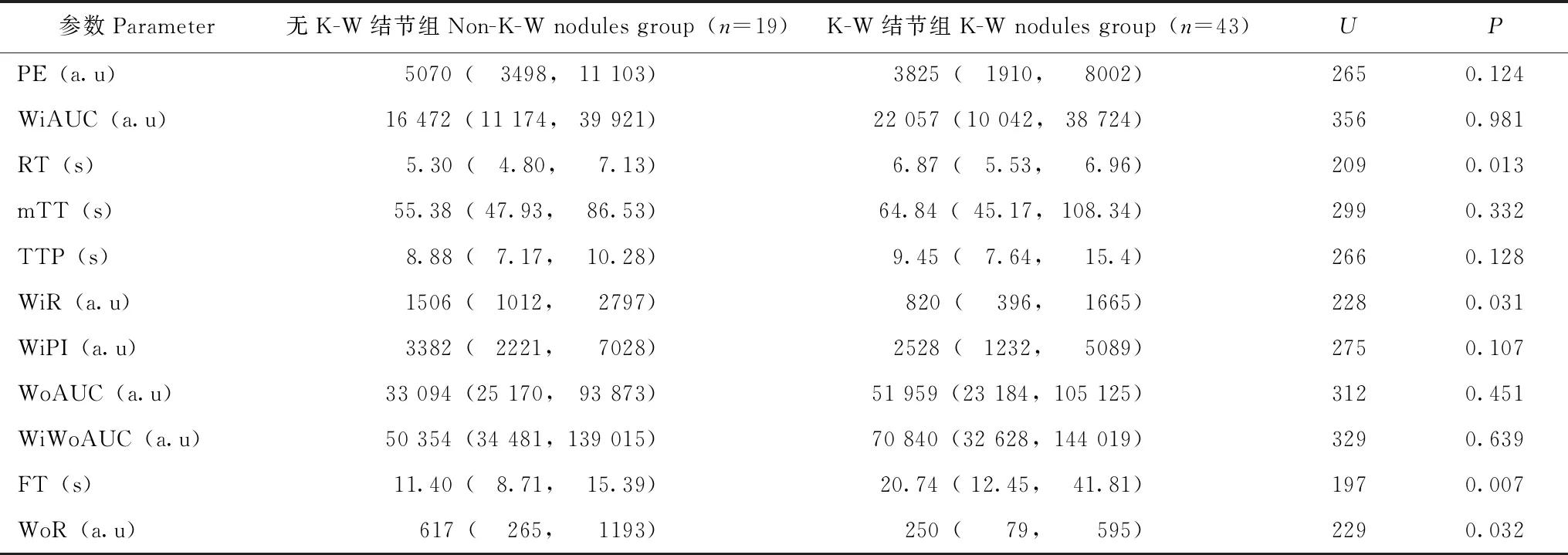
表2 两组皮质CEUS参数的比较[M(Q1,Q3)]Table 2 Comparison of cortical CEUS parameters between two groups[M(Q1,Q3)]
皮质与髓质CEUS参数比值中,K-W结节组的中位PE1/PE2、WiR1/WiR2和WoR1/WoR2分别为1.56、2.30和2.81,明显小于无K-W结节组的2.26(U=224,P=0.026)、3.44(U=235,P=0.041)和7.15(U=230,P=0.043);中位FT1/FT2为0.63,明显大于无K-W结节组的0.29(U=227,P=0.038)(表3)。
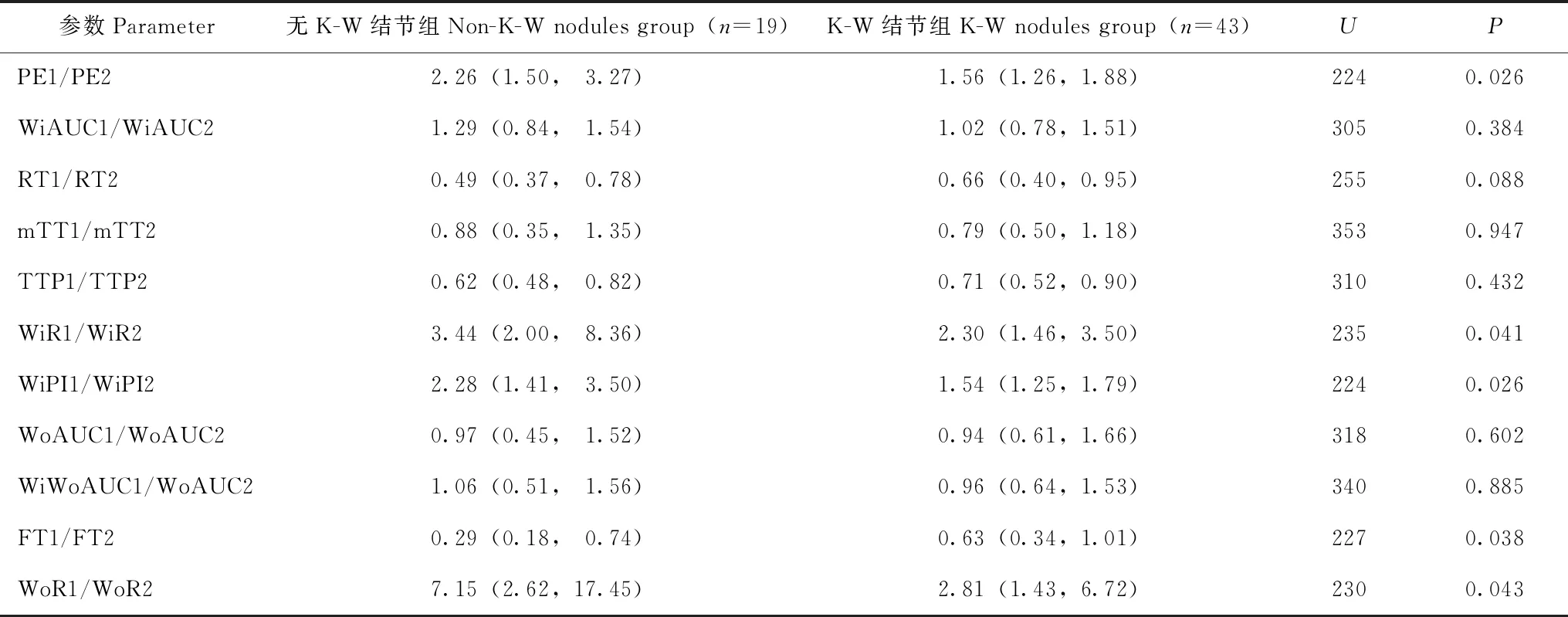
表3 两组皮髓质超声造影参数比值的比较[M(Q1,Q3)]Table 3 Comparison of ratios of cortical to medullary CEUS parameters between two groups[M(Q1,Q3)]
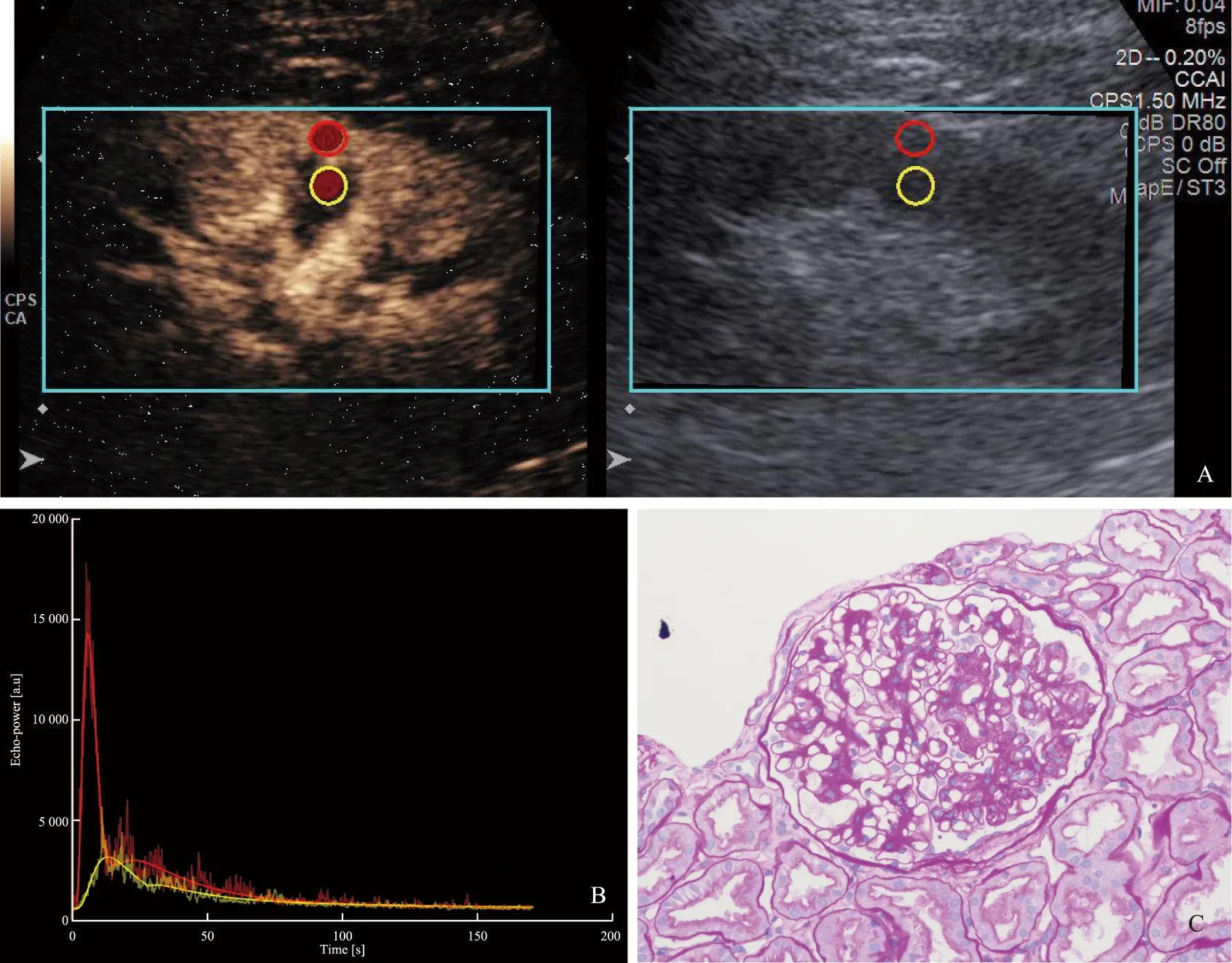
CEUS:超声造影;TIC:时间强度曲线;ROI:感兴趣区CEUS:contrast-enhanced ultrasound;TIC:time-intensity curve;ROI:region of interestA.左肾CEUS图像分析(红圈:皮质取样框;黄圈:髓质取样框);B.左肾CEUS TIC曲线;C.肾脏穿刺活检病理结果,肾小球系膜增生,未见K-W结节形成(HE,×200)A.CEUS image of the left kidney(red circle:ROI of cortex;yellow circle:ROI of medulla);B.CEUS TIC curve of left kidney;C.renal puncture biopsy showed mesangial hyperplasia of glomerulus and absence of K-W nodules(HE,×200)图1 男,61岁,糖尿病病史15年,体质量指数24.5 kg/m2,24 h尿蛋白2261.8 mg,肾小球滤过率91.58 ml/(min·1.73 m2),血肌酐79.8 μmol/LFig 1 A 61-year-old male patient with diabetes history of 15 years,body mass index of 24.5 kg/m2,24-h urinary protein of 2261.8 mg,glomerular filtration rate of 91.58 ml/(min·1.73 m2),and serum creatinine of 79.8 μmol/L
讨 论
DN是糖尿病常见并发症之一,研究显示,近30年来其患病风险改善不如其他并发症,病情难以控制[8]。DN进展至终末期肾病的速度显著高于其他肾病,严重影响患者的预后。依据现行肾脏病理学会提出的DN肾脏病理分型标准[6,9],根据肾小球病变程度将DN肾脏病变分为4期,其中K-W结节为区分Ⅱ期和Ⅲ期的关键诊断指标。研究表明,K-W结节的形成是提示DN不良预后的重要指标[10-12]。如果能通过无创影像学参数对K-W结节形成与否这一病变进展程度进行提示,将对患者的早期诊断及药物干预具有重要意义。
CEUS可提供实质脏器微循环血流实时超声图像,并通过建立时间-强度曲线(time-intensity curve,TIC),以相应的定量参数反映造影的动态过程及强度变化,量化反映组织的灌注特点[13]。超声造影剂为微气泡,具有较高安全性和可重复性,微气泡经过呼吸道代谢,不通过肾脏代谢,不损伤肾功能,是适用于肾脏的增强影像学方法。Ma等[14]和Dong 等[15]研究显示,CEUS能够定量评估早期DN的肾脏血流灌注。Wang等[16]研究认为,AUC可作为糖尿病肾病早期肾损伤和肾微血管高灌注的敏感指标。目前研究观察的是CEUS参数与临床分期或患者临床特征的参数,而纳入病理学指标分析CEUS参数的研究鲜见。本研究则纳入了经病理组织学证实的DN患者,以K-W结节形成为主要因素,分为K-W结节形成组与无K-W结节形成组,对其CEUS参数的改变进行探讨。

A.左肾CEUS图像分析(红圈:皮质取样框;黄圈:髓质取样框);B.左肾CEUS TIC曲线;C.肾脏穿刺活检病理结果,K-W结节(HE,×200)A.CEUS image of the left kidney(red circle:ROI of cortex;yellow circle:ROI of medulla);B.CEUS TIC curve of the left kidney;C.renal puncture biopsy showed the presence of K-W nodules(HE,×200)图2 男,68岁,糖尿病病史8年,体质量指数35.6 kg/m2,24 h尿蛋白3977.6 mg,肾小球滤过率26.15 ml/(min·1.73 m2),血肌酐175.7 μmol/LFig 2 A 68-year-old male patient with diabetes history of 8 years,body mass index of 35.6 kg/m2,24-h urinary protein of 3977.6 mg,glomerular filtration rate 26.15 ml/(min·1.73 m2),and serum creatinine of 175.7 μmol/L
本研究结果显示,K-W结节组与无K-W结节组间的性别、体质量指数、血压和糖尿病罹患时间等无显著差异;K-W结节组患者发病年龄偏小,提示DN发病年龄越小,病程进展可能越快。因此,对于DN患者早期识别具有重要意义。此外本研究还显示,K-W结节组肾小球滤过率较无K-W结节组低,血肌酐、尿蛋白、血糖、三酰甘油和胱抑素C等较无K-W结节组高,但两组间差异无统计学意义。K-W结节组糖尿病视网膜病变及出现血尿的人数比例也较无K-W结节组多,但差异也无统计学意义。上述参数虽无明显统计学意义,可能与样本量有限有关,而这些临床参数变化的趋势提示K-W结节组患者病情更重。本研究根据K-W结节出现与否为标准,分析CEUS对肾脏灌注的评估能力,结果显示,CEUS结果在对不同病理分级(Ⅱ期及Ⅲ期以上)病变中部分参数的差异具有统计学意义,证实CEUS能够对病理分期Ⅰ/Ⅱ期与Ⅲ/Ⅳ期DN血流灌注差异进行评估。
K-W结节是DN特征性的改变。DN的标志是细胞外基质(extracellular matrix,ECM)蛋白的沉积,如肾小球系膜、肾小管间质和基底膜中的胶原、层黏连蛋白和纤维连接蛋白[17]。ECM的表达增加导致肾小球和肾小管基底膜增厚和系膜基质增加,最终导致肾小球硬化和肾小管间质纤维化。特征性的肾小球系膜病变即被描述为K-W结节,有时被称为糖尿病结节性肾小球硬化。Paueksakon等[5]在含有系膜红细胞碎片的K-W结节内发现纤溶酶原激活物抑制剂-1更多,认为K-W结节的形成与微血管损伤相关。有研究认为,K-W结节的形成多位于肾小球毛细血管袢的中心区,挤压毛细血管腔,其对肾小球毛细血管袢的压迫导致毛细血管袢血流量下降,从而导致系膜区异物的蓄积,引起肾小球滤过膜通透性下降[5,18-19]。Conlin等[20]采用核磁技术评估糖尿病小鼠模型,证实肾小球系膜细胞的ECM增生严重减少了肾小球血流量,并认为ECM的扩张不可避免地“挤压”肾小球内的血管空间,粗略估计,在纤维化诱导下肾小球的血管空间下降30%。
CEUS参数中,血流灌注参数肾皮质PE在K-W结节组较无K-W结节组低,提示皮质局部微血流量低。K-W结节组WiR及WiRI较无K-W结节组低,且WiR差异有统计学意义,提示在K-W结节组,肾脏皮质微泡灌注速度及单位时间内灌注流量较无K-W结节组低。时间相关参数RT、mTT和FT在K-W结节组中均较无K-W结节组延长。上述这些改变可能是K-W结节形成后,其对毛细血管袢压迫而造成毛细血管袢血流量下降引起;此外,可能与K-W结节形成常伴随形成微小血管瘤,造成造影剂的流入及流出均有所延迟有关。本课题组前期研究DN与非糖尿病肾病(non-diabetic renal disease,NDRD)灌注差异中,观察到PE、曲线下面积等指标DN 组较NDRD组低。研究认为,灌注参数与临床CKD分期可能存在一定的相关性。而在本研究中,针对与病理分期相关的K-W结节形成与否为分组条件,PE未显示出显著的统计学差异,推测原因为,一方面病理分期与临床分期并非能够精准地一一对应,另一方面本研究有限的病例数可能限制了此类数据差异的显现。
以往研究认为,CEUS技术能够对肾髓质血流灌注进行评估[21-22]。然而,Yang等[23]研究显示,髓质参数可能会被髓质周围的血管或皮质强度影响而不够准确。本研究在数据收集过程中,对患者吸憋气进行检查前培训,患者多能达到较为理想的状态,即肾脏随呼吸上下移动平缓。在髓质数据采集中尽量选取垂直距离接近肾脏皮质处的区域,以最大程度降低髓质周围小血管的影响。但为尽可能减小髓质周围血管及皮质的影响,分析中采用皮质参数与髓质参数的比值进行比较。Yi等[24]研究显示,肾髓质只接受总肾血流量10%左右,肾脏双肾毛细血管系统可以解释肾皮质和髓质灌注模式的显著差异。血液在髓质前供应到肾皮质,肾皮质的强化是早期、均匀和较强的;随后髓质逐渐不均匀强化,表现为延迟峰值,且呈稀疏强化。早期皮质快速流入反映了血液流入肾小球。延迟峰值可能代表第二毛细血管床的肾小管灌注,同时逐渐流入髓质。本研究中,在CEUS血流量和灌注强度参数方面,K-W结节组皮质与髓质的PE之比,WiR、WiRI和WoR之比均较无K-W结节组小,提示皮质与髓质血流灌注差异在K-W结节组更为显著。而时间相关参数皮、髓质FT之比则在K-W结节组大,造影剂流出延迟。在临床患者中对髓质血流灌注进行研究无疑面临着较大难度,其中最为显著的是患者的呼吸运动配合度。在肾脏CEUS参数分析中,本研究选取了皮质显影均匀、动度小的位置作为感兴趣区。而髓质位置比较局限,周围存在皮质甚至细微血管;肾脏会随呼吸运动上下运动,虽然本研究中受试者已接受了吸憋气训练,但到中后期,难以避免肾脏的运动;运动过程中,即便使用了CEUS分析软件中的运动补偿条件,也难免存在一些运动补偿欠佳的情况,导致感兴趣区在某一帧纳入了周围组织。由此本研究提出采用邻近皮、髓质比值进行分析,而摒弃了直接比较髓质参数,能够尽可能降低上述混杂因素对造影参数带来的影响。由此本研究认为,皮质与髓质比值可能较髓质相关参数更为稳定、客观。
本研究以病理诊断为基础,探讨了CEUS参数评估DN进展程度的意义。但存在以下局限性:(1)研究聚焦DN 的K-W结节,目前仅局限在K-W结节的定性诊断即有无结节形成,但对于K-W结节的数目未能进行评估。(2)纳入样本量有限,且为单中心研究。
综上,本研究结果发现,CEUS对DN的进展程度可能具有提示意义,对DN患者K-W结节形成与否的肾脏皮髓质微血流灌注能够提供定量评估参数。在K-W结节组,RT、LT延长,WiR、WoR下降。

