Ni-Cu纳米合金催化剂制备及析氧性能
安旭光,雍朝友,孔清泉,白方正,罗建军
(1.成都大学 机械工程学院,四川 成都 610106;2.四川一然新材料科技有限公司,四川 成都 610100)
0 引 言
通过研究氧析出催化剂来制备氧气是一种解决能源问题的有效途径之一[1-4].传统催化剂析氧反应(OER)因其动力学缓慢、价格昂贵、耐久性不足等特性,使得制氧成本较高,不利于商业化使用.因此,分析H2、O2和H2O之间相互转化关系,调控其电子结构、微观形貌和催化性能,建立构-效关系,研究新型OER材料,制备活性高、低反应过电位的非贵金属催化剂是当前研究的前沿热点[5-6].
Ni-Cu纳米合金是目前最有可能取代传统OER催化剂的双金属镍基催化剂之一[7].其反应动力学高、耐久性好、抗腐蚀能力强,与当前商业化的IrO2和RuO2的性能相近,且具有储量高、价格低、易回收等特点[8-9].Pan等[10]在碳网上的氮化钛纳米颗粒上用电沉积Cu-Ni合金作为催化材料,研究其析氧反应,研究结果表明在C上使用Sn作为固体载体,大大地提高了其反应动力学性能.Ahsan 等[11]报道了sp2碳框架下的双金属镍铜合金纳米颗粒的合成,揭示了具有析氧催化性能的非贵金属双金属纳米结构的结构-功能关系.Gautam等[12]研究了Ni-Cu纳米颗粒和团簇的OER电催化反应,解释了这种新型纳米结构催化剂的催化机理.
本研究以Ni-Cu纳米催化剂为体系,采用电沉积法制备调控Ni-Cu纳米合金催化剂的成分,采用XRD、SEM和TEM对制备的纳米粉体的形貌、微观结构和化学成分进行了定性分析.采用I-t和循环伏安法(CV)研究了Ni-Cu纳米合金催化剂在0.1 mol/L KOH电解液中的OER活性和耐久性,筛选出了最佳OER性能的原子配比(8∶2).其结果表明,Ni0.8Cu0.2OER催化剂具有较低的起始过电位(约为132 mV)和较高的电化学活性比表面积(ECSA),(约为5.45 cm2).通过合金化控制,3组不同配比的Ni-Cu纳米合金催化剂均表现出了较高的I-t耐久性(约为27,000 s).以上结果表明,通过调控Ni-Cu组分和微观形貌,分析催化剂OER性能,建立物理结构与OER性能之间的构效关系,对制备高性能Ni-Cu合金催化剂具有重要作用.
1 实验部分
1.1 材料与仪器
1.1.1 实验材料
硝酸铜(三水)(Cu(NO3)2·3H2O,99.9%)、氯化镍(六水)(NiCl2·6H2O,99.9%)、氢氧化钾(KOH,99.9%)、无水乙醇(C2H6O,99.7%),购于成都市科龙化工试剂厂;去离子水,购于四川优普超纯科技有限公司.
1.1.2 实验仪器
电化学工作站(CHI660E),上海辰华仪器有限公司;电子分析天平,梅特勒—托利多仪器(上海)有限公司;扫描电镜(FEI Inspect F50),赛默飞世尔科技公司;DX系列X射线衍射仪,丹东浩元仪器有限公司;透射电子显微镜(JEM-2100),日本电子株式会社;KQ-400KDE型高功率数控超声波清洗器,昆山市超声仪器有限公司.
1.2 Ni-Cu合金催化剂制备
1.2.1 电极预处理
将玻碳片(GC)进行超声洗涤10 min,置于0.1 g氧化铝粉中进行机械抛光去除表面吸附杂质.将抛光的GC置于无水乙醇(5 mL)和去离子水(50 mL)混合溶液中超声洗涤,去除表面氧化铝粉和表面静电后,置于真空干燥箱中干燥15 min备用.
1.2.2 溶液制备
按不同配比(8∶2、5∶5、2∶8)依次配制0.1 mol/L 20 mL的氯化镍和硝酸铜的混合溶液,使用电子天平分别对以下成分配比进行配料:Ni0.8Cu0.2(0.380 g氯化镍和0.097 g硝酸铜)、Ni0.5Cu0.5(0.238 g氯化镍和0.242 g硝酸铜)、Ni0.2Cu0.8(0.095 g氯化镍和0.397 g硝酸铜).用量筒分别量取20 mL去离子水与配制好的上述化合物混合,用玻璃棒搅拌均匀,直至上述化合物完全溶于去离子水中.
1.2.3 电沉积制备Ni-Cu合金
将GC置于Pt电极夹作为工作电极,以汞/氧化汞电极(Hg/HgO)作为参比电极,铂电极作为对电极建立三电极沉积体系.
依次用I-t测试技术进行催化剂沉积,初始电压为-1 V,沉积时间为600 s,灵敏度设置为1×10-2A,取样间隔时间为0.1 s.沉积结束后采用离子水对沉积的Ni-Cu纳米合金进行表面清洗.
1.3 物理表征
1.3.1 场发射电子显微镜样品制备
将制备好的Ni-Cu纳米合金催化剂样品置于去离子水和无水乙醇溶液中浸泡10 min,用氮气吹干后,使用场发射电子扫描显微镜观测其形貌结构(SEM,FEI Inspect F50).
1.3.2 XRD样品制备及测试
采用X射线衍射仪测定催化剂样品的晶型结构(XRD).样品测试条件为:电压为40 kV,管电流为30 mA,CuKα辐射源,石墨单色器,2θ范围为10°~90°,步进角度为0.06°/s,采样时间为0.5 s.
1.3.3 透射电子显微镜样品制备
将上述Ni-Cu纳米合金催化剂从GC上剥下,放入烧杯中与乙醇混合,用超声洗涤仪超声1 min,用移液枪将Ni-Cu催化剂悬浊液滴于Mo微珊上,以透射电子显微镜(JEM-2100)进行低倍和高倍形貌观察,进行微结构分析.
1.4 电化学实验
1.4.1 三电极体系
在室温下,采用标准的三电极体系上进行Ni-Cu纳米合金催化剂的电化学性能测试,电极组成包括:工作电极,饱和氧化汞电极(1 mol/L KOH)为参比电极,铂片为对电极,电解质溶液为0.1 mol/L KOH.
1.4.2 线性扫描伏安法(LSV)曲线
采用线性扫描伏安法测定Ni-Cu纳米合金催化剂性能,检验其OER性能活性描述符(起始电位和过电位),扫描电位为0~0.7VHg/HgO,扫描速度为10 mV/s,相对于标准氢电极电势(RHE)进行测试电位校正,VRHE=VHg/HgO+0.0591*pH(V)+0.098(V),式中,0.098 V为室温下Hg/HgO的标准电极电势.
1.4.3 电流-时间(I-t)曲线
采用电流-时间法(I-t)测试Ni-Cu纳米合金催化剂的耐久性,测试时间为27 000 s,起始电位为-1 V,采样间隔为0.1 s,灵敏度为1×10-2A.根据电流随时间的变化趋势评价Ni-Cu纳米合金催化剂的耐久性.
1.4.4 电化学活性面积(ECSA)的测定
采用循环伏安法(CV)测定Ni-Cu纳米合金催化剂表面活性位的循环变化趋势,通过测定工作电极GC表面催化剂量,即双电层电容(Cdl)来评估Ni-Cu纳米合金催化剂电化学活性表面积(ECSA).其初始电位为-0.26 V、终点电位为-0.14 V,测定Ni-Cu纳米合金催化剂在不同扫描速度(40 mV/s、60 mV/s、80 mV/s、100 mV/s)下的CV曲线,根据阳极电流密度(Ja)和阴极电流密度(Jc)的差值与扫描速率(v)的直线关系,获得工作电极的双电层电容Cdl,其中,ECSA=Cdl/Cs,Cs为单位电化学活性面积的镍基材料在0.1 mol/L KOH溶液中的比活性,在碱性溶液中一般取0.022~0.130 mF/cm2,对于镍基材料取0.04 mF/cm2.
2 结果与讨论
催化剂性能评价包含活性和耐久性两个重要指标.活性是催化剂工作效率重要描述符,而催化剂耐久性是催化剂工作稳定性和工作寿命的重要指标.
2.1 Ni-Cu纳米合金催化剂制备方法
本研究采用I-t时间电流曲线对Ni-Cu材料进行沉积,如图1所示.随着沉积时间增加,沉积电流逐渐增大,催化剂沉积量增加,其总电量Q=4.3C,根据电量Q/e等公式得出催化剂的量为0.66 mg.
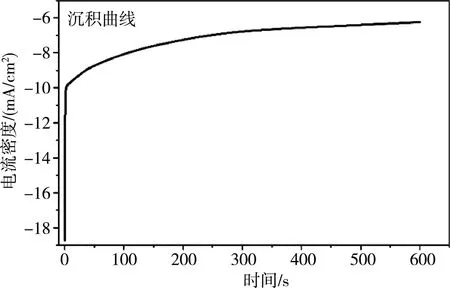
图1 Ni0.8Cu0.2纳米合金催化剂沉积曲线
2.2 催化剂微观结构
图2所示为Ni-Cu纳米合金催化剂的XRD衍射图谱.
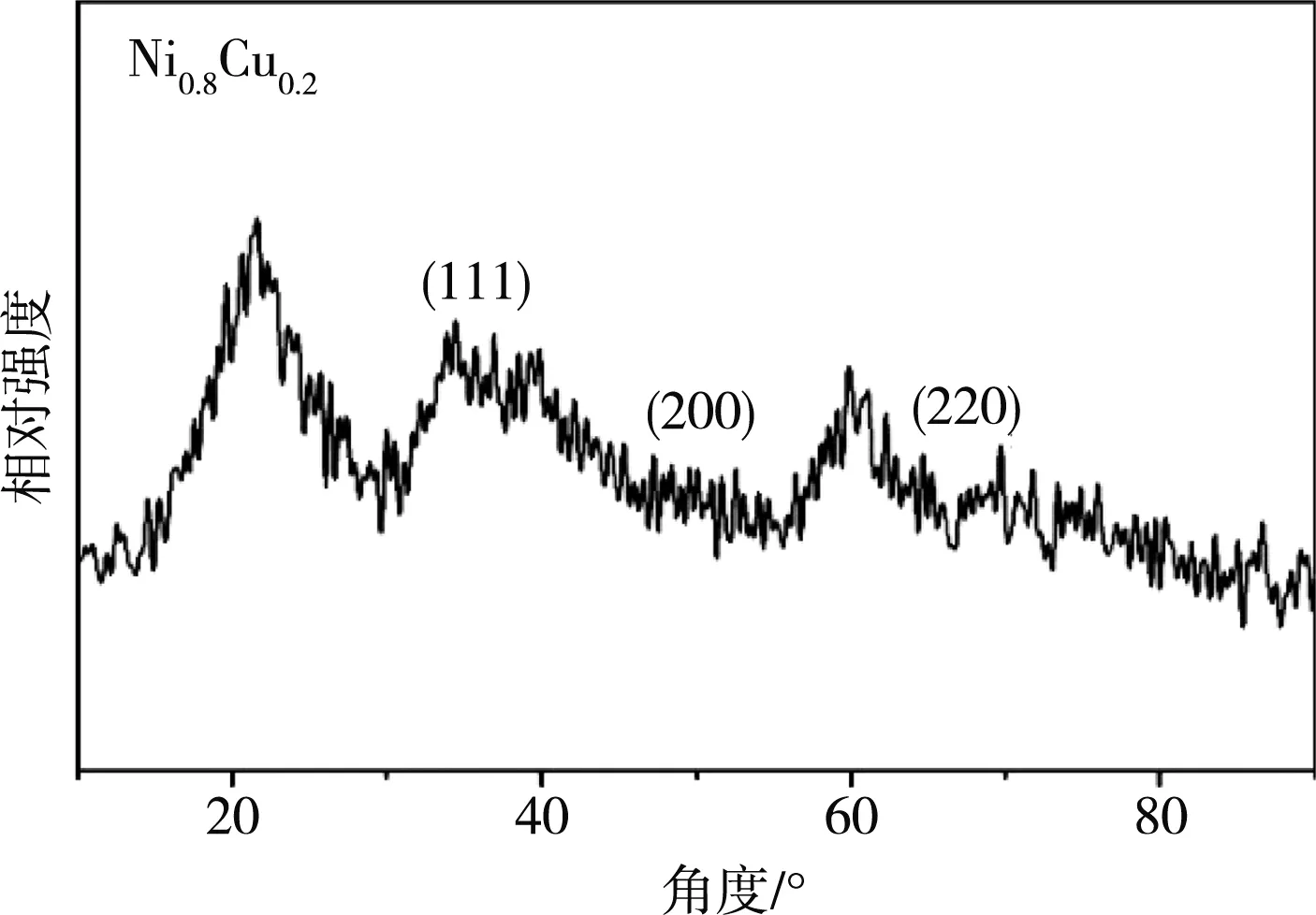
图2 Ni0.8Cu0.2的XRD图谱
由图2可见,Ni-Cu合金中2θ=43.47°、50.76°和74.74°的衍射峰分别为Cu3.8Ni(PDF#00-009-0205)相的(111)、(200)和(220)晶面,说明Cu和Ni产生的合金化作用使得其峰位偏移,从而区别于纯铜、纯镍.此外,在该图谱中并没有出现纯铜、纯镍的衍射峰,证明在该尺度下,铜镍形成了完全固溶体合金,区别于传统Ni-Cu合金固溶度较低的特点(0.1%~1.2%).
图3(a)为Ni0.8Cu0.2纳米合金催化剂SEM形貌特征.由图可知,在电沉积制备过程中,由于GC表面大量析氧未及时排出,在镀层表面大量富集形成了气泡,破裂后导致Ni0.8Cu0.2的表面呈疏松多孔、团聚蜂窝状枝晶,其颗粒尺寸约为200 nm.从图3(b)的TEM高分辨图可以看出,Ni-Cu纳米颗粒形貌均匀,约为200 nm,与扫描电镜测试结果一致.其表面晶格条纹清晰,晶面间距为0.28 nm.与XRD衍射结果(PDF#00-009-0205)进行对比分析,表明该条纹为Ni-Cu的(200)晶面.

(a)Ni0.8Cu0.2纳米合金催化剂SEM图
这种特殊形貌的晶体结构有利于提升催化剂的比表面积,提升催化剂的应用效率[13-14].同时,(200)晶面的台阶状形貌的形成是由于纳米颗粒定向生长而成,其表面具有更丰富的吸附区,更利于H2O分子的吸附,从而降低其吸附能[15-16].
2.3 Ni-Cu合金电催化活性
图4(a)为Ni-Cu纳米合金析氧催化剂的LSV测试结果.由图4(a)可知,在活性区间(约1.45VRHE)相同电压下,Ni0.8Cu0.2纳米合金的电流密度分别为Ni0.5Cu0.5和Ni0.2Cu0.8纳米合金的2.5倍和1.5倍,表明Ni-Cu基材料组分对催化剂活性具有直接作用,调控催化剂成分可优化催化剂性能,其最优成分原子比为8∶2.图4(b)为Ni-Cu纳米合金析氧催化剂的塔菲尔斜率,其转化公式为η=blogJ+a[17].如图4(b)所示,Ni0.8Cu0.2、Ni0.2Cu0.8和Ni0.5Cu0.5纳米合金的Tafel斜率分别为60 mV/dec、68 mV/dec和77 mV/dec,表明合金化作用对反应动力学区域产生了调控作用.当镍和铜的原子比为8∶2时,其增强最大,比Ni0.2Cu0.8纳米合金降低8 mV/dec;比Ni0.5Cu0.5降低17 mV/dec.表明在Cu原子的电子微扰作用下,Ni的表面反应速率得到增强.

(a)LSV曲线
图5为Ni0.8Cu0.2、Ni0.2Cu0.8和Ni0.5Cu0.5纳米合金在起始电位和过电位时的电流密度对比图.如图5(a)所示,Ni0.8Cu0.2、Ni0.2Cu0.8和Ni0.5Cu0.5纳米合金的起始电位分别为132 mV,148 mV和155 mV.通过Cu的合金化调控Ni0.8Cu0.2起始电位,与Ni0.2Cu0.8和Ni0.5Cu0.5相比分别降低了16 mV和23 mV,证明其反应动力学增强,与图4(b)塔菲尔曲线斜率表征结果一致.如图5(b)所示,Ni0.8Cu0.2、Ni0.2Cu0.8和Ni0.5Cu0.5纳米合金的过电位分别为164 mV,203 mV和225 mV,表明合金化作用对Ni0.8Cu0.2活性区域具有增强作用.
2.4 电化学活性表面积分析
电化学活性表面积是催化剂活性指标的重要描述符[17-20].比表面积对指导催化剂制备,调控催化剂性能具有重要参考意义.图6(a)所示为Ni0.8Cu0.2在约0.6~0.72VHg/HgO的循环伏安曲线(CV),扫描速度分别为40 mV/s、60 mV/s、80 mV/s、100 mV/s.随着扫描速度增加,电流密度有规律地增大,说明该反应受扩散控制.
Ni0.8Cu0.2和Ni0.5Cu0.5的ESCA拟合曲线如图6(b)所示,其拟合点的电流密度和扫描速度为一次函数关系,其双电层电容Cdl分别为0.218 mF和0.170 mF.当Cs为0.04 mF/cm2时,其ECSA分别为5.45cm2和4.25cm2(如图6(c)所示).结果表明,Ni含量增加对Ni0.8Cu0.2的活性表面积增强具有促进作用,调控Ni含量有助于增大Ni-Cu合金催化剂的比表面积,提升其催化剂性能.
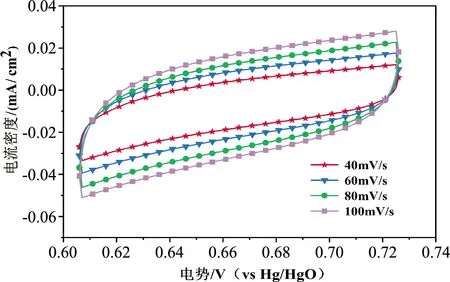
(a)不同扫描速度循环伏安曲线
2.5 Ni-Cu合金催化剂的耐久性
本研究采用I-t测试技术,对比分析了催化剂放电效率随使用时间的变化规律,研究了Ni0.8Cu0.2、Ni0.2Cu0.8和Ni0.5Cu0.5的耐久性如图7所示.

图7 Ni0.8Cu0.2、Ni0.2Cu0.8和Ni0.5Cu0.5纳米合金催化剂电流密度随时间变化曲线
结果表明,Ni0.8Cu0.2、Ni0.2Cu0.8和Ni0.5Cu0.5纳米合金催化剂在其电流密度稳定之后均具有较高的OER稳定性,在经过27 000 s长时间运行后,其残余活性仍然高达190.91 mA/g、66.66 mA/g和45.45 mA/g.Ni0.8Cu0.2的残余电流密度值为Ni0.5Cu0.5的4倍,说明增大其Ni元素的含量可以有效地提高纳米合金催化剂的耐久性,调控催化剂组分对催化剂耐久性的提升具有重要意义.
3 结 论
本研究采用电沉积法制备了一种高性能的Ni-Cu纳米合金催化剂.物性分析结果表明,该材料为形貌均一的多晶材料,其纳米颗粒表面主要为(200)晶面.XRD分析结果表明,Cu和Ni在纳米尺度下合金化程度较高,形成了固溶体合金,不同于传统Cu-Ni固体合金材料的固溶度(为1%).根据成分分析和性能对比研究建立了组分-性能的构效关系,结果表明,通过组分调控Ni0.8Cu0.2的活性比Ni0.5Cu0.5的活性提升了2倍,耐久性高达27 000 s,残余活性为Ni0.5Cu0.5的4倍.本研究提供了一种调控Ni-Cu纳米合金性能的有效方法,该方法降低了OER催化剂的制备成本,对绿色可持续制备O2具有积极作用.

