安肠愈疡汤对溃疡性结肠炎大鼠三叶因子3蛋白表达及肠道菌群的影响
王晗潞,王帅,孙大娟,梁峻尉,尹德菲,迟莉丽
1.山东中医药大学中医学院,山东 济南 250014;2.山东省中医院,山东 济南 250014
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性炎症性疾病,其发生发展与遗传易感性、免疫系统失调、肠道菌群紊乱、炎症介质等因素密切相关。研究发现,肠黏膜屏障功能失调、肠道菌群紊乱在UC的发病中扮演重要角色[1-2]。三叶因子3(TFF3)是肠黏膜修复因子,可与黏蛋白相互作用,增强黏膜屏障功能,在保护胃肠道黏膜和溃疡修复过程中发挥重要作用[3-4]。肠道菌群失调使肠致病菌数量增多,导致肠黏膜通透性增加,致病菌、毒素更易通过肠黏膜,进而引发肠道长期炎症刺激,甚至促使结肠黏膜癌变[5-6]。因此,修复损伤肠黏膜,恢复肠道菌群平衡是治疗UC的关键。目前,西医治疗UC的药物主要是5-氨基水杨酸类制剂、糖皮质激素等,虽起效快,疗效确切,但易发生不良反应。中药在防治UC方面具有独特优势,具有修复肠黏膜损伤、调节微生态等作用,可长期维持UC缓解、降低复发率[7-11]。本课题组前期从基因水平探讨了安肠愈疡汤对UC大鼠TFF3的调控作用[12],但安肠愈疡汤对TFF3蛋白表达及肠道菌群的影响,以及TFF3与肠道菌群的相关性尚不明确。本研究在前期研究基础上,进一步观察安肠愈疡汤对UC大鼠TFF3蛋白的调控作用及对肠道菌群的影响,并探讨TFF3与肠道菌群的关系,为中西医结合治疗UC提供依据。
1 材料与方法
1.1 动物
SPF级SD大鼠36只,雌雄各半,体质量(200±20)g,济南朋悦实验动物繁育有限公司提供,动物许可证号SCXK(鲁)20190003。饲养于山东省中医院动物实验中心,温度20~26 ℃,相对湿度40%~70%,进食标准饲料,通风环境。实验过程通过山东省中医院动物伦理审查批准(AWE-2019-002)。
1.2 药物及制备
安肠愈疡汤(黄芪30g,败酱草30g,黄连9g,麸炒白术30g,薏苡仁30g,黄芩9g,白及12g,木香9g,槟榔15g,炒白芍12g,当归9g,防风6g,地榆炭15g,甘草9 g),饮片购于山东省中医院中药房,浸泡3 h,武火煎煮25 min后再文火煎煮20 min,合并2次煎液,水煎浓缩为含原药材0.375、0.75、1.5 g/mL,过滤,置于4 ℃冰箱保存;美沙拉嗪缓释颗粒,法国Ethypharm,批号190108。
1.3 主要试剂与仪器
葡聚糖硫酸钠(DSS,MP Biomedicals公司),Qiagen QIAamp粪便DNA提取试剂盒(德国Qiagen公司),16S V4区引物515F-806R(北京诺禾致源),Phusion®高保真DNA聚合酶(美国New England Biolabs公司),产物纯化Gene JET胶回收试剂盒(美国Thermo Scientific公司),Ion Plus Fragment Library Kit 48 rxns建库试剂盒(美国Thermo Fisher公司),Ion S5TMXL测序系统(美国Thermo Scientific公司),16S V4区测序委托北京诺禾致源完成。移液器,法国GLISON公司;低温离心机,美国Thermo IEC公司;ND-1000分光光度计,美国Thermo Scientific公司;化学发光图像分析仪,日本富士公司。
1.4 分组、造模及给药
大鼠随机分为空白组、模型组、美沙拉嗪组和中药低、中、高剂量组,每组6只。参考文献[13]采用自由饮用4.5%DSS溶液7 d方法制备UC模型。各给药组于饮用DSS溶液第2日起给予相应药物灌胃,中药浓度为0.375、0.75、1.5 g/mL,美沙拉嗪为0.035 g/mL,空白组和模型组给予等体积蒸馏水灌胃。给药体积均为2 mL/100g,连续2周。
1.5 取材
陈颐磊百思不得其解,鬼子的凶残他是知道的,南京一役,公然违反日内瓦条约,集中屠杀大批放下武器的国军官兵。
1.6 观测指标及检测方法
1.6.1 结肠黏膜组织病理学评分
医护英语的教学目的是培养具有专业学科知识又有外语技能的复合型人才,其教学逐渐成为医学院校英语教学的一个重要组成部分。随着大数据、人工智能时代的到来,教学与学习方式发生了翻天覆地的变化[1]。如何顺应时代潮流,利用智能互联网技术来推进医护英语教学的创新和发展,提高医护英语教学质量和效果是医护英语教学者所面临的新挑战。笔者在安徽中医药高等专科学校一年的医护英语教学实践中尝试了“智慧课堂”的教学模式,并取得了比较好的教学效果。
参照文献[14]进行组织病理学评分,详见表1。
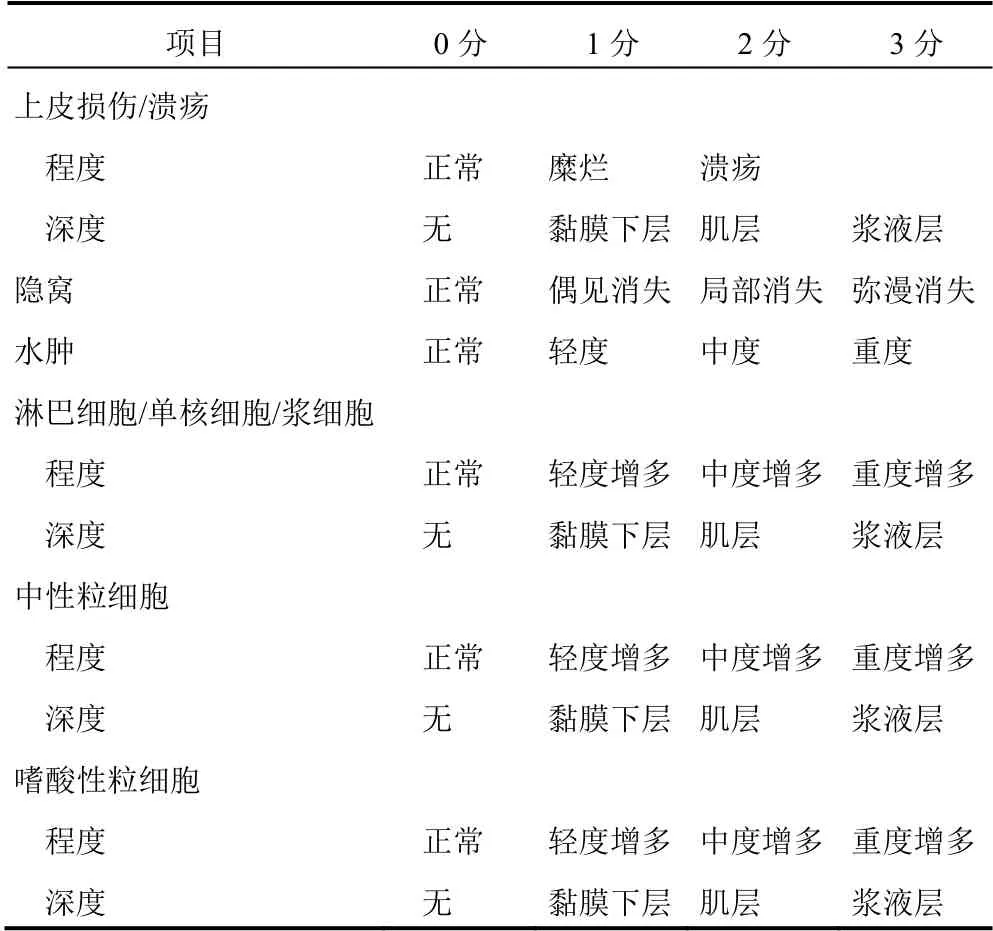
表1 大鼠结肠黏膜组织病理学评分标准
各地旅游产品出现同质化现象,各类旅游产品竞争激烈,特色化、差异化的经营策略是持久竞争力的重要保证,在日间旅游项目日益饱和的情况下,夜间旅游开发实现了同类产品在不同时间段的竞争,为城市旅游开拓新的路径[7]。在经营时间和旅游项目上,合肥夜间旅游与日间旅游错位发展,不仅减少了旅游产品竞争群体,还给游客带来特殊环境氛围下的旅游体验,有利于城市旅游保持持久的竞争力。
菌群多样性与Shannon指数成正比,模型组Shannon指数较空白组降低;中药中、高剂量组及美沙拉嗪组较模型组升高。菌群丰度与ACE指数成正比,模型组ACE指数较空白组降低,中药中、高剂量组及美沙拉嗪组较模型组升高。见图4。
1.6.3 体外粪便DNA 16S rDNA测序及质控
与空白组比较,模型组大鼠结肠黏膜组织病理学评分明显升高(P<0.01);与模型组比较,各给药组大鼠结肠黏膜组织病理学评分明显降低(P<0.01),其中,中药高剂量组降低最明显。见表2。
1.7 统计学方法
采用SPSS21.0统计软件进行分析。计量资料用±s表示,符合正态分布用t检验,多组间比较若方差齐用方差分析,若方差不齐用非参数秩和检验。P<0.05表示差异有统计学意义。
干预结束后,收集大鼠粪便至无菌EP管,-80 ℃保存。大鼠麻醉后取距肛门1 cm以上结肠组织,沿肠系膜纵轴剪开,0.9%NaCl溶液冲洗,肉眼观察炎症、溃疡情况,取病变最明显组织约0.5 cm,4%多聚甲醛溶液固定,石蜡包埋,4 μm连续切片,HE染色,剩余结肠组织-80 ℃冻存。取材结束后,大鼠注射高浓度戊巴比妥钠溶液进行安乐死。
2 结果
2.1 病理观察结果
空白组大鼠结肠组织完整,未见糜烂、溃疡;模型组大鼠结肠组织可见溃疡,局部隐窝消失,可见大量淋巴细胞、浆细胞浸润及隐窝炎;美沙拉嗪组大鼠结肠组织黏膜下层轻度水肿,可见少量炎性细胞浸润;中药低剂量组大鼠结肠组织仍可见溃疡、隐窝炎,伴大量淋巴细胞、浆细胞浸润;中药中剂量组大鼠结肠组织溃疡愈合,组织轻度水肿,可见少量淋巴细胞、浆细胞浸润;中药高剂量组大鼠结肠组织溃疡愈合,固有层轻度水肿,少量炎性细胞浸润。见图1。
1.6.2 Western blot检测三叶因子3蛋白表达
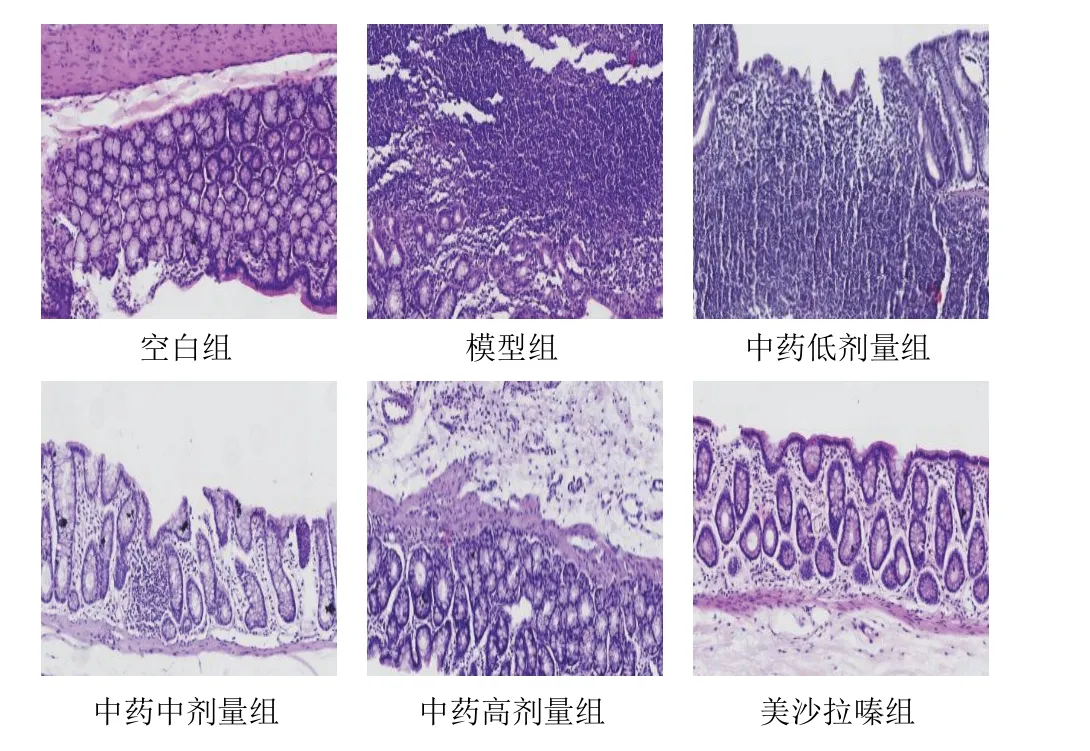
图1 各组大鼠结肠组织形态(HE染色,×200)
2.2 病理学评分结果
采用CTAB方法对样本的基因组DNA进行提取,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的样本DNA置于离心管,使用无菌水稀释样本至1 ng/μL。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物、Phusion®High-Fidelity PCR Master Mix with GC Buffer和高保真DNA聚合酶进行PCR,确保扩增效率和准确性。PCR产物使用2%琼脂糖凝胶进行电泳;根据PCR产物浓度进行等量混样,充分混匀后使用1×TAE浓度2%琼脂糖胶电泳纯化PCR产物,剪切回收目标条带。使用Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库构建,经Qubit定量和文库检测合格后,使用Ion S5TMXL测序系统测序。利用Uparse软件对所有样品的全部Clean Reads进行聚类,默认以97%一致性将序列聚类为OTUs,进行物种注释分析(阈值0.8~1),使用R软件绘制稀释曲线、物种累积曲线,使用Qiime软件计算Shannon指数、ACE指数,并统计门、属水平OTU聚类情况,进行相对丰度分析。
表2 各组大鼠结肠黏膜组织病理学评分比较(±s)

表2 各组大鼠结肠黏膜组织病理学评分比较(±s)
注:与空白组比较,##P<0.01;与模型组比较,**P<0.01
组别 只数 病理学评分 空白组 6 2.50±2.07 模型组 6 15.33±1.51## 中药低剂量组 6 9.50±2.51** 中药中剂量组 6 5.33±1.16** 中药高剂量组 6 1.83±1.60** 美沙拉嗪组 6 2.83±1.17**
2.3 安肠愈疡汤对模型大鼠三叶因子3表达的影响
详参拙作《陆游的双面形象及其诗文之形态与观念》,《陆游与鉴湖》,61-72页,人民出版社2011年12月。
众所周知,16世纪以来钓鱼岛就属于中国领土,而非日本长期侈谈的“无主岛屿”。而现在的钓鱼岛问题之所以成为“问题”,完全是由于日本的血腥侵略造成的。
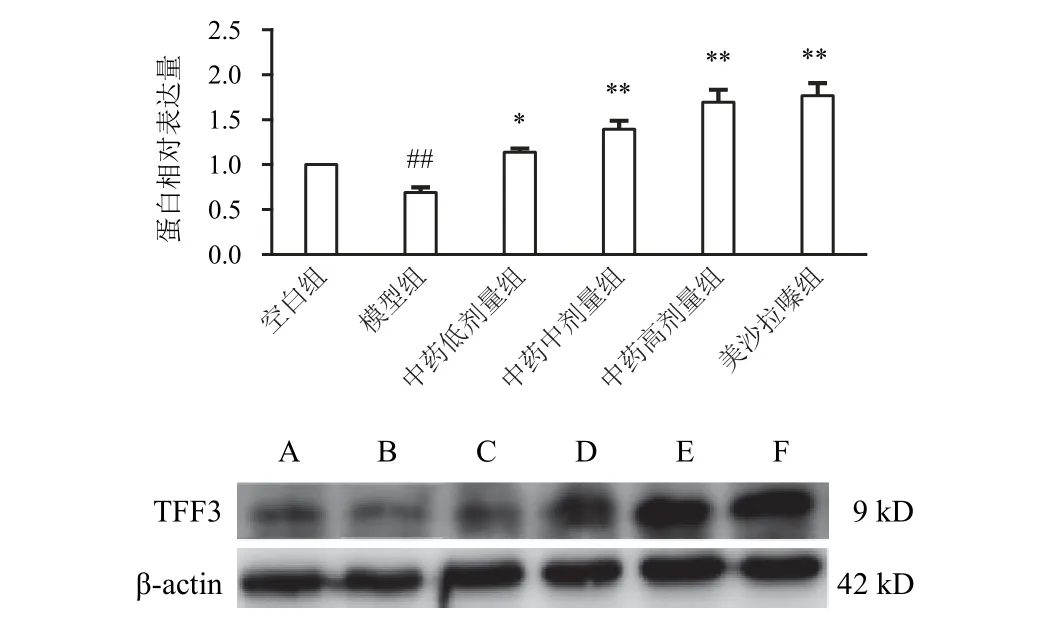
图2 各组大鼠结肠组织TFF3蛋白表达比较(±s,每组6只)
2.4 肠道菌群测序质量评估结果
观察稀释曲线,曲线随着测序深度的增加而逐渐平坦,提示测序深度足够。观察物种累积箱形图,曲线随着样品量的增加而逐渐平坦,提示样品量足够。见图3。
图3 肠道菌群测序质量评估
2.5 肠道菌群多样性、丰度分析结果
大鼠结肠组织裂解,离心,取上清液,电泳,转膜,取出NC膜,平皿1×PBST洗2遍,5%脱脂牛奶封闭过夜,加TFF3一抗、二抗孵育,漂洗后显影、定影,图像分析。
与空白组比较,模型组大鼠结肠组织TFF3蛋白表达明显降低(P<0.01);与模型组比较,各给药组大鼠结肠组织TFF3蛋白表达明显升高(P<0.05,P<0.01),其中,中药高剂量组升高最明显。见图2。
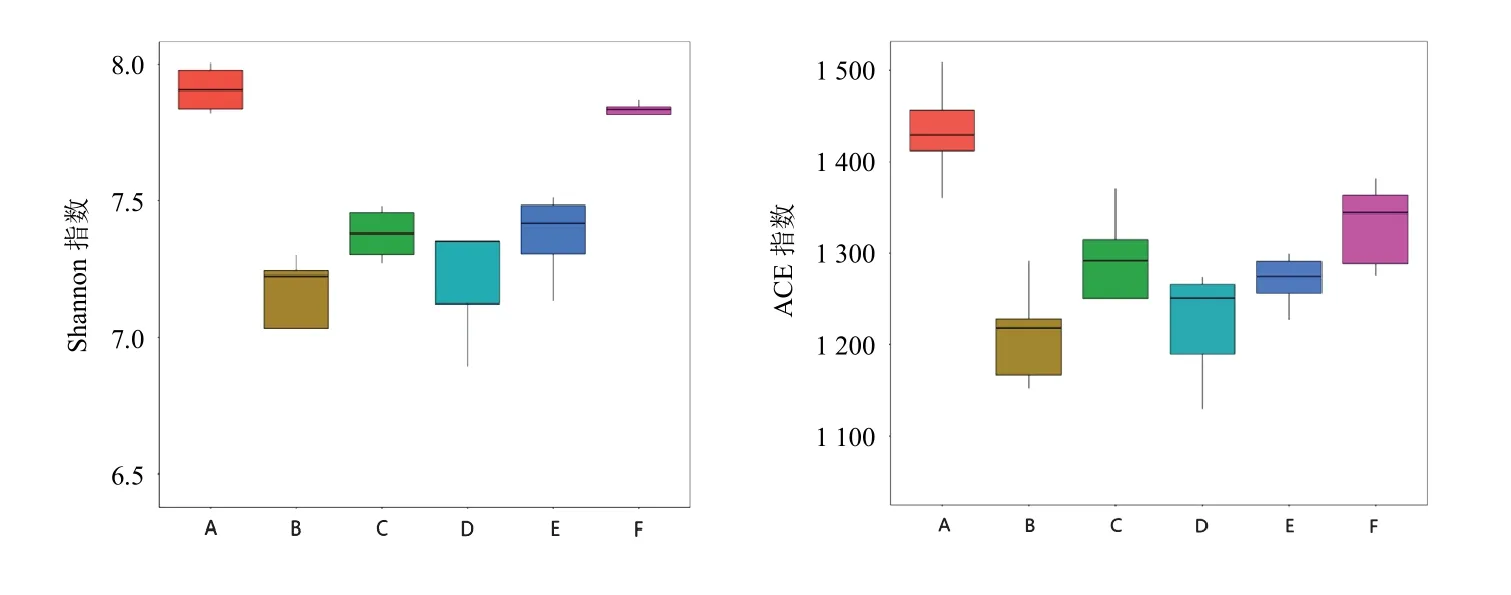
图4 各组大鼠肠道菌群Shannon指数、ACE指数箱型图
2.6 大鼠肠道菌群结构组成
门水平上优势菌门为厚壁菌门Firmicutes、拟杆菌门Bacteroidetes,见图5。各组F/B比值由低到高依次为空白组(1.17)<中药高剂量组(1.20)<美沙拉嗪组(1.28)<中药中剂量组(1.38)<中药低剂量组(1.72)<模型组(1.94),见表3。属水平上优势菌属前2位分别为拟杆菌属Bacteroides、乳杆菌属Lactobacillus。模型组较空白组拟杆菌属丰度升高,乳杆菌属丰度下降;与模型组比较,各给药组拟杆菌属丰度下降,乳杆菌属丰度升高。见图6。

图6 各组大鼠肠道菌群属水平丰度柱形累加图
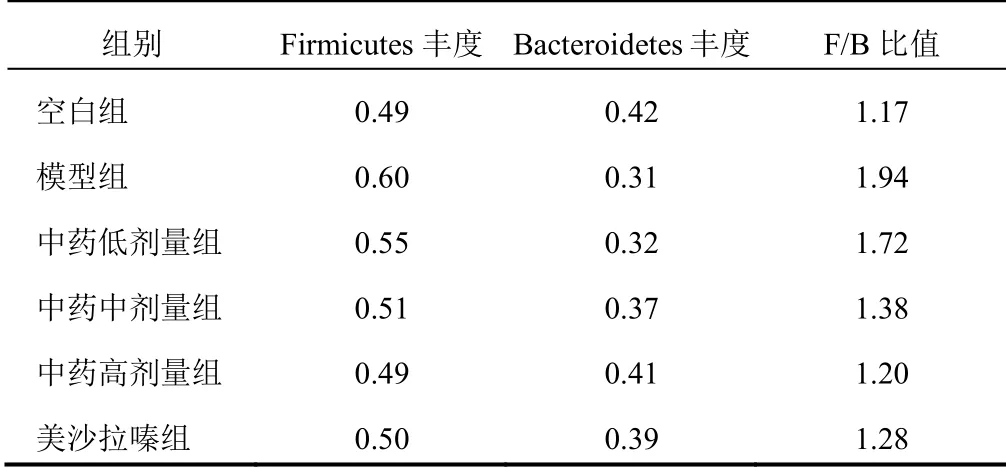
表3 各组大鼠肠道菌群F/B比值比较
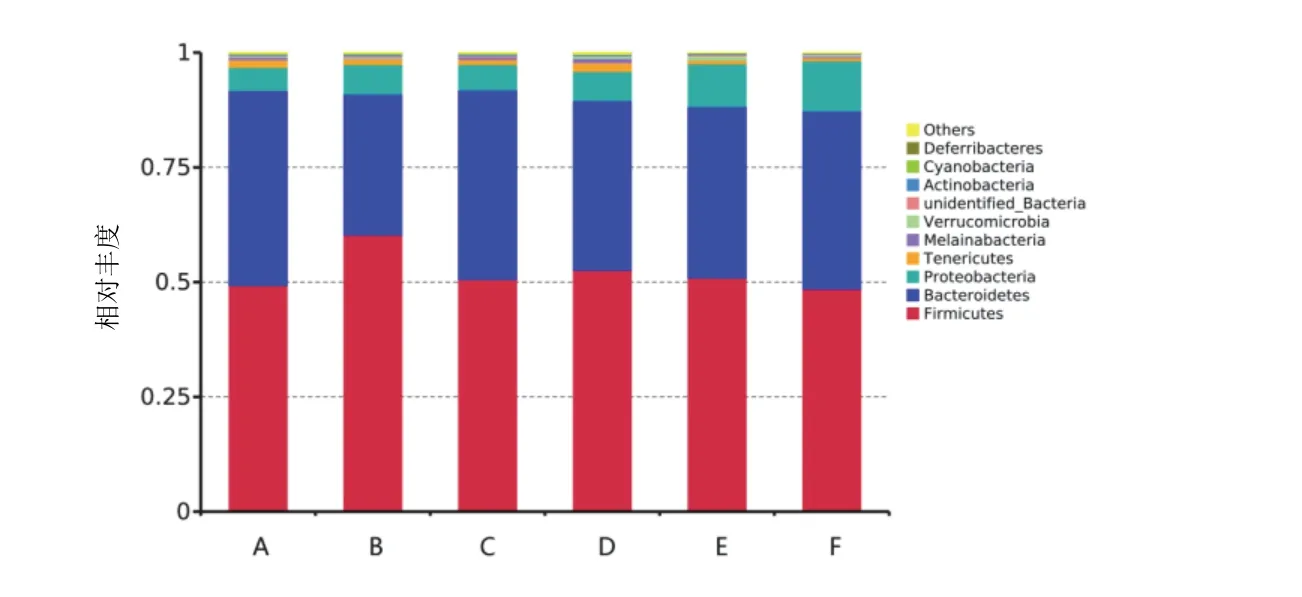
图5 各组大鼠肠道菌群门水平丰度柱形累加图
3 讨论
UC治疗目标从最初的“症状改善和临床缓解”逐渐转变为“诱导并维持临床缓解及黏膜愈合”[15-16]。恢复正常肠黏膜屏障功能是治疗UC的关键,肠黏膜屏障由机械屏障、生物屏障、免疫屏障、化学屏障共同构成[17]。TFF3在机械屏障中发挥重要作用,可刺激血管表皮生长因子表达,促进血管生成,修复肠上皮[18]。研究表明,TFF3是UC黏膜愈合的生物标志物之一[19]。肠道菌群作为生物屏障,可促进肠道相关淋巴组织发育及肠道免疫细胞分化,保护肠道[20]。菌群丰度、多样性减少,可使肠道屏障功能受损而引发UC。F/B比值被认为是评估肠道菌群紊乱的关键参数。研究发现,在急性UC发病过程中F/B比值显著升高[21]。拟杆菌属为致病菌,当肠道菌群失调后,可诱导免疫反应,引起大量炎性细胞聚集在肠黏膜[5]。乳杆菌属为益生菌,能维护肠黏膜屏障稳定[22]。研究发现,UC患者粪便中致病菌如肠球菌、拟杆菌等数量增多[23]。正常大鼠肠道菌群以乳酸菌属、普雷沃氏菌属等有益菌为主,UC大鼠埃希氏-志贺菌属、拟杆菌属等致病菌占主要优势[24]。
中医理论认为,脾气亏虚、邪毒湿热,湿热蕴肠,导致UC的发生发展,本课题组基于以上病机自拟安肠愈疡汤以健脾益气、化湿解毒、理气止血。
本研究结果显示,各给药组TFF3蛋白表达较模型组上调,且呈剂量依赖性,同时发现各给药组肠道菌群丰度、多样性均有提升,益生菌增加,致病菌减少。由此推测,中药复方可促使肠黏膜修复因子上调,恢复肠道菌群多样性,增加益生菌的同时减少致病菌,从而修复肠黏膜。
三是对以“合同”之名行“行政”之实不服的救济方式。出让人在出让合同中将一些实为行政行为,通过合同约定为合同行为或者出让人在行使合同权利时,借 “合同”之名,行“行政强制”之实运用国家强制力实施的一些行为,因这些行为本质上属于行政行为,受让人可通过行政复议、行政诉讼的方式进行救济。如合同约定出现违约行为时收回开采权、注销采砂许可证、停业整顿等。
TFF3与肠道菌群关系密切,其与黏蛋白相互作用形成肠上皮黏液层作为保护膜,可限制共生菌在黏膜内层定植,抑制肠道菌群与肠上皮接触,有效阻止肠微生物等对组织损伤,还为肠道菌群与宿主共生状态提供环境条件,为肠道菌群提供营养物质及结合位点[25]。当TFF3分泌减少,黏液层变薄或消失,肠黏膜通透性增加,细菌或其代谢产物穿过肠黏膜表面黏液层,粘附于肠上皮细胞,导致肠道微生物群的移位和免疫系统的激活对组织产生损伤[26]。安肠愈疡汤是间接通过影响TFF3表达进而调控肠道菌群,抑或直接对肠道菌群产生影响,有待今后进一步研究。

