miRNA-132抑制人骨肉瘤细胞的增殖和侵袭能力
王晓敏,刘瑞雪,杨杰,于梦雨,付刚
(潍坊市益都中心医院 1病理科;3泌尿外科,青州 262500;潍坊医学院附属医院 2口腔科,潍坊 261000)
骨肉瘤是一种主要发生于儿童和青少年的恶性肿瘤。病理性骨折及早期肺转移是主要的临床表现。尽管外科治疗和化疗方案不断改进,但是治疗效果仍然很差、生存率仍然很低[1]。因此,探索骨肉瘤的发生机制及寻求有效的治疗靶点及对于提高骨肉瘤的治疗效果是非常有必要的。微小RNA(microRNA,miRNA)代表内源性小片段非编码RNA家族,其长度约18~25个核苷酸,主要通过调控转录后翻译调节生物学过程[2]。研究发现调控miRNA的表达可能成为肿瘤的治疗靶点[3],miRNA-132与宫颈癌、结直肠癌等多种恶性肿瘤的发生发展有关[4,5]。但miRNA-132在骨肉瘤中的作用及机制尚无明确报道。本研究通过观察比较miRNA-132在骨肉瘤细胞系U2OS、MG63和143B中的表达水平,并通过质粒转染干预miRNA-132在骨肉瘤细胞系中的表达,检测肿瘤细胞增殖和侵袭能力的变化,探讨miRNA-132在骨肉瘤发生发展中的作用。
材料与方法
1 主要试剂
TRIzol试剂 (Life Technologies),反转录及荧光定量PCR的相关试剂 (Takara,Dalian),细胞培养用的胎牛血清(Gibco),高糖MEM(Hyclone),无血清DMEM(Gibco),促进miRNA-132表达质粒(pRFP-miRNA-132-up)及抑制miRNA-132表达质粒(pRFP-miRNA-132-down质粒)(上海吉凯),Lipofectamine 3000 (Thermo Fisher Scientific),EdU试剂盒(广州锐博生物)。Transwell小室(Corning Incorporated,33117045)。
2 细胞株、细胞培养及转染
人骨肉瘤细胞系U2OS、MG63、143B购买自ATCC细胞库,用含10%胎牛血清 (fetal bovine serum, FBS, Gibco)的高糖MEM (Modified Eagle's medium, MEM, Hyclone)培养基。37℃、含5%CO2的细胞培养箱中培养。细胞生长至对数生长期,按照Lipofectamine 3000试剂盒说明进行质粒转染。转染pRFP-miRNA-132-up、pRFP-miRNA-132-down质粒为实验组,转染空载质粒作为对照组,转染24h、48h、72h后提取RNA通过RT-qPCR检测转染效果。
3 RT-qPCR
Ttizol提取骨肉瘤细胞系总RNA并反转录合成cDNA。miRNA-132的检测,以U6作为内参照。引物由上海生物工程有限公司设计并合成,反转录引物包括:miRNA-132,5’-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGGCGA-3’;U6,5’-CGCTTCACGAATTTGCGTGTCAT-3’。扩增引物:miRNA-132上游引物,5’-AGG GCA ACCGTGGCTTTCGATT-3’;miRNA-132 下游引物,5’-ATCCAGTGCAGGGTCCGAGG-3’。U6上游引物,5’-GCTTCGGCAGCACATATACTAAAAT-3’;U6下游引物,5’-CGCTTCACGAATTTGCGTGTCAT-3’。反转录、扩增体系配置及实验过程参照之前的步骤[5]。miRNA-181、Prox1的相对表达量通过检测相对循环阈值 (Ct; 2-ΔΔCt) 来获得。
4 细胞增殖实验
将骨肉瘤细胞系U2OS、143B接种在96孔板,5×104细胞/孔,分别转染pRFP-miRNA-132-down、pRFP-miRNA-132-up质粒为实验组,以转染空载质粒作为对照组。转染48h后,按照EdU试剂盒说明书进行细胞增殖检测,Hoechst 33342复染细胞核,荧光显微镜拍照,以EdU阳性细胞与Hoechst 33342阳性细胞比值分析细胞增殖状态。
5 Transwell实验
将转染pRFP-miRNA-132-down质粒和空载质粒24h后的U2OS细胞及转染pRFP-miRNA-132-up质粒和空载质粒24h后的143B细胞进行消化处理。预先在Transwell小室内侧滤膜铺上基质胶置于细胞培养箱内2~4h,按每孔1.2×105细胞的数量加入到Transwell小室的上室,下室中加入600ml 含10%FBS 的MEM 培养基。培养48h后4%多聚甲醛固定,擦去上室内侧细胞,0.1%结晶紫复染,显微镜下观察并计数穿过小室滤膜的细胞数量。随机选取5个高倍视野,计数穿膜细胞数量。
6 统计学分析
本研究使用Prism 5.01 软件 (GraphPad Software, San Diego, CA, USA) 进行统计学分析。所有计量资料均以均数±标准差表示。两组间的计量资料采用t检验进行分析比较。三组间数据比较采用单因素方差分析。以P<0.05表示差异具有统计学意义。
结 果
1 miRNA-132在3种人骨肉瘤细胞系中的表达水平不同
RT-qPCR检测显示,在U2OS、MG63和143B 3种骨肉瘤细胞系中,miRNA-132的表达依次下降(图1)。
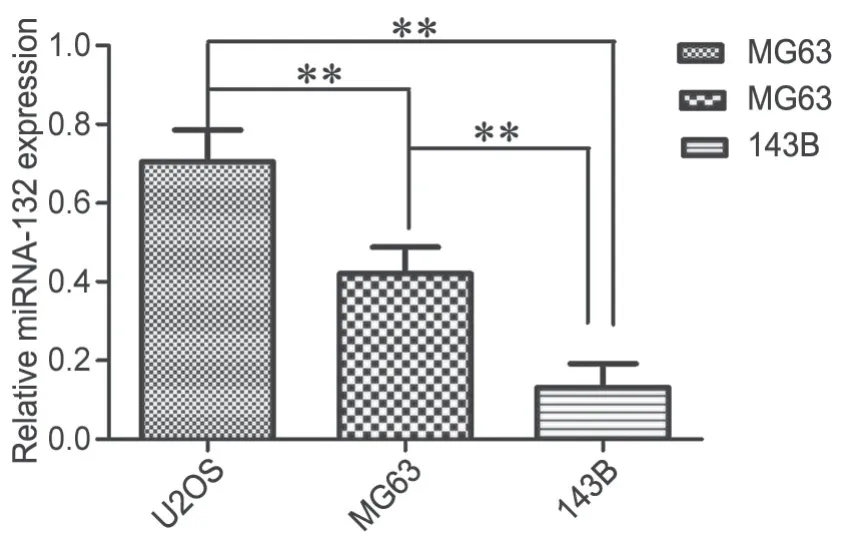
图1 RT-qPCR检测U2OS、MG63和143B人骨肉瘤细胞系中miRNA-132表达水平的统计学分析。**,P<0.01Fig.1 Statistical analysis of the expression levels of miRNA-132 in human osteosarcoma cell lines U2OS, MG63 and 143B detected by RT-qPCR.**, P<0.01
2 U2OS细胞和143B细胞系中的miRNA-132表达能分别被RFP-miRNA-132-down质粒和RFP-miRNA-132-up质粒转染有效抑制和促进
qRT-PCR检测显示,在U2OS细胞中,转染RFP-miRNA-132-down质 粒 24h、48h和 72h后,miRNA-132表达均显著下调,以转染48h后下调最为明显(图2A);在143B细胞中,转染RFP-miRNA-132-up质粒24h、48h和72 h后,miRNA-132表达显著上调,以转染48h后上调最为显著(图2B)。
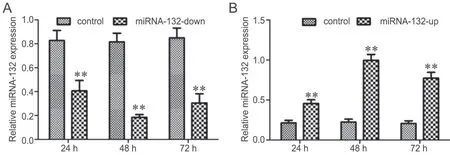
图2 RT-qPCR检测质粒转染后人骨肉瘤细胞系中miRNA-132表达水平变化的统计学分析。A,U2OS细胞系;B,143B细胞系。**,P<0.01,与对照组比较Fig. 2 Statistical analysis of the miRNA-132 expression in human osteosarcoma cell lines detected by RT-qPCR after plasmid transfection. **, P<0.01,compared to control
3 miRNA-132抑制人骨肉瘤细胞的增殖
选择影响miRNA-132表达最明显的时间点48h进行EdU实验检测细胞增殖能力变化显示,以pRFP-miRNA-132-down转染U2OS细胞后,EdU阳性细胞比例明显升高,而以pRFP-miRNA-132-up转染143B细胞后,EdU阳性细胞比例显著下降(图3)。

图3 miRNA-132对骨肉瘤细胞增殖能力影响的EdU染色检测。A,U2OS细胞;B,143B细胞。A1和B1,U2OS细胞(A1)和143B细胞(B1)代表性EdU染色结果,Hoechst33342复染细胞核;标尺,50μm。B1和B2,EdU阳性U2OS细胞(A2)和EdU阳性143B细胞(B2)比例统计学分析;**,P<0.01Fig.3 EdU staining examination for the effect of miRNA-132 on the proliferation of human osteosarcoma cell lines. A, U2OS cells; B, 143B cells. A1 and B1, representative EdU staining images of U2OS (A1) and 143B (B1) cells, counterstaining nuclei with Hoechst33342; scale bar, 50μm. B1 and B2,statistical analysis of EdU incorporation rates in U2OS cells (A2) and 143B cells (B2); **, P<0.01
4 miRNA-132抑制人骨肉瘤细胞的侵袭
转染pRFP-miRNA-132-down或pRFP-miRNA-132-up 48h后进行Transwell实验,检测不同miRNA-132表达水平对人骨肉瘤细胞侵袭能力的影响。结果显示,转染pRFP-miRNA-132-down的U2OS细胞的侵袭能力明显增加,而转染pRFP-miRNA-132-up的143B细胞的侵袭能力明显降低(图4)。
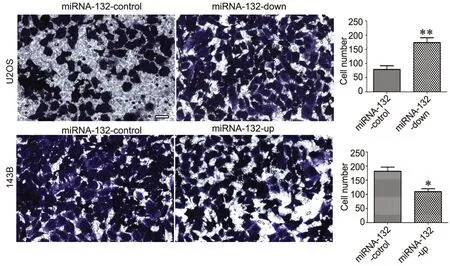
图4 miRNA-132对骨肉瘤细胞侵袭能力的影响 (标尺, 25µm),与对照组比较;*,P<0.05;**,P <0.01Fig.4 The effect of miRNA-132 on the invasion ability of human osteosarcoma cell lines (scale, 25µm), compared to control, *, P<0.05; **, P<0.01
讨 论
骨肉瘤是成骨细胞来源的恶性肿瘤。主要以发病年龄年轻、高度侵袭、高度恶性、频繁的复发及早期血道转移尤其是肺脏转移为主要临床特点,随着综合治疗方案的应用,五年生存率已提高至60%~70%,但是对于复发和转移病例,临床预后仍然很差[6]。miRNA分析可以协助确定肿瘤相关亚型、评估患者生存率和对治疗的反应, 是癌症诊断和预后评估的重要组成部分[7]。因此,探索骨肉瘤发生发展的机制,寻找有效的治疗靶点,对于骨肉瘤的早期诊断、治疗和预后具有重要意义。
近年来,miRNA在恶性肿瘤中的作用及机制日益受到关注,miRNA与目标mRNA通过碱基配对结合以后,可以降解mRNA或者抑制翻译,达到调节细胞内多种生理病理活动的目的,包括细胞的分化、生长、凋亡以及胚胎发育等,研究发现人类已知的miRNA中有50%以上是与肿瘤密切相关的,包括肿瘤的生长、转移及侵袭等[8],近年来多项研究表明miRNAs具有多靶点、组织特异性和高效性的调控特点,每个miRNA具有多个作用靶点,每个目标mRNA又能与多个miRNA结合,靶基因的作用机制和调控网络十分复杂,在肿瘤的发生发展过程中起着非常重要的作用[9-12]。国内外研究发现多个miRNA与骨肉瘤相关,miRNA-34a可以通过调控SOX-2蛋白水平调节骨肉瘤干细胞的分化和迁移能力[13]。miRNA-222骨肉瘤细胞系中的表达较正常骨组织降低,抑制mi-RNA表达可促进人骨肉瘤细胞系的增殖和侵袭[14]。
随着研究的不断深入,研究者发现miRNA-132在多种实体肿瘤中的发生和进展中也发挥着重要作用,过表达miRNA-132能够通过下调Bim-1提高宫颈癌放疗的敏感性[3]。在甲状腺癌miRNA-132通过foxA1发挥抑癌基因的功能[15]。在结直肠癌DNA的超甲基化降低了miRNA-132的表达,提示预后不良[4]。miRNA-132在骨肉瘤中的作用及机制尚无系统报道。本研究选择骨肉瘤研究中代表性的3种细胞系U2OS、MG63、143B,其中U2OS恶性程度最低,143B恶性程度最高,qRT-PCR检测显示miRNA-132在U2OS、MG63和143B中的表达水平依次下降,由此提示miRNA-132在高度恶性的骨肉瘤细胞低表达,在低度恶性的骨肉瘤细胞高表达,可能在骨肉瘤中发挥抑癌基因的作用。
为了进一步探索miRNA-132在骨肉瘤中的作用,我们分别通过过表达和低表达质粒分别转染U2OS和143B细胞,干预miRNA-132在细胞中的表达后,进行EdU染色及Transwell实验,发现过表达miRNA-132后,143B增殖能力和侵袭能力降低,而抑制miRNA-132表达后,U2OS细胞的增殖能力和侵袭能力明显增加,进一步提示miRNA-132在骨肉瘤的发生发展过程中发挥了抑癌基因的作用。目前我们对miRNA-132在骨肉瘤中的研究处于起步阶段,miRNA-132与mRNA靶基因的作用机制和信息通路,以及是否可以评估患者生存率和对治疗的反应还需要我们进一步的研究。

