白藜芦醇通过TLR4调节自噬发挥抗骨关节炎作用
董鑫,孙应许,姚嘉语,杨迎春,顾海伦,刘莉*
(1中国医科大学公共卫生学院,沈阳,110122 ;2中国医科大学附属盛京医院骨科,沈阳,110004)
骨关节炎(osteoarthritis,OA)是一种慢性退行性关节疾病,主要表现为软骨的损伤、软骨下骨的侵蚀、骨赘形成、肌肉无力以及滑膜和肌腱炎症,可出现关节疼痛、肿胀、畸形甚至残疾[1]。骨关节炎的病因涉及衰老、肥胖、遗传、创伤等[2]。目前,其发病机制尚不十分清楚,且无有效治愈措施。
白藜芦醇(resveratrol,RES)是一种天然多酚类植物抗毒素,主要来源于红葡萄皮,红酒和桑葚、蓝莓等,具有保护血管、抗炎、抗癌、抗氧化等作用[3]。研究发现,RES在预防OA的发生及减缓OA的进展方面具有潜在的应用价值[4]。RES可以剂量依赖方式显著增加软骨细胞的生长速率,减少软骨细胞降解,并明显改善软骨细胞外基质的沉积[5]。OA的发生与软骨细胞自噬密切相关。自噬是真核生物中的一种蛋白质或细胞器的降解过程,通过去除功能异常的细胞器和大分子来维持细胞稳态[6]。研究发现,RES的抗OA效应与调节自噬有关[7],但详细机制仍需探讨。Toll样受体4(Toll-like receptor 4,TLR4)是天然免疫受体家族中的一员,我们与其他学者的研究均发现其在OA发病中的重要地位。OA软骨中TLR4表达上调,而抑制TLR4可以降低相关炎症因子的表达,进而抑制OA的恶化[8]。许多研究表明TLR4诱导自噬,Xu等人通过对鼠巨噬细胞和原代人肺泡巨噬细胞的研究,证实脂多糖通过激活TLR4及其下游途径来诱导自噬[9]。RES可以抑制TLR4的表达[10],但在OA时RES对自噬的影响是否通过TLR4来介导,有待进一步探究。
因此,本研究首先观察RES对高脂饮食诱导的肥胖OA小鼠膝关节软骨自噬水平及TLR4的影响,继而探讨RES对IL-1β处理的SW1353软骨细胞自噬的影响是否涉及TLR4,以期为阐明RES的抗OA机制提供实验依据。
材料与方法
1 实验动物
选用42只7周龄雄性C57BL/6小鼠,体重18~22g,由中国医科大学实验动物部提供。小鼠适应性喂养1周后按体重随机分为对照组、高脂组和干预组,每组14只。对照组喂饲普通饲料(脂肪供能比为10%),高脂组和干预组喂饲高脂饲料(脂肪供能比为60%);对照组和高脂组给予0.5%羧甲基纤维素钠水溶液灌胃,干预组给予0.5%羧甲基纤维素钠水溶液与RES悬浊液灌胃,每日一次,RES剂量为45mg/kg/d(根据前期研究结果得到的干预剂量)。饲养期间自由进食饮水,每周称体重并记录摄食量,共22周。
2 主要仪器与试剂
主要仪器:细胞培养箱(中国上海科峻仪器公司);倒置显微镜(日本Olympus);MultiskanMK3酶标仪(美国Thermo);低温高速离心机(美国Sigma);实验动物身体组分分析仪(德国Bruker);VE-180垂直电泳槽(中国上海天能科技有限公司);化学发光检测系统(中国上海天能图像系统版本5200)
主要试剂:RES(美国Sigma Aldrich);IL-1β(美国PeproTech);TLR4抑制剂CLI-095(美国InvivoGen);BCA蛋白定量试剂盒(美国Santa);RIPA裂解液(中国北京鼎国昌盛生物技术有限责任公司);β-actin一抗(美国Santa);抗beclin 1、LC3-II、LC3-I抗体(中国武汉爱博泰克生物科技有限公司);HRP标记的山羊抗兔二抗(中国北京中杉金桥生物技术有限公司);HRP标记的山羊抗鼠二抗(中国武汉爱博泰克生物科技有限公司)。
3 细胞培养和处理
SW1353软骨肉瘤细胞系购置于中国科学院上海生科院细胞资源中心,DMEM完全培养基(含10%FBS、1%双抗),37℃、5%CO2、饱和湿度条件下的培养箱中培养。细胞共分5组:对照组、IL-1β组、IL-1β+RES组、IL-1β+RES+CLI-095组、IL-1β+-CLI-095组。待细胞融合80%~90%后,CLI-095预处理6h,再加入IL-1β或IL-1β+RES处理48h,其中IL-1β终浓度为10ng/ml,RES终浓度为50μmol/l,TLR4抑制剂CLI-095购自美国InvivoGen公司(终浓度为 2μg/ml)。
4 组织学染色
取关节组织进行固定,脱钙后石蜡包埋,制备切片。番红O-固绿染色:脱蜡至水,固绿染色,固定数秒,番红染色,酒精分化,透明,中性树胶封片;番红O染色:脱蜡至水,番红染色,乙醇镜下分化,风干,透明,中性树胶封片。
5 TLR4、beclin 1和LC3 Western blot检测
刮取小鼠膝关节软骨于液氮中研磨或收集细胞,加RIPA裂解液,BCA试剂盒定量,调至统一浓度(软骨样本 40μg/μl,细胞样本 20μg/μl)。制胶,上样,电泳,转膜,5%脱脂奶粉封闭,一抗孵育,4℃摇床过夜,HRP标记二抗孵育,ECL发光,以β-actin作为内参进行半定量分析。
6 统计分析
实验所得数据以平均值±标准差表示,用SPSS 20.0统计软件进行单因素方差分析。以P<0.05为界定差异有统计学意义。
结 果
1 白藜芦醇不影响高脂喂养小鼠体重、体脂比及摄食量
实验初始时各组小鼠体重无差异,从第2周高脂组小鼠体重开始显著高于对照组,第6周开始RES干预组小鼠体重明显高于对照组(图1A);第22周,高脂组和干预组体脂比均显著高于对照组(图1B)。实验期间,3组小鼠摄食量无明显差别(图1C)。
2 白藜芦醇减轻高脂所致骨关节炎
对照组中,番红O-固绿染色显示软骨表面光滑平整,软骨与骨界限清楚,番红O染色显示潮线清晰连续;高脂组中,软骨出现OA样的一些改变,番红O-固绿染色显示出软骨表面出现部分缺损,软骨与骨界限模糊,番红O染色可见潮线不清偶有断裂的情况;而RES干预组软骨的情况则介于对照组和高脂组之间(图2)。
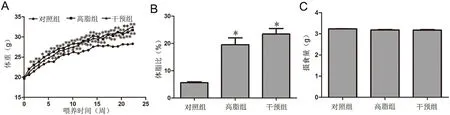
图1 高脂饮食和白藜芦醇处理对小鼠体重、体脂比及摄食量的影响。A,体重;B,体脂比;C,摄食量。与对照组相比,*0.01<P<0.05,**P<0.01, n=14Fig.1 Effect of high-fat diet and resveratrol on body weight, body fat ratio and food intake of mice A, body weight; B, body fat ratio; C, food intake.*0.01<P<0.05,**P<0.01, compared with control group; n=14
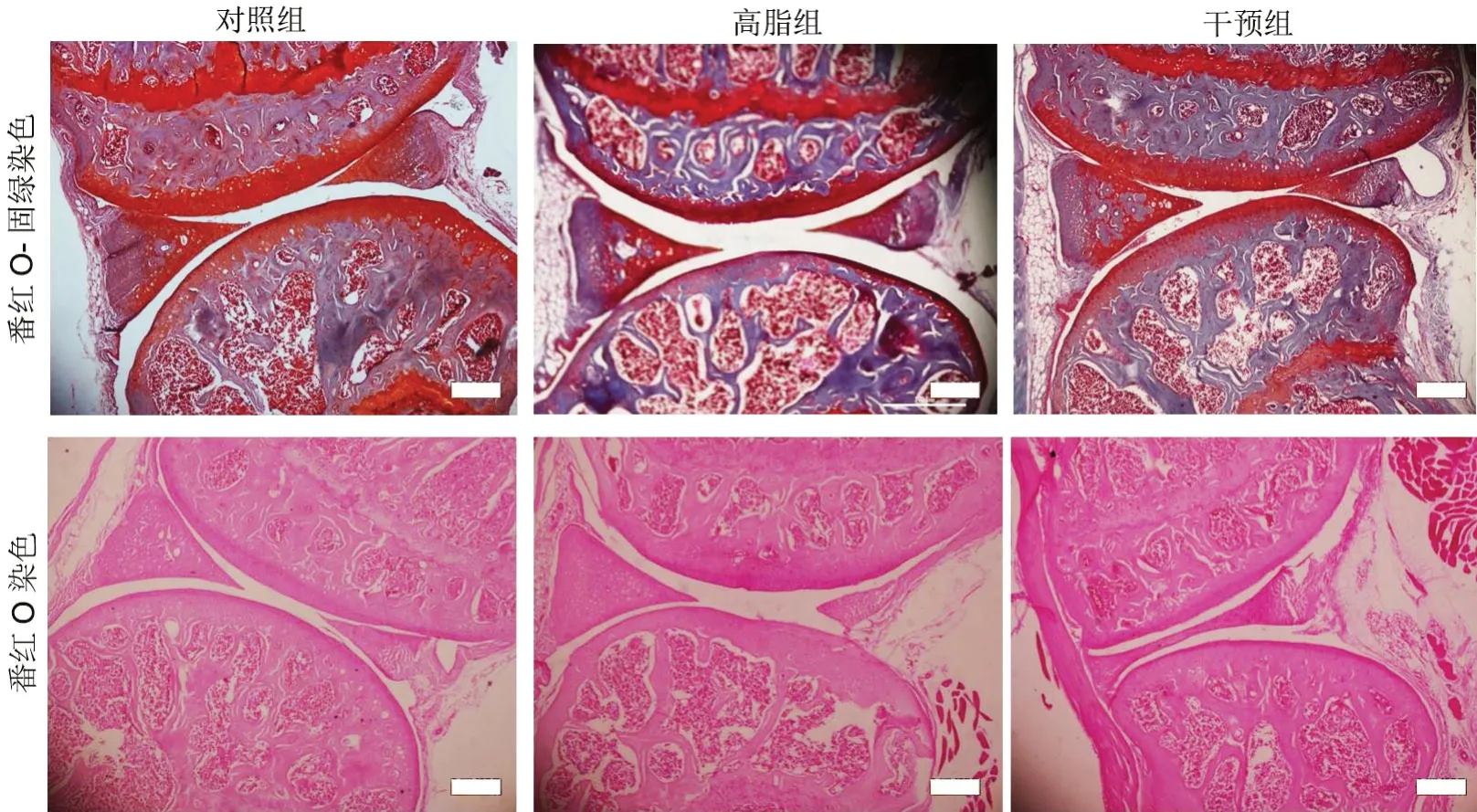
图2 小鼠关节软骨组织病理学染色。比例尺,100μmFig. 2 Histopathological staining of mouse articular cartilage. Scale bar, 100μm
3 白藜芦醇减轻高脂所致小鼠关节软骨组织内TLR4、beclin 1及LC3水平上调
Western blot检测显示:高脂组小鼠软骨内TLR4、beclin 1及LC3-II/LC3-I水平均明显升高,RES干预组软骨内以上3种蛋白的水平较高脂组显著降低,且与对照组无明显差异(图3)。
4 白藜芦醇通过TLR4影响软骨细胞自噬
Western blot检测显示:与对照组相比,IL-1β组beclin 1、LC3-II/LC3-I蛋白表达明显升高;RES干预后,以上蛋白水平均显著下降,介于对照组和IL-1β组之间;单独用CLI-095干预后,beclin 1、LC3-II/LC3-I水平也显著降低,介于对照组和IL-1β组之间;RES和CLI-095共同预处理后,beclin 1、LC3-II/LC3-I水平下降,介于对照组和IL-1β组之间,而与CLI-095单独预处理相比,beclin 1水平有所回升。与IL-1β+RES组相比,IL-1β+RES+CLI-095组beclin 1和LC3-II/LC3-I水平无明显变化。
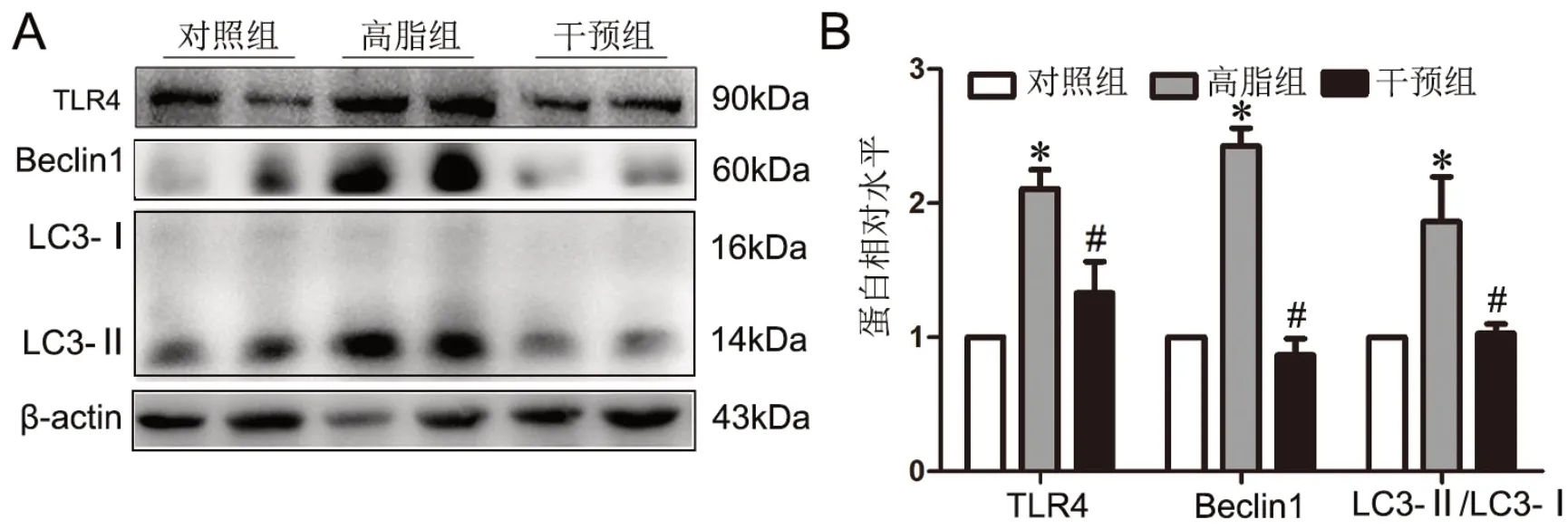
图3 高脂饮食和白藜芦醇处理对小鼠软骨组织内TLR4、beclin 1、LC3-II/LC3-I水平的影响。A,代表性Western blot检测结果;B,TLR4、beclin 1、LC3-II/LC3-I水平统计学分析。与对照组相比,*P<0.05,与高脂组相比,#P<0.05;n=7Fig.3 Effect of high-fat diet and resveratrol on levels of TLR4, beclin 1 and LC3-II/LC3-I in cartilage tissue of the mice. A, representative Western blot detection results; B, statistical analysis of TLR4, beclin 1 and LC3-II/LC3-I levels. *P<0.05, compared with control group; #P<0.05, compared with high-fat group; n=7
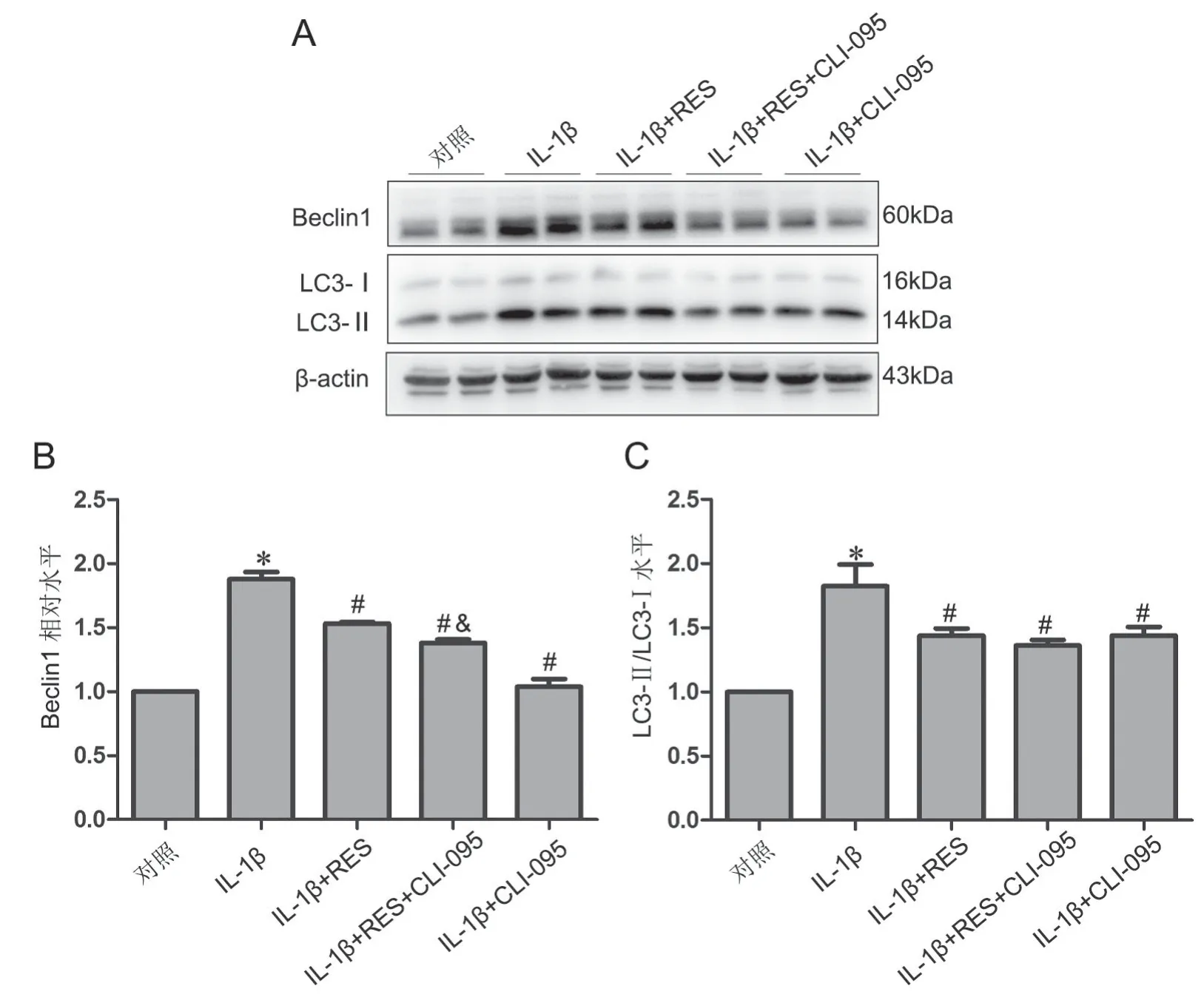
图4 TLR4抑制剂对IL-1β诱导的SW1353细胞中beclin 1、LC3-II/LC3-I上调的影响。A,代表性Western blot检测结果;B,beclin 1水平统计学分析;C,LC3-II/LC3-I水平统计学分析;与对照组相比,*P<0.05;与对照组相比,#P<0.05;与IL-1β组相比,&P<0.05;与IL-1β+-CLI-095组相比;n=3Fig. 4 Effect of TLR4 inhibitor on the IL-1β-induced upregulation of beclin 1, LC3-II/LC3-Iin SW1353 cells. A, representative Western blot detection results; B, statistical analysis of beclin 1 level; C, statistical analysis of LC3-II/LC3-I level; *P<0.05, compared with control group; #P<0.05, compared with IL-1β group; &P<0.05, compared with IL-1β+CLI-095 group; n=3
讨 论
OA是一种常见的非特异性炎症,造成OA的原因很多,其中肥胖是一个主要因素,因此,本研究首先采用高脂饮食喂养小鼠来诱导肥胖相关OA。结果发现,单纯高脂或高脂结合RES灌胃均使小鼠体重和体脂比明显增加,但二者的摄食量并无明显差别,同时,高脂组小鼠膝关节软骨出现OA病理学改变,RES干预组的OA病变减轻,表明高脂饮食可以引起肥胖相关OA,而RES对肥胖相关OA具有改善作用。
在OA的众多危险因素中,肥胖是最具影响力的因素之一。肥胖不仅会增加软骨的机械应力,它还与炎症反应存在着紧密联系。研究证明,肥胖的人和动物的血液中可检测出高水平的肿瘤坏死因子-α(TNF-α)、IL-6和1L-1β,而这些因子在OA软骨基质降解中起到至关重要的作用[11]。在本研究中,我们检测了关节软骨中自噬相关蛋白beclin 1、LC3-II/LC3-I水平,结果显示高脂组自噬水平明显增加,而给予RES后,自噬水平显著下降,提示RES可能通过降低自噬水平来减轻肥胖引起的炎症和氧化应激反应,进而改善OA关节软骨的病理改变。
自噬是一种细胞的“自我吞噬”过程,可分解代谢细胞内成分以维持细胞稳态并保护细胞免受不同形式的压力,包括营养缺乏、生长因子耗竭、感染和缺氧等[12]。自噬同时也是一把“双刃剑”,基础自噬可通过控制细胞内组分的清除和再利用来帮助细胞在压力条件下产生足够的能量,促进细胞存活。但当压力过大并超过细胞最大适应能力时,则会出现过度自噬,并诱导细胞死亡。自噬是有益还是有害取决于自噬诱导的程度和自噬的持续时间[13,14]。
许多研究发现,OA时自噬水平下降[15],而本研究却出现相反结果,这可能由于OA的不同阶段自噬程度不同,导致了相关蛋白表达水平的差异[16]。在OA最初的退行性变阶段,自噬水平升高,通过调节活性氧(ROS)及细胞凋亡等方式来改善软骨细胞的退变,保护软骨细胞免受各种环境变化的影响。而随着OA程度加深,软骨逐渐降解,细胞死亡及细胞凋亡增多,自噬水平也随之降低[17]。Sasaki等人[18]的研究也发现,与正常软骨或严重OA软骨相比,轻度OA软骨中自噬标记物表达明显增强。本研究采用高脂喂养使小鼠膝关节产生的OA样改变处于早期病变阶段,因而自噬水平升高。同时,高脂喂养的小鼠体内可能存在慢性低度炎症,而血液中炎症因子浓度较高则会引发软骨细胞的过度自噬。此外,在体外实验中我们也观察到,在IL-1β刺激48h后,细胞中出现了自噬相关蛋白的增加,而RES的处理使自噬水平降低,这与动物实验的结果一致,证明在OA早期阶段,自噬水平升高,而RES可通过减轻过度自噬来改善OA情况。
TLR4已被证实可促进炎症反应,加速OA进程,且TLR4水平升高与OA的严重程度成正相关[19]。本研究结果显示,高脂组中TLR4表达增加,而RES干预后TLR4表达减少。为进一步探讨RES对自噬的调节作用是否与TLR4有关,我们采用TLR4抑制剂CLI-095预处理SW1353细胞系,结果显示,CLI-095预处理降低IL-1β诱导的beclin 1和LC3-II/LC3-I水平上升,说明TLR4被抑制可以降低IL-1β诱导的细胞过度自噬;当同时加入RES预处理细胞时,自噬抑制效果并没有出现明显的叠加,而是出现了自噬水平上调的情况,这可能是由于CLI-095的作用使自噬活性被显著抑制,细胞不能通过自噬进行正常的物质周转,维持胞内稳态,从而导致受损线粒体累积,氧化应激增加,使细胞死亡或变性。此时上调自噬可能对细胞提供保护作用。当CLI-095预处理后,IL-1β诱导的自噬已经被减弱,此时RES可能不再起到抑制自噬的作用。因此推测在同时加入RES预处理时,RES通过发挥其抗炎、抗氧化等功能,使自噬水平出现了一定程度的上调。
RES预处理后,IL-1β诱导的beclin 1和LC3-II/LC3-I的表达显著降低,而在加入RES的基础上进一步加入TLR4抑制剂并没有显著逆转beclin 1的降低。这可能是由于TLR4并不是RES作用的唯一靶点,且RES对TLR4的抑制作用可能存在一定的时间和剂量依赖性,这与Ma等人的研究结果一致[20]。我们认为RES可能通过或部分通过TLR4发挥其抗OA的作用。
综上所述,本研究发现,RES可以抑制OA的进展,其机制可能与调节TLR4和自噬有关。未来的研究可以通过检测RES对不同OA阶段软骨自噬水平的影响,以及TLR4在其中所发挥的作用,进一步阐明RES的抗OA机制,为OA的营养防治提供理论依据。

