基因重排检测技术联合玻璃体液中IL-10和IL-6检测对PIOL的诊断价值
吕永川,彭金萍,管英朝,张 阳,张淑清,树玲博 ,陶 勇
0引言
原发性眼内淋巴瘤(primary intraocular lymphoma, PIOL)是发生于眼内组织的淋巴瘤,属原发性中枢神经系统淋巴瘤亚型,本病多见于老年人,以视物模糊、眼前黑影漂浮感为主要临床表现[1]。PIOL病因复杂,临床表现多样,且无标准治疗方案,数据报道约80%的患者随着病情发展可累及中枢神经系统而致死,预后较差,及时诊断并开展放射治疗、化学治疗等方式是取得生存获益的关键[2-3]。但PIOL可获取的标本量相对较少,临床诊断及病理诊断均存在困难。探索有效的PIOL诊断方式至关重要。淋巴细胞抗原受体基因重排是淋巴瘤的重要辅助诊断方式之一,但检测过程复杂、影响因素繁杂,并在一定程度上影响检测灵敏度[4]。玻璃体液及房水中细胞因子检测也是PIOL的重要辅助诊断方式,有研究指出检测眼内白介素-10(interleukin-6,IL-10)及IL-10/白细胞-6(interleukin-6,IL-6)比值可辅助诊断B细胞淋巴瘤[5-6]。鉴于此,本研究拟将基因重排检测技术结合检测玻璃体液IL-10、IL-6水平用于PIOL的诊断,分析其诊断价值,以期为PIOL的临床诊断提供试验依据。
1对象和方法
1.1对象回顾性分析。研究对象为2015-01/2019-12在本院收治的拟诊PIOL患者27例,其中经诊断学玻璃体切割手术检查确诊PIOL 21例21眼,葡萄膜炎患者6例6眼。PIOL组中男11例,女10例,年龄31~75(中位数53)岁,均为弥漫大B细胞淋巴瘤。葡萄膜炎组中男4例,女2例,年龄25~69(中位数51)岁,前葡萄膜炎4例,全葡萄膜炎2例,急性期3例,慢性期3例。纳入标准:(1)经诊断性玻璃体切割术病理检查确诊;(2)接受过基因重排检测及玻璃体液中IL-10、IL-6水平,且检测前未接受过药物、手术等治疗方式干预;(3)病历资料完整。排除标准:(1)病理检查确诊为中枢神经系统淋巴瘤眼内转移瘤;(2)双眼病变;(3)全身其他系统性淋巴瘤病变。本研究符合《赫尔辛基宣言》相关要求。所有患者知情同意,经过医院伦理委员会审批通过。
1.2方法
1.2.1仪器与试剂盒基因组DNA提取试剂盒购自根生化科技(北京)有限公司;基因测序平台为Life Techplogy技术平台;Lympho Track Dx IGH FR2 Assay基因重排检测验证试剂盒、Lympho Track Dx TCRG Assay基因重排检测验证试剂、IgH、TCRG基因重排检测试剂盒均购自美国Invivo Scribe公司;酶联免疫吸附法试剂盒购自尚柏生物医学技术(北京)有限公司;Spectra Max i3x多功能酶标仪购自美谷分子仪器(上海)有限公司。
1.2.2基因重排检测所有患者均接受玻璃体切割手术,未灌注时切除并收集核心玻璃体1.5~2.0mL,指压方式维持相对稳定压力,获取标本后灌注平衡液维持眼内压,切除剩余玻璃体。取玻璃体标本至Eppendorf管,基因组DNA提取试剂盒提取DNA,安捷伦4200评价所提取DNA质量,进行PCR扩增。扩增反应体:Master Mix 45μL,AmpliTaq Gold Taq 0.2μL,DNA 5μL,总体积50μL;扩增条件:95℃ 7min、95℃ 45s、60℃ 45s、72℃ 90s,循环数29个;72℃ 10min。而后采用AMPure XP方法纯化PCR产物,安捷伦4200对DNA进行定量。NEXT-flex DNA Barcords及NEXTflex PCR free DNA测序试剂盒构建DNA文库,乳液PCR制备模板,将文库上载Ion 316芯片,上Ion PGM机测序,测序结束后将导出的FASTQ文件直接导入Lympho Track Dx PGM Software Dx软件完成数据分析,将最终结果导入EXCEL表格;参照文献[7]对结果进行克隆判定。
1.2.3细胞因子检测取0.7~1.0mL玻璃体液至Eppendorf管,15 000r/min条件下离心10min,酶联免疫吸附法测定玻璃体液中细胞因子IL-10(正常范围0~50.0pg/mL)、IL-6(1.0~50.0pg/mL)水平;Spectra Max M45酶标仪测定各孔吸光度,波长450nm,以标准品浓度为横坐标,吸光度值为纵坐标绘制标准曲线,计算玻璃体液中IL-10、IL-6含量。
统计学分析:采用SPSS 21.0软件进行统计学分析,不符合正态分布数据采用P50(P25,P75)描述,两组间比较采用非参数检验;计数资料采用例或百分比(%)描述;诊断价值采用受试者工作特征(ROC)曲线分析,ROC曲线下面积比较采用Z检验。P<0.05为差异有统计学意义。
2结果
2.1上机测序及测序结果分析纳入PIOL患者21例中,15例IhH FR2单克隆性重排序列,阳性率71%(15/21),均可获得基因重排的基因序列;4例检出TCRG克隆性基因重排序列;其余6例标本未能检出IgH FR2单克隆序列。而6例确诊为葡萄膜炎的标本中均未见IhH FR2、TCRG单克隆性重排序列,FR2、TCRG均为多克隆性,DNA电泳图见图1。经ROC曲线分析显示基因重排检测PIOL的AUC为0.857(0.669~0.961),Z=7.071,P<0.001;约登指数0.714,敏感性、特异性分别为71.43%、100.00%,见图2。

表2 细胞因子水平诊断PIOL的ROC曲线分析结果

图1 组织DNA电泳图 M:Marker;D1~D7:PIOL组;C1~C3:葡萄膜炎组。
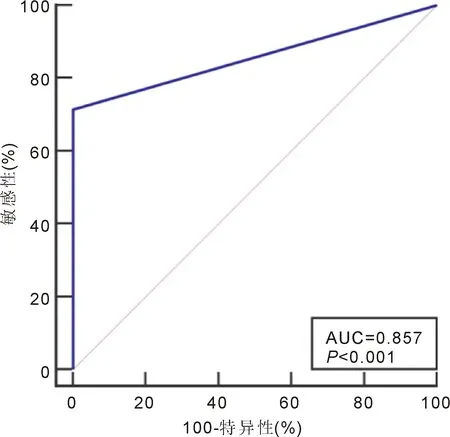
图2 基因重排检测PIOL诊断PIOL的ROC曲线分析。
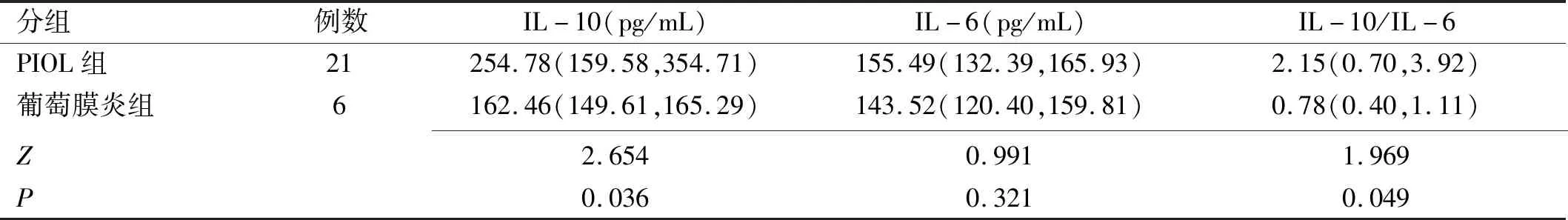
表1 两组患者细胞因子水平检测结果 P50(P25,P75)
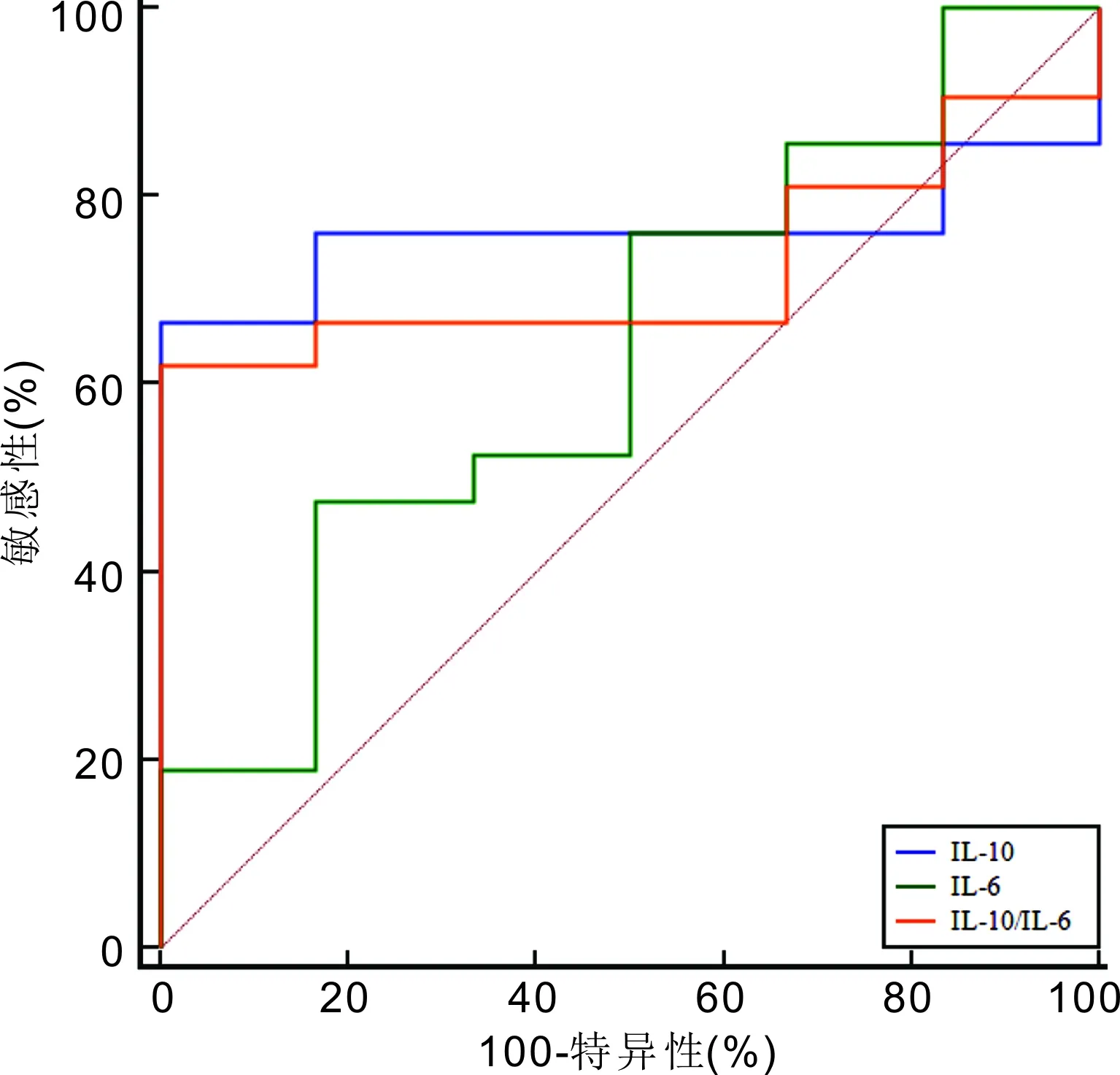
图3 细胞因子水平诊断PIOL的ROC曲线分析。
2.3基因重排检测联合细胞因子水平诊断PIOL的ROC曲线分析基因重排检测阳性、IL-10>170.90pg/mL、IL-10/IL-6比值>1.95中满足任意条件即判定为PIOL,经ROC曲线分析显示基因重排检测联合细胞因子诊断PIOL的AUC为0.893(0.713~0.978),Z=4.553,P<0.001,约登指数0.785,敏感性、特异性分别为95.24%、83.33%,见图4。
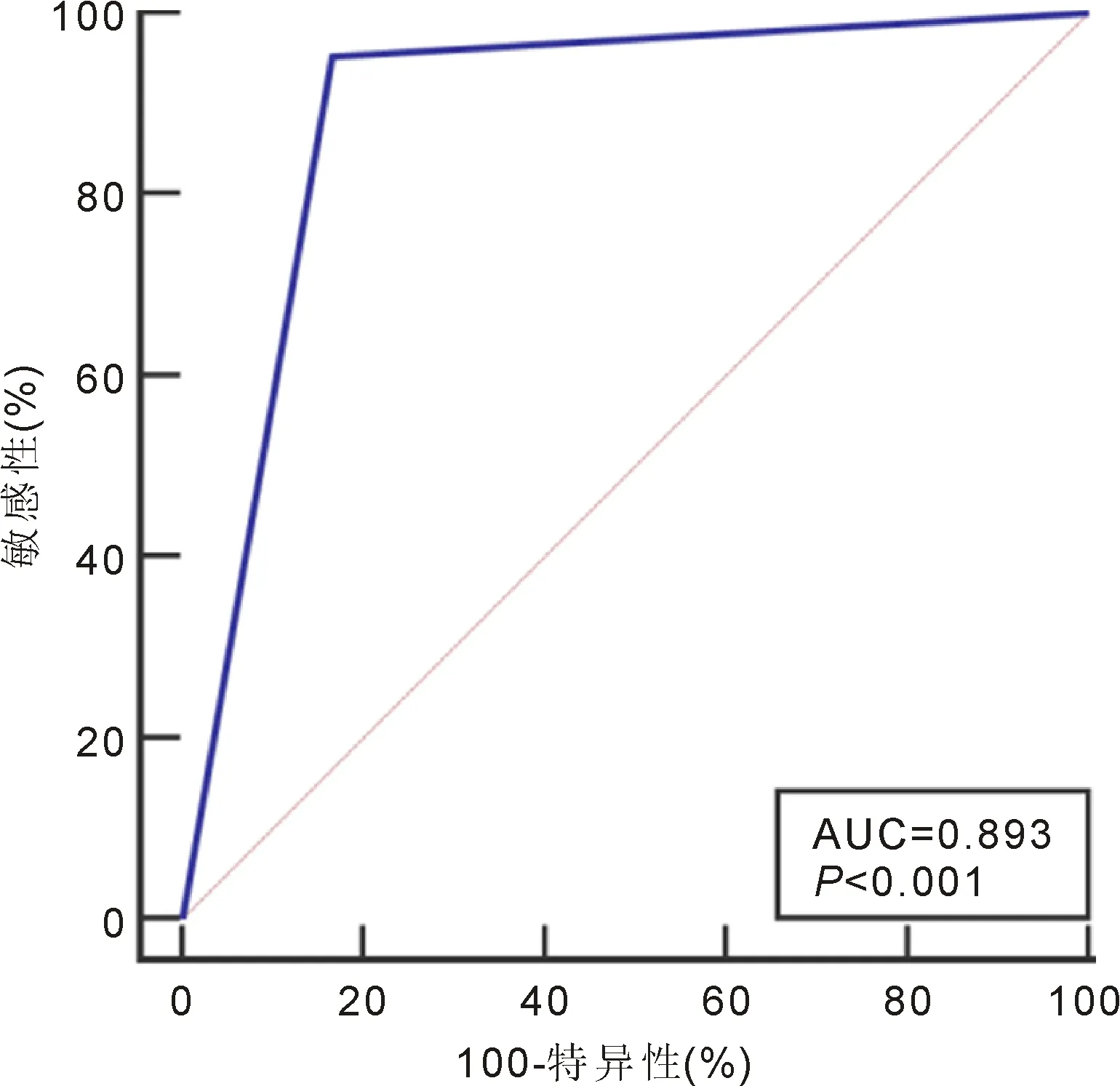
图4 基因重排检测联合细胞因子水平诊断PIOL的ROC曲线分析。
3讨论
PIOL属非霍奇金淋巴瘤,且多数PIOL为B细胞来源,约占眼内及眼眶肿瘤的0.8/100 000[8]。当前国内并无PIOL的流行病学调查研究,但近年来受诊断技术提升、免疫缺陷患者增加等多因素影响,PIOL发病率有上升趋势[9]。本病临床表现缺乏特异性,被称为伪装综合征的典型代表,临床极易将其误诊为葡萄膜炎、巩膜炎,诊断难度较大[10]。当前临床对拟诊PIOL的诊断流程也十分繁杂,一般先行MRI检查,而后接受腰椎穿刺并行脑脊液检查,若检查结果为阴性则需完善诊断性玻璃体切割术获得组织标本,若为阳性则诊断为PIOL;若为阴性则需进一步接受视网膜下或视网膜病变活检。同时,在眼部活检证实诊断后还需完善神经系统影像学检查及脑脊液分析,一般PIOL患者的诊断可延迟8~21mo,且研究报道一般PIOL患者并病理学检查确诊后一般生存率仅为3~5a[11]。眼底自发荧光检查、光学相干断层成像等影像学辅助方式虽能有效评价疾病进程及预后,但诊断特异性不佳[12]。
研究报道,多数淋巴细胞增生性疾病通过组织形态学、免疫表型便可获得确诊,但仍有少部分淋巴瘤在经大量免疫标志检测后依然难以鉴别良恶性。基于淋巴瘤的病生理特征,其是因淋巴细胞成熟阻滞于某个阶段发生克隆性增生,所有细胞具有相同的重排方式,即克隆性重排,这也是克隆性增生和谱系来源的标志,且自然杀伤细胞(natural killer cells,NK)/T细胞淋巴瘤中免疫球蛋白及T细胞受体(T cell receptor,TCR)基因多数呈胚系构型,无克隆基因重排,这也是免疫球蛋白及TCR基因克隆性重排则可作为淋巴瘤的重要辅助诊断方式的重要原因[13-14]。本研究中,15例IhH FR2单克隆性重排序列,阳性率71%(15/21),均可获得基因重排的基因序列;4例检出TCRG克隆性基因重排序列;其余6例标本未能检出IgH FR2单克隆序列。6例确诊为葡萄膜炎的标本中均未见IhH FR2、TCRG单克隆性重排序列,FR2、TCRG均为多克隆性。经ROC曲线分析显示基因重排检测技术诊断PIOL的AUC为0.857,特异性高达100.00%,但敏感性欠佳,仅为71.43%。往期研究也报道[15],IhH FR2单克隆性重排序列也并不意味着恶性,CD阳性T淋巴细胞增生等疾病也可出现淋巴细胞克隆性增生,也因PCR的高度敏感性,也可发生假克隆或寡克隆现象。因此,单纯基因重排检测技术诊断PIOL存在局限性。
IL-10、IL-6均是重要的免疫调节细胞因子。前者作为重要的多效免疫调节细胞因子,可通过抑制Th1细胞、INF-γ、IL-2来损害肿瘤免疫监视;不仅如此,IL-10还可刺激B淋巴细胞增殖分化,在淋巴瘤恶性发展中也扮演重要角色[16]。而IL-6则具多重性及复杂性,良恶性B淋巴细胞、良恶性T淋巴细胞均可产生IL-6,其参与机体生理性免疫调节及炎症反应,当前研究已证实IL-6与淋巴细胞增生异常具紧密关联,可作为淋巴细胞生长因子参与非霍奇金淋巴瘤(non-Hodgkin’s lymphoma,NHL)发生及发展[17]。本研究显示,PIOL患者玻璃体液中IL-10及IL-10/IL-6水平均显著高于葡萄膜炎患者,但两种病变患者IL-6水平差异无统计学意义,ROC曲线分析也显示IL-6对PIOL无显著诊断效能,可能与肿瘤细胞、炎症均可增加IL-6分泌有关[18-19]。ROC曲线分析还显示,IL-10诊断PIOL的AUC最高,特异性虽为100.00%,敏感性则仅为66.67%;IL-10/IL-6诊断的AUC略低于IL-10,特异性与IL-10相当,敏感性仅为52.40%。由此也可见,单一IL-10、IL-6等细胞因子检测作为PIOL的诊断性生物标志物存在局限性。进一步应用基因重排检测技术联合细胞因子检测诊断时,AUC高达0.893,敏感性、特异性分别为95.24%、83.33%。提示基因重排检测技术联合IL-10、IL-6等细胞因子检测诊断PIOL可显著提升诊断敏感性,且特异性良好。
综上所述,玻璃体液IL-10、IL-10/IL-6可用于PIOL辅助诊断,但诊断敏感性欠佳现象,联合应用基因重排检测技术可明显提升诊断敏感性,并获得良好的特异性。考虑PIOL的大样本研究罕见,本研究样本量也仅为21例,基因重排检测技术,尤其是细胞因子检测在PIOL诊断中的应用仍有极大深入探究空间,以期在下阶段采集充足样本量后持续补充及完善。
1莫春艳, 张学东. 原发性眼内淋巴瘤的诊断及治疗. 眼科新进展 2017;37(6):597-600

