慢性乙肝和肝硬化患者HBV DNA与HBsAg相关性分析
王 军,黄文达,薛思为
(惠阳三和医院检验科,广东惠州 516211)
慢性乙肝是发病率较高的慢性传染病,该病症因感染乙肝病毒(HBV)所致。相关调查显示,全球人口中约35%感染过HBV,其中15%~30%HBV携带者会发展为肝硬化[1]。HBV DNA是诊断HBV感染最直接的指标,其特异性、灵敏性较高,HBV携带者的传染性强弱与HBV DNA定量水平密切相关,其在判断病毒复制程度和抗病毒药物治疗效果中具有重要价值,但该指标对检测仪器和环境要求较高[2]。乙型肝炎表面抗原(HBsAg)是HBV感染的重要标志物,在HBV感染患者中,HBsAg亚病毒颗粒数量与成熟病毒颗粒相比明显更多,即便经药物抑制病毒复制,HBsAg仍在持续合成与分泌,因此其水平与肝病的发展存在密切关联[3]。本研究旨在探讨慢性乙肝和肝硬化患者HBV DNA与HBsAg的相关性,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析惠阳三和医院2019年1月至2020年10月收治的105例肝病患者的临床资料,按照不同疾病类型分为3组。将37例慢性乙肝患者纳入A组,其中男性23例,女性14例;年龄26~64岁,平均(38.61±8.27)岁;其中乙型肝炎E抗原(HBeAg)阳性25例。将32例代偿期肝硬化患者纳入B组,其中男性20例,女性12例;年龄24~65岁,平均(38.56±8.18)岁;其中HBeAg阳性22例。将36例失代偿期肝硬化患者纳入C组,其中男性25例,女性11例;年龄25~63岁,平均(38.68±8.37)岁;其中HBeAg阳性24例。3组患者一般资料相比,差异无统计学意义(P>0.05),组间具有可比性。研究经院内医学伦理委员会批准。纳入标准:所有患者均符合《慢性乙型肝炎防治指南(2015年更新版)》[4]中的相关诊断标准;肝硬化患者符合《临床肝脏病学》[5]中的相关诊断标准;患者无抗病毒治疗史;初诊患者。排除标准:其他原因所致的肝炎或肝硬化患者;拟诊肝癌患者;患者入组前有提高血细胞、降酶药物治疗史。
1.2 方法 采集3组患者空腹肘静脉血5 mL,室温下放置30 min,离心处理(转速3 000 r/min,半径9 cm,时间14 min),取上层血清备检,采用圣湘SLAN96实时定量PCR仪对HBV DNA定量水平进行检测;采用化学发光法对HBsAg定量水平进行检测,检测仪器为罗氏ROCH601化学发光免疫分析仪。
1.3 观察指标 ①比较3组患者HBV DNA和HBsAg定量水平。②观察并比较3组HBeAg阳性患者HBV DNA和HBsAg定量水平。③分析3组患者HBV DNA与HBsAg的相关性。④分析HBV DNA、HBsAg与肝硬化程度的相关性。
1.4 统计学分析 采用SPSS 24.0统计软件处理数据,计量资料以(±s)表示,采用t检验,多组间比较采用重复测量方差分析;符合正态分布的数据相关性分析采用Pearson检验,不符合正态分布的数据数据相关性分析使用Spearman检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 3组患者HBV DNA、HBsAg水平 A组患者HBV DNA、HBsAg水平均显著高于B组、C组,且B组显著高于C组,差异均有统计学意义(均P<0.05),见表1。
表1 3组患者HBV DNA、HBsAg水平比较(±s,IgIU/mL)

表1 3组患者HBV DNA、HBsAg水平比较(±s,IgIU/mL)
注:与A组比,*P<0.05,与B组比,#P<0.05。HBV:乙肝病毒;HBsAg:乙型肝炎表面抗原。
组别 例数 HBV DNA HBsAg A组 37 7.59±1.16 3.93±0.69 B组 32 6.61±1.05* 3.54±0.37*C组 36 5.58±0.98*# 2.71±0.33*#F值 32.347 56.991 P值 <0.05 <0.05
2.2 3组HBeAg阳性患者HBV DNA、HBsAg水平 A组HBeAg阳性患者25例,B组HBeAg阳性患者22例;C组HBeAg阳性患者24例。A组HBeAg阳性患者HBV DNA、HBsAg水平均显著高于B组、C组,B组HBeAg阳性患者HBsAg定量水平显著高于C组,差异均有统计学意义(均P<0.05);B组、C组HBeAg阳性患者HBV DNA定量水平经比较,差异均无统计学意义(均P>0.05),见表2。
表2 3组HBeAg阳性患者HBV DNA、HBsAg水平比较(±s,IgIU/mL)

表2 3组HBeAg阳性患者HBV DNA、HBsAg水平比较(±s,IgIU/mL)
注:与A组比,*P<0.05,与B组比,#P<0.05。
组别 例数 HBV DNA HBsAg A组 25 7.69±1.10 4.31±0.56 B组 22 6.85±0.97* 3.76±0.45*C组 24 6.41±0.81* 3.11±0.41*#F值 11.043 38.366 P值 <0.05 <0.05
2.3 HBV DNA与HBsAg的相关性Spearman相关性分析结果显示,A组中,HBV DNA与HBsAg呈正相关(r=0.982,P<0.05);而B组、C组中,HBV DNA与HBsAg定量水平之间无明显相关性(r=0.085、0.067,均P>0.05),见表3。
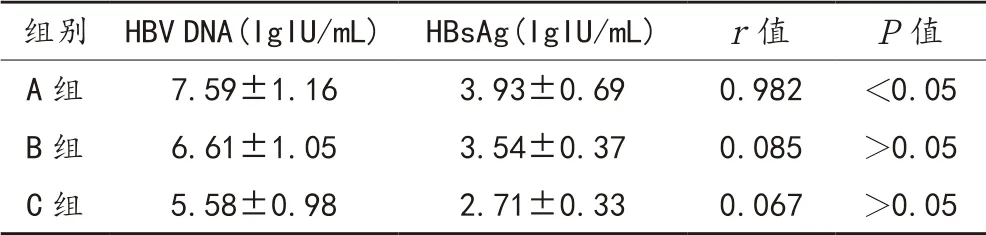
表3 HBV DNA与HBsAg的相关性
2.4 HBV DNA与HBsAg定量水平与肝硬化程度的相关性Spearman相关性分析结果显示,HBV DNA、HBsAg定量水平与肝硬化程度均呈负相关(r=-0.715、-0.504,均P<0.05)。
3 讨论
慢性乙肝是指患者感染HBV持续6个月以上,且肝脏出现不同炎症坏死和(或)肝纤维化的疾病。全球有2亿多慢性HBV感染者,而多数HBV感染患者随着病情加重会发展为肝硬化,在国内,约60%的HBV患者会转化为肝硬化[6]。HBV DNA位于HBV核心内,其是HBV感染的最直接证据,具有特异性、灵敏度较高的特点,其定量水平与病毒复制和传染性存在密切关联。HBsAg是HBV感染的重要标志物,具有稳定可靠的特点,可作为诊断HBV感染的重要依据,其是一种由乙型肝炎病毒S基因分泌而来的病毒包膜蛋白质,可排放至细胞外。研究表明,与感染性成熟病毒颗粒相比,HBsAg亚病毒颗粒定量水平更高,在及时进行抗病毒治疗后,仍不能完全抑制病毒复制增生,HBsAg仍可持续合成与分泌[7]。可见,HBsAg在HBV感染和疾病发展中发挥着重要作用。血清HBsAg是肝细胞核基因整合的共价闭合环DNA(cccDNA)的转录和翻译结果,其滴度与cccDNA数量相关,因此,通过检测血清HBsAg可反映肝细胞中cccDNA的转录和翻译活性。由于HBV DNA只能反映HBV复制情况,而HBsAg可提供与HBV DNA不同的互补信息,因此可将HBsAg作为感染细胞数量的替代性指标。
本研究结果显示,A组患者HBV DNA、HBsAg水平均显著高于B组、C组,B组显著高于C组,提示HBV DNA、HBsAg定量水平随着病情加重而逐渐降低。分析原因可能为HBV的入侵会改变人体机能,体内细胞会更具有特异性,体液也会出现明显的免疫应答,进而破坏肝细胞,随着疾病的不断发展,肝细胞的损坏范围会继续扩大,增加肝部的纤维化容量,可能出现HBV DNA和HBsAg水平降低的情况[8]。本研究结果还显示,A组HBeAg阳性患者HBV DNA与HBsAg定量水平均显著高于B组、C组,B组HBeAg阳性患者HBsAg定量水平显著高于C组,B组、C组HBeAg阳性患者HBV DNA定量水平相比,差异无统计学意义(P<0.05),提示随着慢性乙型肝炎向肝硬化进展,患者肝损伤不断加重,HBsAg和HBV DNA定量水平可能逐渐降低,但并不能完全说明HBV复制不活跃,也可能与本研究样本量少有关。
本研究结果显示,HBV DNA、HBsAg在A组中呈正相关,在B组、C组中无明显相关性,提示HBV DNA、HBsAg在疾病不同阶段并不完全平行,分析原因可能与HBV DNA、HBsAg在不同疾病阶段的合成和分泌路径不完全相同有关[9]。Spearman相关性分析显示,HBV DNA、HBsAg与肝硬化程度呈负相关,但HBsAg和HBV DNA定量较低的肝硬化患者,不等同于肝细胞内cccDNA数量的相应减少,仍需积极的抗病毒治疗,加强肿瘤筛查,可联合血清学和影像学检查来提高早期肝癌的检出率。
综上,随着病情加重,HBV DNA、HBsAg定量水平呈逐渐降低趋势,且HBV DNA与HBsAg呈正相关,但其在不同疾病阶段并不完全平行,HBV DAN、HBsAg与肝硬化呈负相关,临床通过对HBV DNA、HBsAg进行定量测定可有效预防肝硬化发展进程。

