一步法绿色制备具有持续抗菌性能的医用支架
黄榕康,胡民辉,梁伟文,郑娟娟,杜杨,林燕欢,王怀明,过文泰,曾展涛,李创坤,利民,王辉,*,张兴才*
a Department of Colorectal Surgery, The Sixth Affiliated Hospital of Sun Yat-sen University, Guangzhou 510655, China
b Guangdong Provincial Key Laboratory of Colorectal and Pelvic Floor Diseases, The Sixth Affiliated Hospital of Sun Yat-sen University, Guangzhou 510655, China
c John A.Paulson School of Engineering and Applied Sciences, Harvard University, Cambridge, MA 02138, USA
d Materials Science Institute, PCFM Lab and GDHPRC Lab, School of Chemistry, Sun Yat-sen University, Guangzhou 510275, China
e Department of Surgery, Dongguan Third Peoples’ Hospital, Dongguan 523000, China
1.引言
随着现代医学的不断发展,聚丙烯(PP)、聚乳酸、聚氨酯、聚多巴胺(PDA)等高分子材料被广泛应用于各种医学领域[1–4]。其中,医用PP材料因其轻量、结构多样化、理化性质多样化而备受关注,在外科领域应用广泛 [5–7]。
生物高分子支架是一种新型医用材料,可用于原位组织缺损修复或替代缺失的组织。这类支架由于优异的生物相容性、安全性和稳定性,越来越受到研究人员的关注[8,9]。例如,聚乳酸虽然也是一种常见的生物支架材料,但在人体内降解后形成酸性物质,导致局部炎症反应。此外,聚乳酸的降解时间短于人体组织的愈合周期,在形成新组织之前存在力学性能的丧失,而使用高强度PP材料可以在一定程度上避免这种缺陷[10,11]。
传统PP支架的生物相容性欠佳,可能导致免疫系统排斥和局部炎症反应[12,13]。已有许多研究提示,PDA可用于改善各种材料的生物相容性[14,15]。在PP支架表面修饰生物相容性良好的PDA可有效地减少PP与机体的接触,从而显著地改善支架的生物相容性。另一方面,三氯生是目前最常用的抗菌剂[16–18],被广泛地应用于新型抗菌支架材料的研发。
目前,很少有研究报道使用简单的一步法来制备医用材料的表面功能涂层。在此,我们通过简单的一步法,将PDA和三氯生的混合液均匀地涂覆在PP支架表面,制备了一种具有良好生物相容性的抗菌支架。实验结果表明,所制备的支架具有均匀的表面涂层和良好的持续抗菌性能。该方法可进一步发展成一种抗菌医用材料的通用绿色制备方法[19–22]。
2.材料与方法
2.1.材料制备
合成方法:将一块大小约2.5 cm × 2.5 cm的PP医用支架(江苏三联星海医疗器械有限公司,中国)、25 mL去离子水、20 mL乙醇、0.2 g F127(环氧丙烷和环氧乙烷共聚物)、0.2 g多巴胺和0.2 g三氯生置于烧瓶,并用磁力搅拌器搅拌;通过Tris-HCl溶液将混合液调整为弱碱性(pH= 8.5)溶液;在室温(25 ℃)下搅拌反应24 h后,用去离子水和乙醇冲洗,得到三氯生聚多巴胺聚丙烯(TPP)复合支架,然后在恒温干燥箱中在60 ℃下进行干燥。
2.2.表征
2.2.1.材料结构表征
利用场发射扫描电子显微镜(FESEM, JSM-6330F, JEOL Ltd., 日本)检测样品的形貌和组分;使用Equinox 555仪器(Bruker, 德国)记录傅里叶变换红外(FTIR)光谱;使用ESCALab250仪器(Thermo Electron, 美国)进行X射线光电子能谱(XPS)测量,所得结果由C 1s峰(284.8 eV)校准[23,24]。
2.2.2.抗菌试验
在抗菌试验中,将大肠杆菌(E.coli,ATCC25922)革兰氏阴性菌株和金黄色葡萄球菌(S.aureus, ATCC 6538)革兰氏阳性菌株于灭菌的Luria-Bertani broth(LB)中在37 ℃下预培养过夜,获得每毫升约1×107菌落形成单位(CFU)的浓度。
2.2.3.抑菌圈
为确定抑菌圈大小[25],将200 µL的菌液均匀涂于琼脂平板上。将由浓度为4 mg∙mL–1的三氯生制备的TPP(大小为5 mm × 5 mm)放入相应的LB琼脂平板。在37 ℃下,对接种的琼脂平板进行孵育,孵育24 h后记录抑菌圈的直径。
2.2.4.最低抑菌浓度及最低杀菌浓度
为确定最低抑菌浓度(MIC)和最低杀菌浓度(MBC)[26],将一个由不同三氯生浓度制备的大小为5 mm ×5 mm的支架分别置于细菌培养板的5 mL菌液孔中,然后放在转速为180 r·min–1的摇床上,在37 ℃下培养24 h。取上述200 µL菌液,并将其置于LB琼脂平板上,在37 ℃下培养24 h,然后计数菌落,观察其杀菌性能并检查琼脂培养板上细菌生长的情况。将细菌培养板中菌液澄清时的浓度记为MIC,将三氯生浓度最低且在琼脂平板上无菌落生长时的浓度记为MBC。
2.2.5.持续抗菌试验
在持续抗菌试验中,将由不同三氯生浓度制备的TPP支架(大小约为5 mm × 5 mm),放置在相应的细菌培养板的5 ml菌液孔中,然后放在转速为180 r·min–1的摇床上,在37 ℃下培养24 h。取出支架,用去离子水冲洗三次,随后置于新的5 ml菌液孔中进行培养,每24 h更换一次菌液并持续15 d。每24 h测量残余菌液的光密度(OD),持续15 d。因三氯生不溶于水,故冲洗后不会减少三氯生含量。
2.2.6.三氯生持续释放试验
在三氯生持续释放试验中,将大小为5 mm × 5 mm的支架置于5 mL磷酸盐缓冲盐水(PBS)溶液中,并放在转速为180 r·min–1的摇床上,在37 ℃下培养24 h后取出。每隔24 h取出支架,然后将其置于新的PBS溶液中,持续17 d。分别于第1 d、3 d、5 d、7 d、9 d、11 d、13 d、15 d、17 d检测缓冲液在281 nm处的吸收值。
3.结果和讨论
3.1.形态和表面结构
TPP支架的制备过程如图1所示。在烧杯中,将PP支架、多巴胺、分散剂和三氯生溶解于水和乙醇,使用Tris-HCl溶液调节溶液至弱碱性环境,并在室温下搅拌反应混合物24 h,从而获得载有三氯生聚多巴胺包覆层的PP支架(TPP)。图2(a)、(b)显示,在TPP支架中,
PP纤维的表面被三氯生和PDA覆盖,并且其表面比目前研究报道的光滑PP纤维表面更粗糙[27–29]。如图2(a)、(b)所示,PP支架和TPP支架的颜色从白色变为棕色,表明PP支架表面被PDA和三氯生的混合物覆盖。从图2(d)~(g)可以看出,元素碳(C)、氧(O)、氮(N)和氯(Cl)均匀分布在PP纤维的表面。能量色散X射线谱(EDX)统计结果表明,该材料表面含有69.21%的C元素、21.33%的O元素、1.88%的N元素和7.58%的Cl元素。在这项研究中,由于Cl元素来源于三氯生,TPP支架中三氯生的含量可通过元素地图中Cl元素半定量初步确定。此外,我们通过EDX不同三氯生浓度样品中的Cl元素含量进行半定量分析;如图2(h)所示,PP纤维表面的Cl含量随着三氯生浓度的增加而增加,表明该支架表面已成功地被三氯生修饰。
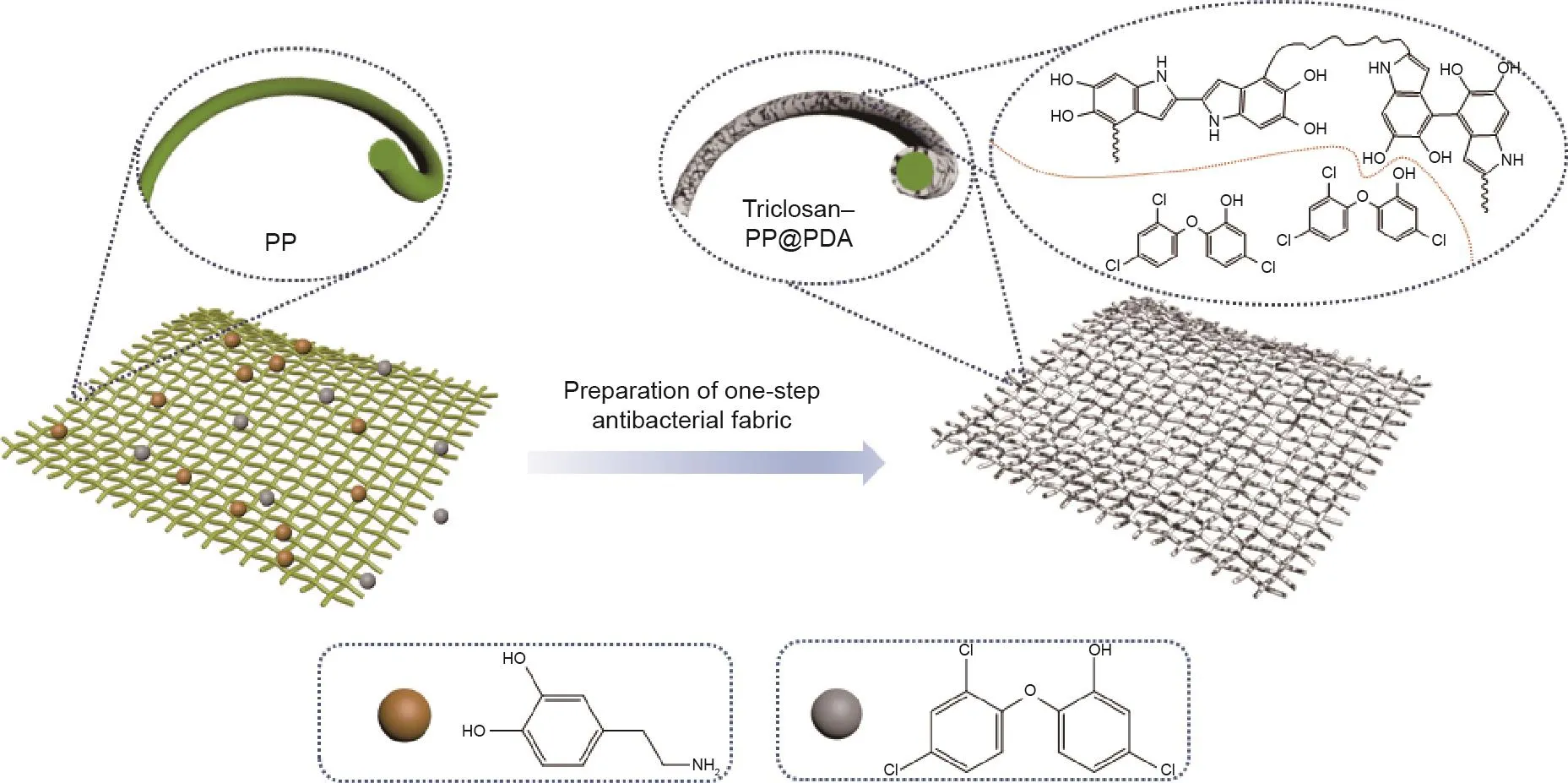
图1.TPP支架的制备示意图。
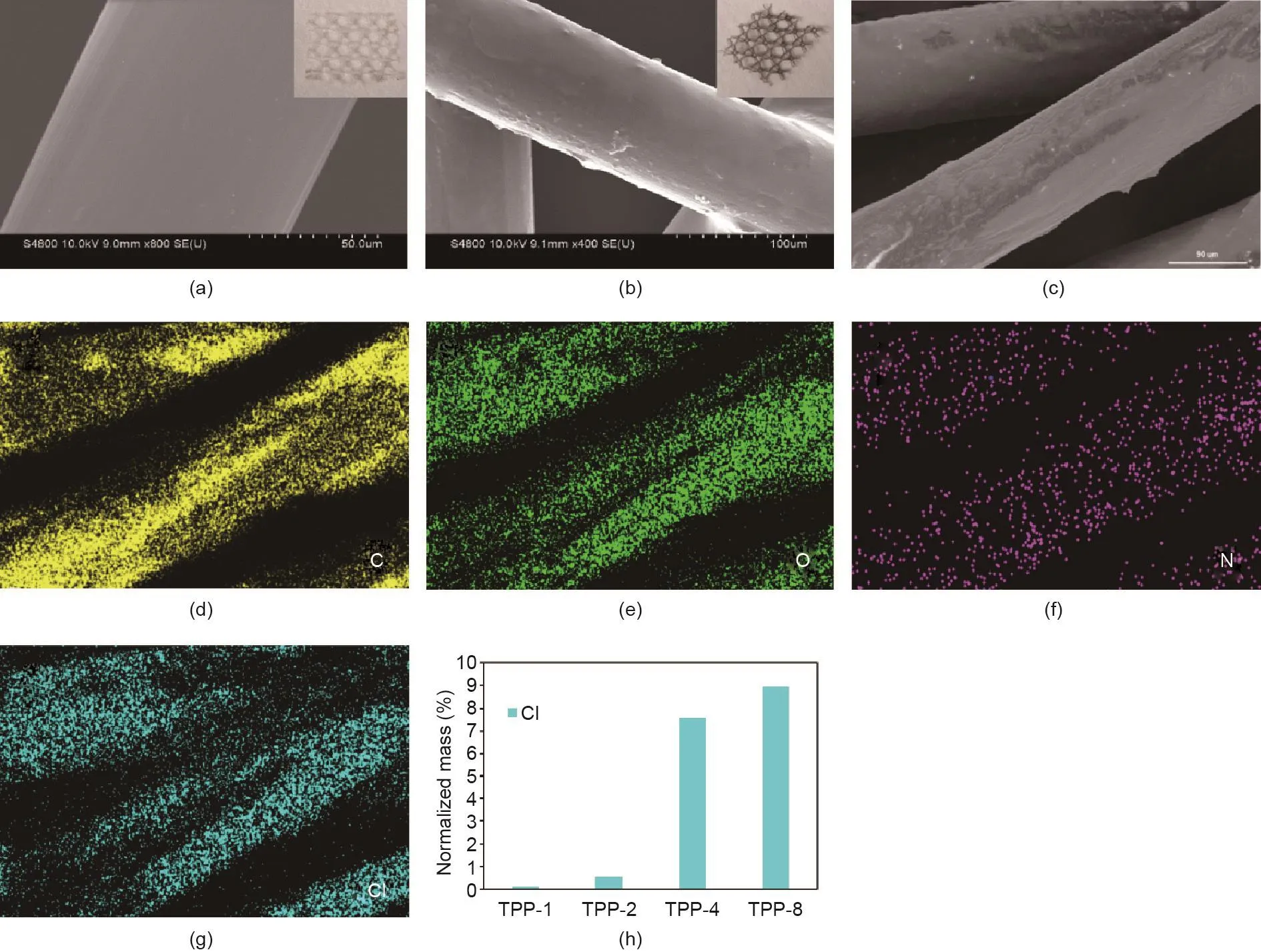
图2.PP(a)和TPP(b)支架的SEM图,插图为PP(a)和TPP(b)支架的实物图;(c)用于元素分析的TPP支架的SEM图;(d)~(g)三氯生浓度为4 mg∙mL–1的TPP支架上的元素分布图:C(d)、O(e)、N(f)和Cl(g)元素;(h)元素分布图,显示不同三氯生浓度(1 mg∙mL–1、2 mg∙mL–1、4 mg∙mL–1、8 mg∙mL–1)的TPP支架表面的Cl元素含量。
图3展示了三氯生浓度(分别为1 mg∙mL–1、2 mg∙mL–1、4 mg∙mL–1和8 mg∙mL–1)的TPP支架的实物图和SEM图。实物图显示,当三氯生浓度从1 mg∙mL–1增加到8 mg∙mL–1时,TPP的颜色明显变暗。在三氯生浓度大于2 mg∙mL–1后,SEM图未显示明显的颜色变化。
根据不同三氯生浓度制备的PP纤维表面Cl元素的分布图[图2(h)]可以看出,随着三氯生的浓度从1 mg∙mL–1增加到4 mg∙mL–1,PP纤维表面Cl元素含量增加。但是,当三氯生浓度高于4 mg∙mL–1后,浓度的提高未显示明显的性能改善。随后的抗菌实验表明,三氯生浓度为4 mg∙mL–1所制备的支架能达到所需的抗菌和灭菌效果。
图4显示了PP、三氯生、PDA和TPP的红外光谱曲线。由于PP支架涂有PDA,因此PP、PDA和TPP曲线在2955~2835 cm–1时显示4个吸收峰,分别是甲基和亚甲基的对称和非对称振动吸收峰。对于PP曲线而言,1376 cm–1处对应的是甲基的拉伸振动特征峰,而1460 cm–1处对应的是C–C键的拉伸振动特征峰(该峰出现在所有样品中)[30]。对于三氯生曲线来说,1110 cm–1是醚键的拉伸振动特征峰,750~700 cm–1是氯苯中C–Cl键的拉伸振动特征峰,1280 cm–1是羟基的变形振动峰,1203 cm–1是苯酚中C–O键的拉伸振动特征峰[31]。对于TPP曲线,1105 cm–1是C和N的拉伸振动特征峰。如上所述,还可以观察到三氯生的特征峰。
材料表面的化学组成是确定该材料特性的重要依据,三氯生的含量和Cl元素的分布是抗菌活性的决定因素。为了进一步阐明材料的表面结构,我们采用XPS光谱并通过C 1s峰(284.8 eV)进行校准。由图5(a)可以清楚地看到TPP支架表面富含O、N、Cl、C和其他元素。图5(b)~(d)分别显示了高分辨率的C 1s、O 1s和Cl 2p的XPS光谱,其中图5(b)中的高分辨率C 1s光谱明显由三个峰组成,分别是C–C键(284.3 eV)、C–N键(286.5 eV)和C–O键(285.3 eV)的拉伸振动特征峰;图5(c)中的高分辨率O 1s光谱主要由两个峰组成,即H–O–C键(534 eV)和C–O–C键(532 eV)的拉伸振动特征峰,表明三氯生的羟基和醚基存在于材料的表面;图5(d)显示的高分辨率Cl 2p光谱主要由C–Cl(200.1 eV)和N–Cl(201.6 eV)两个峰组成,表明该材料具有较高的三氯生负载量。这些发现还表明三氯生在聚多巴胺形成过程中与多巴胺发生相互作用,从而有助于三氯生的负载。
3.2.杀菌和抑菌特性
为了评估材料的生物学价值,使用抑菌环法评估该材料的抑菌和杀菌性能。将总量200 µL的菌液均匀分散在琼脂平板上,然后将5 mm × 5 mm大小的TPP支架放在培养皿的中央,并在37 ℃下孵育24 h后记录抑菌区的大小。
如图6(a)~(c)显示了5 mm × 5 mm大小的、由不同三氯生浓度制备的支架对200 µL金黄色葡萄球菌24 h的抑制作用。TPP支架对金黄色葡萄球菌具有良好的抑制作用,最小抑菌环的直径为2.6 cm(TPP-1),最大抑菌环的直径为4.1 cm(TPP-4)。图6(d)~(f)描述了5 mm × 5 mm大小的、由不同三氯生浓度制备的支架对200 µL大肠杆菌的抑制作用,TPP-1、TPP-2和TPP-4对大肠杆菌的抑制作用弱于对金黄色葡萄球菌的抑制作用,但仍显示出明显的抑菌作用,最大抑菌环直径为2.1 cm(TPP-4)。这种高抑菌活性的结果与Karaszewska等[18]设计的抑菌商业无纺布的抑菌性能结果是一致的,报道的抑菌商业无纺布在使用12个月后,其抑菌环直径为3~6 mm。

图3.不同三氯生浓度制备的TPP样品的实物图和SEM图。(a)1 mg∙mL–1(TPP-1);(b)2 mg∙mL–1(TPP-2);(c)4 mg∙mL–1(TPP-4);(d)8 mg∙mL–1(TPP-8)。

图4.三氯生(TLS)、TPP-4、PP和PDA的衰减全反射红外(TR-IR)光谱图。
图7显示了由不同三氯生浓度制备的TPP支架,对大肠杆菌的MIC和MBC结果。将大小为5 mm × 5 mm的TPP支架放入不同体积的菌液中,并在37 ℃的振荡器中孵育24 h。随后取出200 μL菌液并均匀将其涂覆在琼脂培养基上,在37 ℃下培养24 h后观察结果。在图7中,红色方框内的菌液是透明的,但24 h后琼脂培养基出现了菌落。TPP-1和TPP-2在浓度为1×107CFU∙mL–1的2 mL菌液中显示出良好的抑菌效果,而在浓度相同的5 mL菌液中则没有明显的抑菌作用。但是,随着三氯生含量的增加,TPP-4和TPP-8在浓度约为1×107CFU∙mL–1的5 mL菌液中表现出良好的抑菌作用。在2 mL菌液中培养24 h后,在TPP-4和TPP-8上均未发现细菌菌落,这表明TPP-4和TPP-8对2 mL浓度为1×107CFU∙mL–1的菌液均具有良好的杀菌作用。
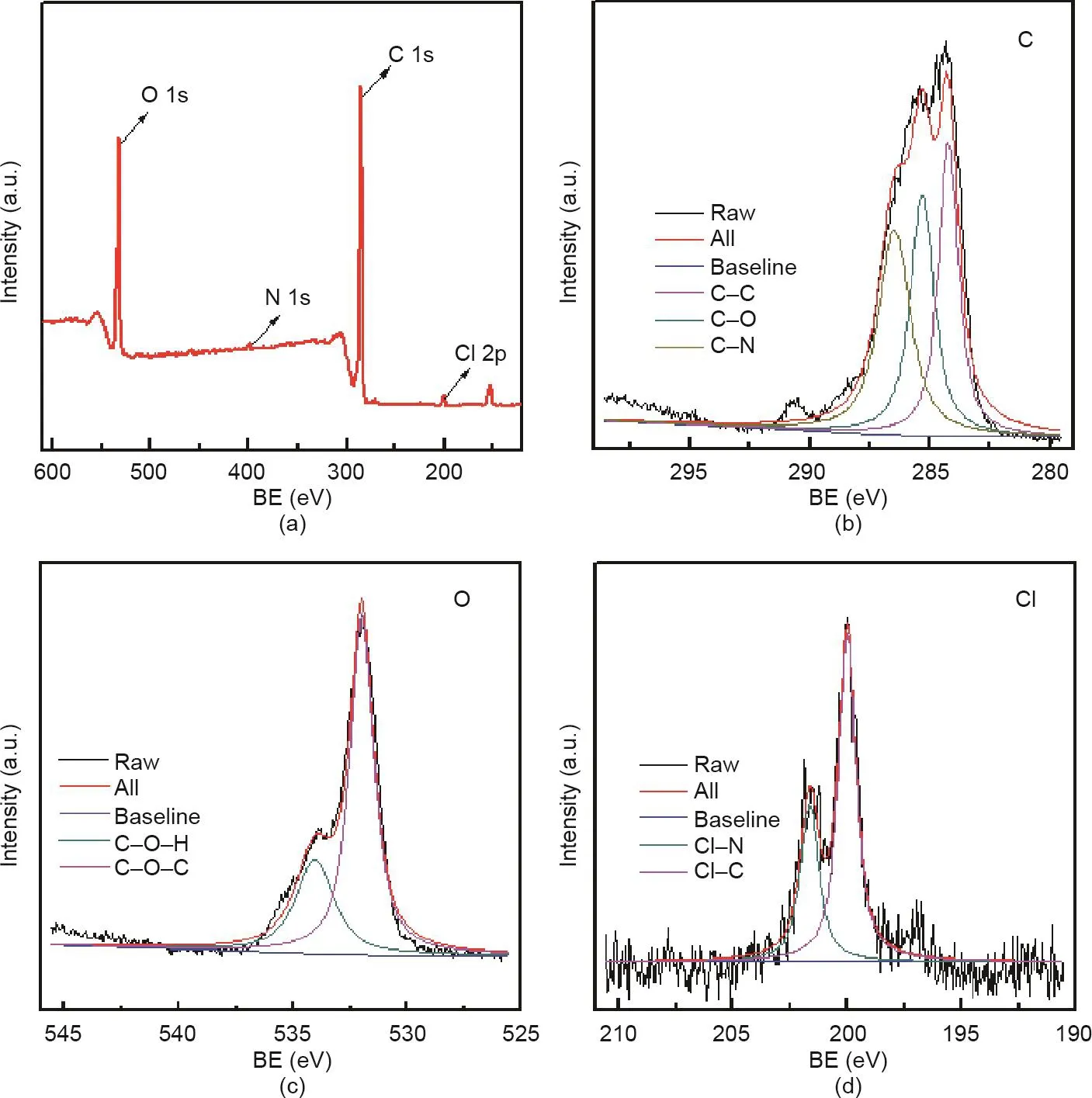
图5.三氯生浓度为4 mg∙mL–1的TPP的XPS光谱。(a)XPS光谱;(b)~(d)高分辨率XPS光谱:C 1s(b)、O 1s(c)和Cl 2p(d)。BE:结合能量。
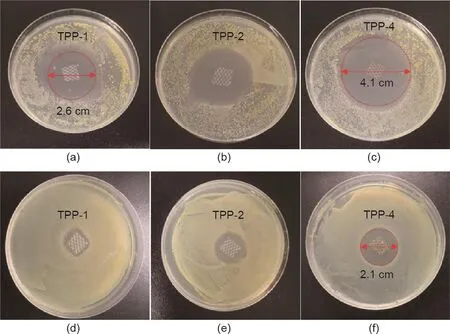
图6.由不同三氯生浓度制备的TPP支架对金黄色葡萄球菌(a~c)和大肠杆菌(d~f)的抑菌性能。TPP-1、TPP-2和TPP-4的三氯生浓度分别为1 mg∙mL–1、2 mg∙mL–1和4 mg∙mL–1。

图7.TPP对大肠杆菌的MIC和MBC。1 mL、2 mL和5 mL是指浓度约为1×107 CFU∙mL–1的1 mL、2 mL和5 mL菌液。对于TPP-1、TPP-2、TPP-4和TPP-8,三氯生的浓度分别为1 mg·mL–1、2 mg·mL–1、4 mg·mL–1和8 mg·mL–1。红色框:菌液是透明的,并且相应的琼脂平板显示细菌生长。蓝色框:菌液是透明的,并且相应的琼脂平板没有发现细菌生长。
图8显示了由不同三氯生浓度制备的TPP样品对金黄色葡萄球菌的MIC和MBC结果。红色框所示的TPP-1至TPP-4样品的菌液是透明的,但在琼脂平板上均匀涂覆200 µL菌液后,TPP-1、TPP-2和TPP-4支架出现明显菌落。如蓝色框所示,2 mL金黄色葡萄球菌在TPP-4支架上没有形成菌落,5 mL金黄色葡萄球菌在TPP-8支架上同样没有形成菌落。这些结果表明TPP-4和TPP-8分别对2 mL金黄色葡萄球菌和5 mL金黄色葡萄球菌均具有明显的杀菌作用。因此,本文所制备的TPP支架具有良好的抑菌和杀菌作用,并且对金黄色葡萄球菌比对大肠杆菌具有更好的抗菌作用。
3.3.TPP支架持续释放三氯生并具有持续的抗菌性能
为了更好地说明所制备材料的持续抗菌性能,将所制备的TPP支架(5 mm × 5 mm)和对比样品在振动床上与5 mL菌液一起培养24 h,测量并记录细菌的OD值,然后将其置于新的5 mL菌液孔中培养,每24 h更换一次菌液并持续15 d。图9显示了TPP支架、PP和F127的持续抗菌曲线。图9(a)显示了针对金黄色葡萄球菌的持续抗菌曲线,第8 d的TPP-4的OD值仍小于0.2,表明TPP-4持续抗菌有效时间为8 d,TPP-8持续抗菌的有效持续时间超过15 d。依据TPP支架与PP和F127对比样品的比较可知,其抗菌作用来自三氯生。如图9(b)所示,TPP-4对大肠杆菌的有效抗菌时间为7 d,TPP-8对大肠杆菌的有效抗菌时间超过15 d。
为了更好地了解抗菌机制,将TPP-8样品(5 mm ×5 mm)放入PBS缓冲溶液中,然后置于37 ℃的振荡器中。每天记录溶液的紫外线(UV)吸收光谱并更换缓冲液。图10(a)显示了TPP-8和三氯生的紫外光谱,其中230 nm处的较大特征峰来自三氯生。图10(b)显示了TPP-8在不同时间的紫外光谱。三氯生的特征吸收峰随时间增加而降低,但三氯生在约15 d时仍持续释放,表明该样品具有良好的持续抗菌效能。
4.结论
综上,本文提供了一种简单而有效的合成方法,用于制备表面涂覆PDA并加载三氯生的医用TPP支架。我们对TPP纤维的纳米结构和化学成分进行测定,发现TPP纤维表面均匀,表明三氯生和PDA可以对PP纤维进行良好的表面修饰。由于表面存在三氯生和PDA涂层,复合TPP支架对大肠杆菌和金黄色葡萄球菌均具有良好的抗菌性能。当三氯生浓度从1 mg∙mL–1增加到8 mg∙mL–1时,支架的表面修饰效果更加均匀,抗菌性能增强。在5 mL浓度为1×107CFU∙mL–1的菌液中,TPP支架的有效抑菌时间长达15 d。TPP复合材料有效地提高了PP支架的生物相容性和长效抗菌性。由于TPP涂层支架的优异抗菌性能和良好的生物相容性,该材料有望成为新一代的腹壁缺损修补材料。本研究促进了绿色制造功能性支架和纤维材料的生物医学应用[32–36],包括伤口敷料和各类医用导管等。
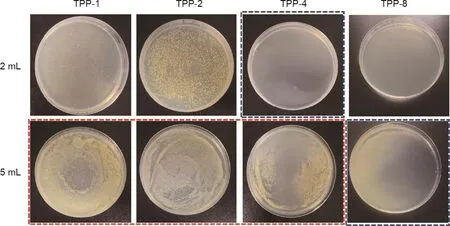
图8.TPP对金黄色葡萄球菌的MIC和MBC。2 mL和5 mL分别表示2 mL或5 mL浓度为1×107 CFU∙mL–1的细菌溶液。TPP-1、TPP-2、TPP-4和TPP-8的三氯生浓度分别为1 mg·mL–1、2 mg·mL–1、4 mg·mL–1和8 mg·mL–1。红色框:菌液是透明的,相应的琼脂平板显示了细菌的生长。蓝色框:菌液是透明的,相应的琼脂平板没有发现细菌生长。
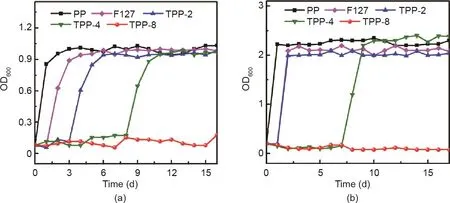
图9.TPP支架对金黄色葡萄球菌(5 mL)(a)和大肠杆菌(5 mL)(b)的持续抑菌活性。OD 600:在600 nm波长处测得的样品的OD值。

图10.TPP的持续释放紫外光谱曲线。(a)TPP-8和三氯生的紫外光谱;(b)TPP-8在不同时间的紫外光谱。
致谢
感谢广州市科技计划项目(201704020059、201803010074)的财政支持。
Compliance with ethics guidelines
Rongkang Huang, Minghui Hu, Weiwen Liang, Juanjuan Zheng, Yang Du, Yanhuan Lin, Huaiming Wang, Wentai Guo, Zhantao Zeng, Chuangkun Li, Ming Li, Hui Wang, and Xingcai Zhang declare that they have no conflict of interest or financial conflicts to disclose.

