工业硫酸锰中重金属元素脱除的试验研究
贺兵红
(中冶长天国际工程有限责任公司,湖南 长沙 410205)
0 前 言
硫酸锰是生产电解锰、锰氧化物以及锂电池正极材料的的重要中间产品,广泛应用于新能源、医药、催化剂、陶瓷、造纸等行业[1-3]。近年来,煤、石油等化石能源的大量消耗,造成了严重的环境污染和资源短缺问题,发展新能源技术成为可持续发展的关键环节[4-5]。锂离子电池因其优异特性广泛应用于手机、电脑、无人机等生活各个领域,并在电动汽车、电能质量调节、小型分布式电站等方面具备巨大应用潜力[6-7]。据报道,锂离子电池正极材料占原料成本的40%[8],而硫酸锰是制备锂电池正极材料(镍钴锰酸锂三元正极材料、锰酸锂正极材料)的重要前驱体[9],电池级硫酸锰对杂质含量要求极为严格,对重金属含量达到痕量级[10]。目前我国硫酸锰生产大都采用菱锰矿或软锰矿为原料,经浸出、直接湿法还原浸出或火法还原后浸出得到硫酸锰溶液,去除铁和重金属,最后浓缩结晶得到工业硫酸锰产品[11]。而工业硫酸锰中重金属杂质含量高,无法满足电池级硫酸锰要求。因此研究工业硫酸锰中重金属的脱除极具应用价值。
工业硫酸锰溶液中重金属的脱除方法有锰粉置换法、硫化物沉淀法和吸附法[12-13],硫化物沉淀法因其去除效率高(>90%),适合所有重金属的优点,在工业上应用最为广泛。硫化剂如福美钠(二甲基二硫代氨基甲酸钠)和乙硫氮(二乙基二硫代氨基甲酸钠)是硫酸锰溶液净化常用的重金属Co、Ni等去除剂,但由于其含有电池级硫酸锰中不希望有的碱金属杂质,使用其除重金属会增加除钠的负荷,故不能采用。同理,像硫化钠和硫化铵等也因同样的原因不能用做除重金属的硫化剂,相比而言硫化锰、硫化钡带来的影响就要小得多。因此,以工业硫酸锰为原料,使用硫化锰、硫化钡为重金属脱除剂,重点考察不同加入量、温度及时间条件下对重金属离子的脱除效果。
1 试验原料及方法
实验用原料为广西某企业生产的工业硫酸锰,配置成溶液后进行除重金属研究,其成分含量如表1所示。实验用硫化锰由工业硫酸锰配置的溶液和理论量过量10%的硫化铵制备,硫化钡采用含量≥67%的工业纯试剂。试验用工业硫酸锰成分如表1所示。
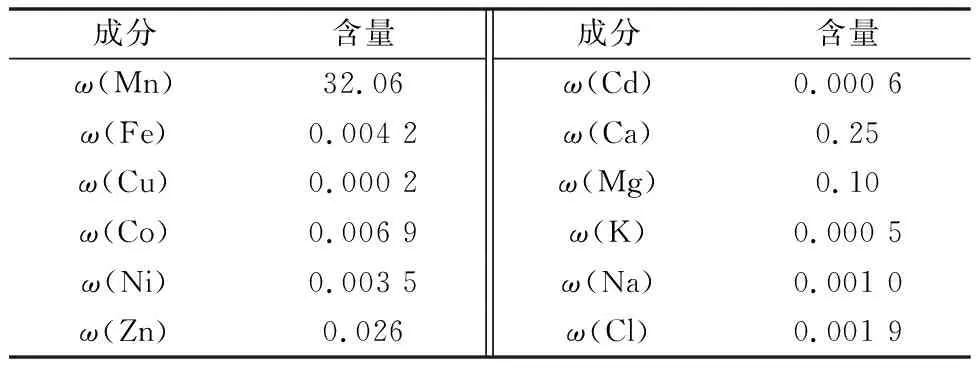
表1 试验用工业硫酸锰成分含量 %
实验过程中分别向硫酸锰溶液中分别加入硫化剂于烧杯中进行净化,搅拌升温,用硫酸调节pH,实验中控制MnS和BaS的添加量、反应温度、反应时间,待重金属离子生成硫化物沉淀后,用布氏漏斗真空过滤,滤液用电感耦合等离子体发射光谱仪(ICP)对重金属含量进行分析。
2 结果与讨论
2.1 试验原理
对于硫酸锰溶液体系,利用硫化剂水解产生的S2-与重金属形成难溶于水的沉淀[7],可以有效地将他们除去。几种金属硫化物溶度积常数如表2所示。

表2 部分金属硫化物溶度积
硫化锰的溶度积与其他重金属如钴、镍、锌、镉和铜的硫化物溶度积相比要大得多,完全可以将他们用在硫酸锰溶液中做重金属杂质的硫化去除剂,而不会往其中增加新的杂质,全过程也没有锰的损耗。
硫化钡在形成重金属硫化物的同时生成大颗粒的硫酸钡,对固液分离起到良好效果。加入到硫酸锰溶液中后除了会发生上述反应外,还会和其他重金属如镍钴锌铜等发生类似反应,这取决于他们的反应速度。由于溶液中锰是大量的,所以最终溶液中有效硫浓度将由硫化锰的溶度积决定。两种硫化剂脱除重金属主要反应如下:
MnS+MeSO4→MeS↓+MnSO4
(1)
BaS+MnSO4→MnS↓+BaSO4↓
(2)
式(1)中Me为Co、Ni、Zn、Cd、Cu等重金属。
试验过程只要定性检测Ni合格,即可以推测其他几种重金属也会合格,事实上目前电解锰生产过程控制就是如此操作。
2.2 硫化锰做硫化剂
2.2.1 加量的影响
净化前硫酸锰溶液成分为Mn 96.88 g/L,Co 101.1 mg/L,Ni 251.46 mg/L,Zn 746.06 mg/L,pH 5.5。加入不同理论量(3.5 g/L)的倍数硫化锰做硫化剂,控制反应为温度90℃,结果如表3所示。
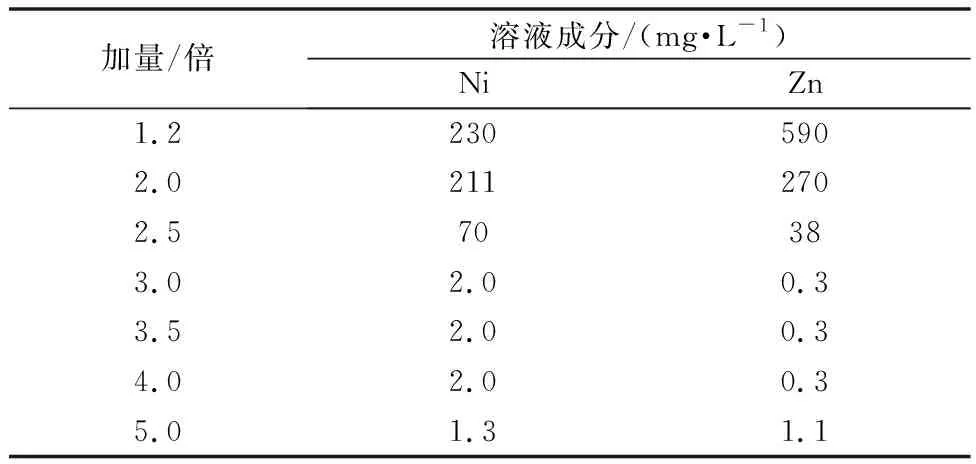
表3 部分金属硫化物成分
由表3可知:加量对除杂有很大影响,随着加量的增大,溶液中重金属离子Ni、Zn含量在逐渐下降。当MnS加量从1.2倍增加到3.0倍时,Ni的含量从230 mg/L降到2.0 mg/L,Zn的含量从590 mg/L降到0.3 mg/L。加量大于3.0倍时,溶液中Ni、Zn含量趋于稳定。因此,MnS加入量是理论量的3倍时,即可达去除重金属镍、锌的目的。
2.2.2 温度和时间的影响
实验前硫酸锰溶液成分为Mn 81.52 g/L,Ni 172.5 mg/L,Zn 483.87 mg/L。硫化锰加量为理论量的3倍,起始pH为3.0~4.0,考察温度和时间对溶液净化的影响,结果如表4所示。
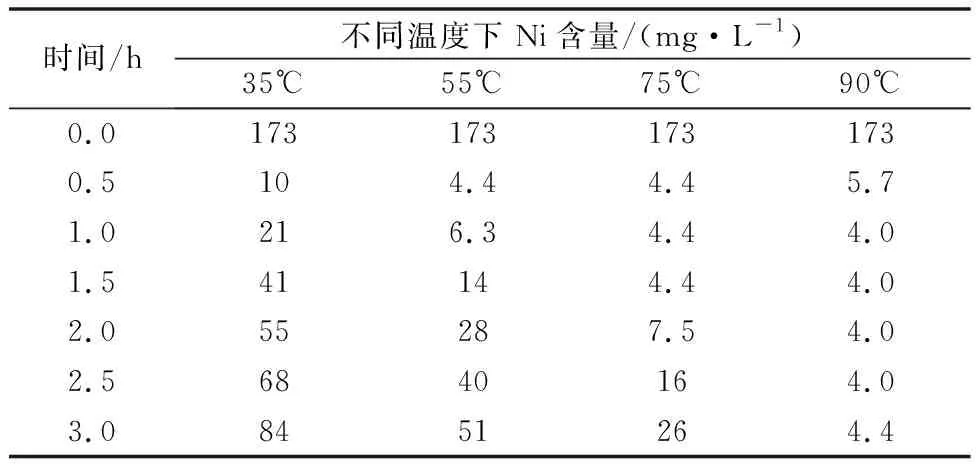
表4 不同温度和时间下净化后溶液Ni含量
由表4可知:温度升高,有利于重金属Ni的脱除,这是因为温度升高相应的重金属硫化物溶度积常数增加,同时MnS离解增大,有利于重金属的沉淀反应进行。反应温度在35~90℃范围,反应时间在0.5 h时,能达到的最低Ni含量分别为10,4.4,8.9 mg/L。在同一温度下随着净化时间延长,硫酸锰溶液中镍含量均有不同程度的升高,说明随时间增加,沉淀后的硫化镍有返溶现象, 90℃时没这个现象,故此温度下硫化比较合适,硫化时间0.5~1 h即可。
2.3 硫化钡做硫化剂
2.3.1 加量的影响
使用体积为100 mL硫酸锰溶液,成分为Mn 96.62 g/L,Ni 284.2 mg/L,Co 79.47 mg/L,Zn 719 mg/L,pH控制在5.86。硫化钡加量为所要去除重金属理论量(10 g/L)的倍数,在常温(30℃)下反应2 h,控制pH 4.5~7.0。30℃下不同量硫化钡净化后溶液成分如表5所示,30℃下不同量硫化钡净化后镍锌去除率及锰回收率如表6所示。
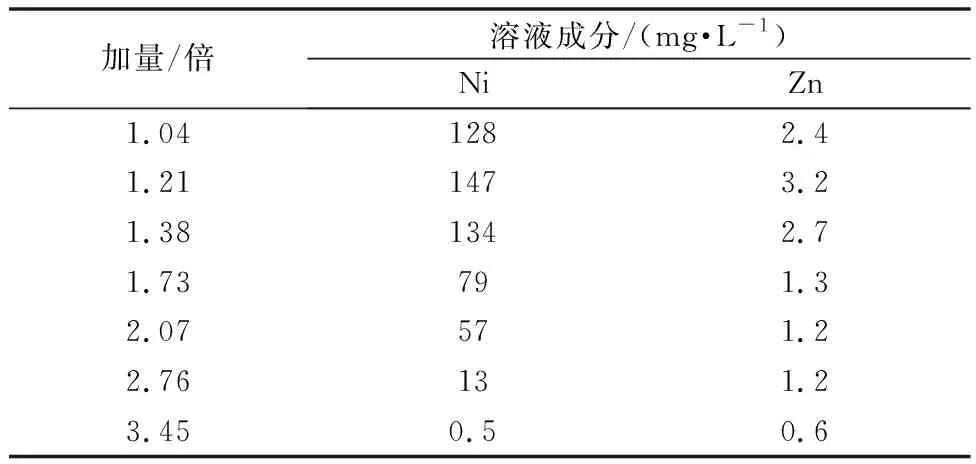
表5 30℃下不同量硫化钡净化后溶液成分
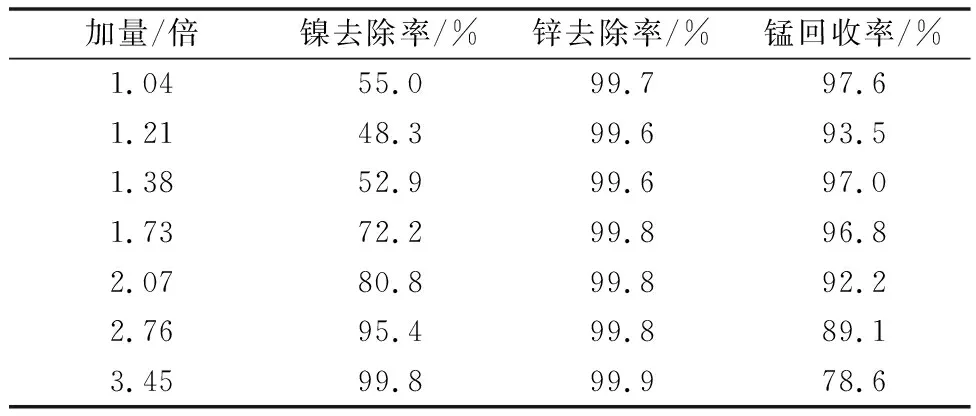
表6 30℃下不同量硫化钡净化后镍锌去除率及锰回收率
常温(30℃)下的净化试验表明:随着硫化钡加量的增加,溶液中镍锌的含量逐渐降低,Zn在BaS加量为1.73倍时就已去除干净,去除率达99.7%,溶液中Zn含量为1.3 mg/L。而镍则要在加量为3.45倍时,去除率才能达到99.7%。常温下重金属镍无法做到深度去除,因此改变反应温度,使温度从常温升高至90℃,在BaS相同加量下考察重金属的脱除效果,结果如表7~8所示。
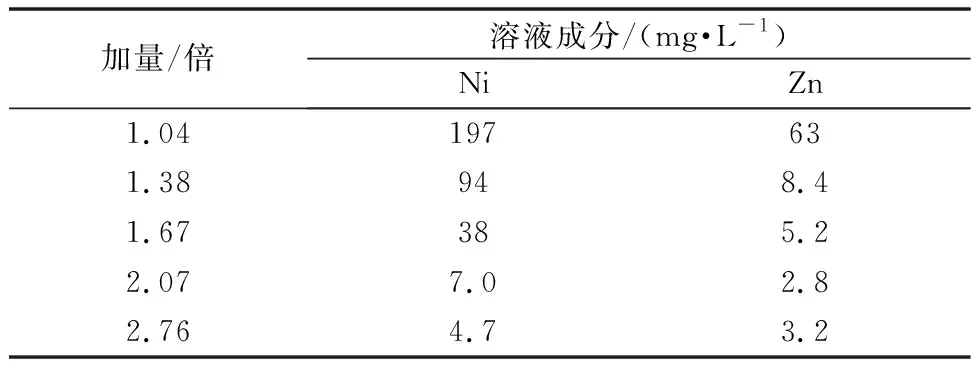
表7 90℃下不同量硫化钡净化后溶液成分
90℃下硫化钡净化效果相比常温(30℃)要好很多,BaS加量仅为理论量的2.07倍时,就达到常温下3.45倍的效果,此时溶液中Ni含量为7 mg/L,Zn含量为2.8 mg/L。
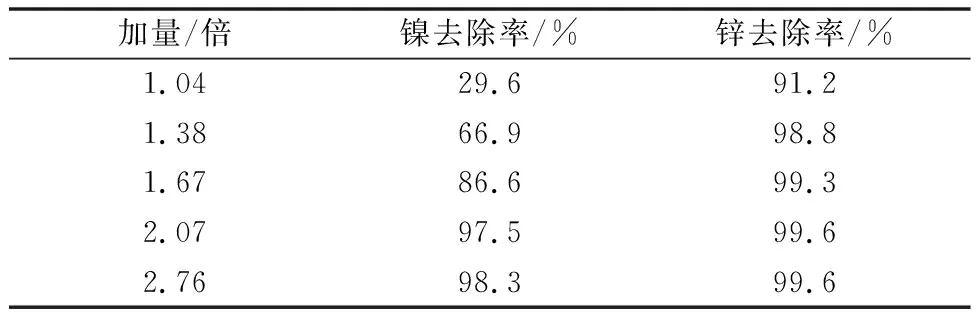
表8 90℃下不同量硫化钡净化后镍锌去除率
2.3.2 温度的影响
使用体积在100 mL工业硫酸锰溶液,其成分为Mn 96.62 g/L,Ni 284.2 mg/L,Co 79.47 mg/L,Zn 719 mg/L,pH 5.86。硫化钡加量为所要去除的重金属理论量的2倍,控制pH 4.5~7.0,在不同温度下反应2 h。不同温度下硫化钡净化后溶液成分如表9所示,不同温度下硫化钡净化后镍锌去除率及锰回收率如表10所示。
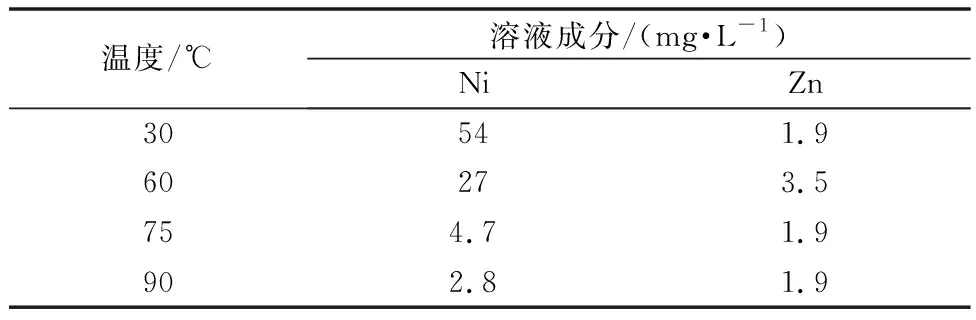
表9 不同温度下硫化钡净化后溶液成分
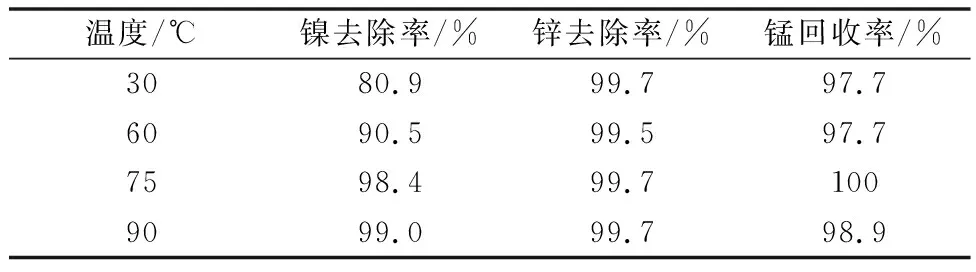
表10 不同温度下硫化钡净化后镍锌去除率及锰回收率
不同温度下溶液净化试验表明:温度对锌的去除影响不大而对镍的去除影响非常大。90℃下硫化钡加量2倍时的净化效果就可以基本达到常温下硫化钡3.45倍的效果。此时镍锌可以完全被去除,锰回收率还高,净化温度应定为90℃。
2.3.3 时间的影响
使用体积在1 000 mL工业硫酸锰溶液,其成分为Mn 92.04 g/L、Ni 220.53 mg/L、Co 93.33 mg/L、Zn 573.08 mg/L、pH 4.95,硫化钡加量为理论量的2.0倍,反应过程不调节pH,温度为90℃,定时取样100 mL,考察反应时间对结果的影响,结果如表11所示。
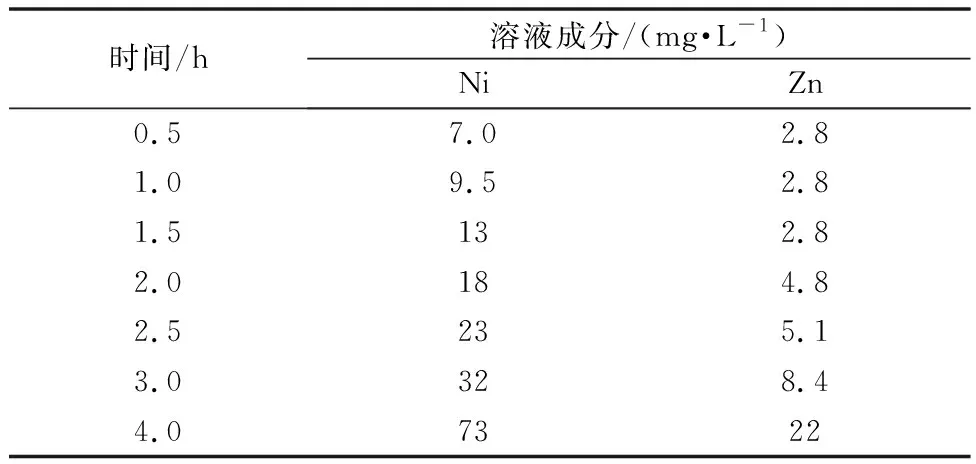
表11 不同净化时间硫化钡净化后溶液成分
由表11可知:随着时间延长,沉淀的Ni和Zn有反溶现象,这在用硫化锰做硫化剂低于90℃下除重金属时也出现过,只是硫化钡的更明显。因此延长反应时间对重金属杂质的脱除没有提高,反而还会降低生产效率,最佳反应定在0.5~1 h即可。
2.3.4 陈化时间的影响
上面的试验已经表明,随时间的延长,已经沉淀的重金属会有不同程度的复溶,如果硫化反应结束后停止搅拌,是不是就不会出现类似的现象呢,否则会增加工序的复杂程度。为此安排了如下的试验。
使用体积在1 000 mL的硫酸锰溶液,其溶液成分为Mn 92.04 g/L、Ni 220.53 mg/L、Co 93.33 mg/L、Zn 573.08 mg/L、pH 4.95,硫化钡的加量为理论量的2.0倍,反应过程不调节pH,温度90℃,时间0.5 h,反应完成后取出8份样,每份100 mL反应溶液,陈化不同时间后取样送分析。陈化后溶液成分如表12所示,陈化后溶液镍锌去除率如表13所示。
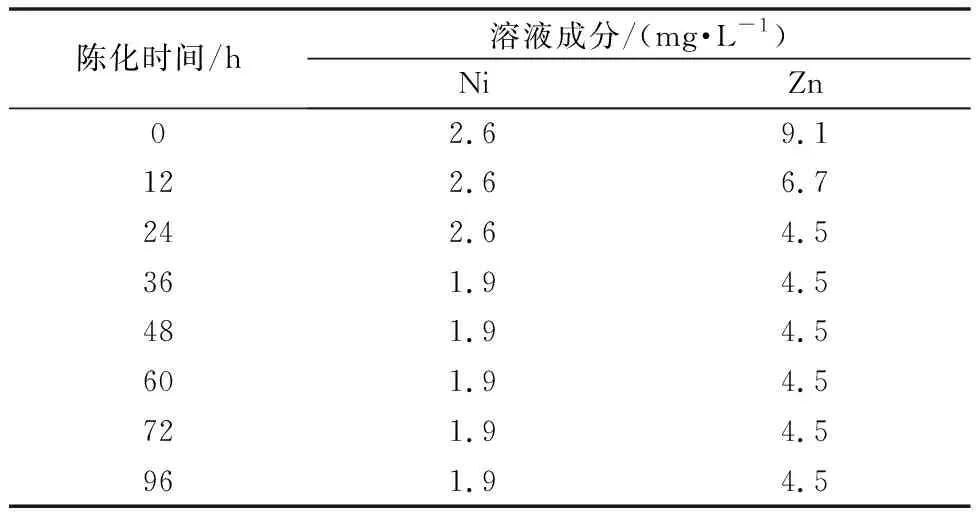
表12 陈化后溶液成分
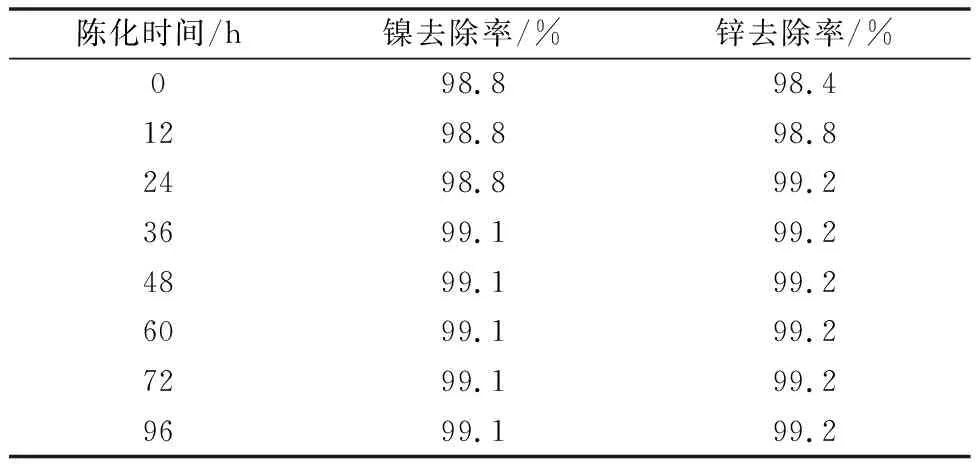
表13 陈化后溶液镍锌去除率
陈化时间试验消除了此前的担心,只要硫化反应到时停止搅拌,就不会出现已沉淀的重金属复溶的现象,溶液中重金属含量反而有所降低。
3 结 论
1)硫化锰、硫化钡为硫化剂时脱除重金属杂质效果显著,提高温度有利于金属离子沉淀,过长反应时间会有不同程度的反溶现象。
2)以硫化锰为脱除剂时,最佳条件在以硫化锰添加量为理论量的3.0倍、温度为35~90℃、反应时间0.5~1.0 h时,镍、锌可分别脱除至2.0,0.3 mg/L。
3)以硫化钡为脱除剂时,添加量为理论量的3.45倍、温度为90℃、反应时间2.0 h时,镍、锌可分别脱除至2.8,1.9 mg/L。
4)硫化反应截止时停止搅拌,长时间的陈化后不会出现重金属沉淀反溶现象。

