Neddylation在病毒感染性疾病中的作用
白 玉 , 赵立红 , 连鹏敬 , 李静云 , 乔 健
(中国农业大学动物医学院 , 北京 海淀 100193)
Neddylation是一种与泛素化修饰相似的蛋白质翻译后修饰方式,通过影响蛋白质的构象、降解和定位等,从而调控细胞周期、细胞凋亡与增殖以及免疫反应等一系列生命活动。运用抑制剂MLN4924特异性抑制Neddylation可阻止肿瘤细胞增殖。近些年研究发现,Neddylation还能通过调控病毒复制或宿主免疫反应而影响病毒感染性疾病的发生和发展,所以调节Neddylation在未来有望成为一种治疗病毒感染性疾病的手段。本文介绍Neddylation在病毒感染性疾病中的作用及其机制,为进一步探讨Neddylation在病毒感染性疾病治疗方面的研究及其应用提供重要的参考。
1 Neddylation概念及其特征
Neddylation是新发现的一种蛋白质翻译后修饰方式,该修饰方式与蛋白质泛素化修饰过程极为相似。NEDD8是类泛素化蛋白家族成员,通过一系列与泛素化相似的酶促反应,与底物蛋白质的赖氨酸残基共价结合的过程称为Neddylation。Neddylation能使底物蛋白质的构象和定位等发生改变,进而影响一系列生命活动过程,如调控细胞周期、细胞增殖和凋亡以及免疫反应等。类泛素分子NEDD8已于1992年在胚胎小鼠大脑中克隆出来,NEDD8由81个氨基酸组成,与泛素分子的氨基酸序列同源性为80%,在动物、植物和真菌中高度保守,且在大部分真核生物组织中都表达,暗示其在生命活动中扮演重要角色[1]。
2 Neddylation反应过程
蛋白质的Neddylation修饰与泛素化修饰相似,也为一系列激酶参与的级联反应,参与Neddylation修饰的蛋白酶主要包括:E1 NEDD8激活酶、E2 NEDD8结合酶和E3 NEDD8连接酶3种。当NEDD8分子前体合成后,被Neddylation酶(NEDP1和UCH-L3)在第76位甘氨酸水解暴露出双甘氨酸序列,后者作为与底物蛋白结合位点被E1 NEDD8激活酶(NAE1和UBA3组成的异二聚体)在镁离子和ATP参与下发生腺苷化,再通过硫脂键转移到NAE的半胱氨酸侧链上 ; 然后有活性的NEDD8通过硫脂反应被转移到E2 NEDD8结合酶(UBC12和UBE2F等) ; 再经E3 NEDD8连接酶将NEDD8 转移到底物蛋白N端的赖氨酸形成异肽键,最终底物蛋白完成Neddylation修饰[1-2]。Cullin家族蛋白是目前研究最为清楚的Neddylation底物,包括Cullin-1、2、3、4a/4b、5和7等,Cullin家族蛋白需要装配成蛋白质复合体才能行使功能。Neddylation是蛋白质翻译后修饰过程之一,该过程是可逆的,被Neddylation修饰的底物蛋白质,在去Neddylation酶催化下发生Deneddylation,将NEDD8 从被修饰后的底物蛋白上解离下来,Deneddylation酶包括CSN、NEDP1、USP21和UCH-L3等。生理情况下,Neddylation和Deneddylation处于动态平衡状态,在蛋白质修饰过程中起重要作用(图1)。目前研究发现,E1 NEDD8激活酶包括NAE1和UBA3,所以阻止NEDD8 与E1 NEDD8激活酶结合就可特异性抑制Neddylation的发生[1,3]。有资料显示,MLN4924能竞争性抑制NAE与NEDD8的结合,从而阻止Neddylation发生,其具体机制为在镁离子存在条件下,ATP脱去2个磷酸基团并释放能量生成AMP,AMP与NEDD8结合成NEDD8-AMP复合物; 后者又与NAEβ亚基的半胱氨酸残基中活性巯基位点反应,形成NAE-NEDD8硫酯复合物并释放AMP,最终形成E1-S-CO-NEDD8三元复合物。MLN4924与AMP在结构上极为相似,MLN4924与NEDD8分子的亲和力远高于AMP,故MLN4924极易与NEDD8发生亲和加成反应形成MLN4924-NEDD8复合物,从而竞争性抑制了NAE与NEDD8的结合,导致Neddylation被阻止[3]。
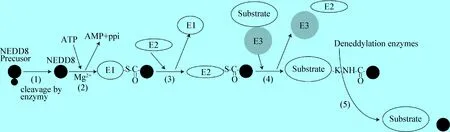
图1 Neddylation 修饰蛋白质过程示意图
3 Neddylation对病毒复制的直接调控作用及机制
以往研究发现,Neddylation参与肿瘤的发生和发展,将MLN4924与细胞自噬阻断剂进行联合应用,能明显抑制肺脏和肝脏肿瘤细胞的增殖[1]。目前,MLN4924作为抗肿瘤药物已经进入一期临床试验。随着对Neddylation研究的不断深入,科学家发现,Neddylation在病毒感染性疾病发生和发展中同样扮演着十分重要的角色。
每年冬、春季是流感病毒感染人和其他动物的高发期,严重威胁全球公共卫生安全、畜禽行业健康和经济发展。A型流感病毒的遗传基因由8个RNA片段组成,其中病毒的聚合酶碱性蛋白2(Polymerase basic 2,pb2)基因编码的PB2蛋白是RNA聚合酶的组成部分,PB2蛋白在A型流感病毒复制中结合帽子结构,并且其羧基端含有核定位序列,是A型流感病毒复制中不可缺少的蛋白质之一。Zhang等研究发现,E3 DEDD8连接酶—HDM2能促进PB2蛋白的K699R位点发生Neddylation,结果导致PB2蛋白的稳定性下降;过表达HDM2也能减弱PB2蛋白的稳定性并抑制A型流感病毒的复制[4]。
Neddylation不仅对RNA病毒的蛋白能进行翻译后修饰直接影响病毒复制,还可对DNA病毒的蛋白进行翻译后修饰而影响病毒的复制。我国是人感染乙型肝炎病毒(Hepatitis B virus,HBV)的高发国家,长期感染HBV,在后期可导致感染者继发肝癌的可能性,HBV感染的高发生率和感染后的严重病症危害我国公共卫生安全。HBV的HBx蛋白在HBV诱导的肝癌发生发展中发挥重要作用,Liu等研究发现,E3 NEDD8连接酶—HDM2能促进HBx蛋白在K91和K95位点发生Neddylation,结果导致HBx蛋白稳定性异常和诱导肝癌作用增强[5]。上述资料表明,Neddylation可直接对RNA病毒和DNA病毒的蛋白质进行翻译后修饰以影响蛋白稳定性,从而直接影响病毒复制及其致病性。
4 Neddylation对病毒复制的间接调控作用及机制
在病毒感染过程中,病毒与宿主间相互作用影响病毒复制,而在此相互作用中,机体免疫系统扮演重要角色。Neddylation是蛋白质翻译后修饰方式之一,而蛋白质参与机体免疫反应的各个环节,所以Neddylation可通过调控机体免疫反应而间接影响病毒复制。
当病毒侵入机体后,细胞会通过模式识别受体(Pattern recognition receptor,PRR)识别病原而激活下游的干扰素调节因子(Interferon regulatory factor,IRF)或核因子(Nuclear factor,NF)-κB等信号通路而增加干扰素(Interferon,IFN)或相关细胞因子表达而消灭病毒[6]。MLN4924能抑制Toll样受体(Toll like receptor,TLR)-3、4和维甲酸诱导基因蛋白Ⅰ(Retinoic acid-inducible gene Ⅰ,RIG-Ⅰ)样受体(Retinoic acid-inducible gene Ⅰ-like receptor,RLR)介导的IFN-β表达,该抑制效果在NEDD8敲除的细胞中消失[7-8]。Sun等研究发现,对PR8和H9N2亚型流感病毒感染的小鼠,再注射MLN4924后,小鼠肺脏中相应病毒滴度明显降低,且前促炎细胞因子如IL-6、IL-1β和TNF-α等分泌量明显低于未注射MLN4924的病毒感染小鼠;病理组织学检测显示,注射MLN4924能减轻流感病毒感染小鼠所致急性肺损伤(Acute lung injury)的发病程度,进一步研究发现,MLN4924通过抑制NF-κB与NEDD8结合而降低Neddylation,进而减少NF-κB与其抑制因子-α(NF-κB inhibitor α,IKB-α)的解离,使NF-κB磷酸化减弱,最终导致细胞因子基因转录水平降低[9]。在Zhang等[4](在前文“3. Neddylation对病毒复制的直接调控作用及机制”中介绍)和Sun等[9]的2项研究中,Neddylation对流感病毒复制影响略有不同的原因可能是:Zhang等的研究是在体外进行,而Sun等的研究是在体内进行,Neddylation是一个极其复杂的调控过程,体内外可能会有不同;另外,在2项研究中所用的流感病毒毒株不同,可能也是造成Neddylation在流感病毒复制中产生不同作用的原因,但具体原因有待于进一步深入探究。人感染Ⅰ型单纯疱疹病毒(Herpes simplex virus-1,HSV-1)后,其常表现为呼吸道、生殖道和皮肤黏膜等处出现大量破溃,孕妇感染HSV-1后,病毒可通过胎盘屏障感染胎儿,导致胎儿发育迟缓、智力低下、小头、小眼、心脏异常以及四肢发育畸形等,HSV-1在体内存活时间较长,机体不易清除该病毒,严重危害人类健康。有研究发现,给处于HSV-1感染早期的小鼠注射MLN4924后,小鼠体内IFN-β生成量明显减少,而在病毒感染后的晚期阶段,MLN4924能明显增加NF-κB的磷酸化,诱导IFN-β大量生成,从而抑制病毒复制[10]。在水泡性口炎病毒(Vesicular stomatitis virus,VSV)感染小鼠中,抑制Neddylation能降低感染早期阶段IFN-β表达,其机制可能是抑制Neddylation能减弱IKB-α与NF-κB的解离,影响NF-κB进入细胞核;在病毒感染后期IFN-β表达增加,其产生机制可能是VSV诱导IRF3活性增强,其作用效果强于对NF-κB信号通路的抑制作用,从而导致IFN-β表达增加[11]。以上2项研究均表明,MLN4924处理HSV-1或VSV感染不同时期的小鼠对IFN表达产生不同的作用效果。前促炎细胞因子IL-1β能诱导大量细胞因子的产生和诱导免疫细胞成熟,IL-1β的成熟需要Caspase-1切割修饰,而Caspase-1本身需要Neddylation后才具有切割蛋白活性。Caspase-1具有CARD、P10和P20三个结构域,其中P10和P20均需要进行Neddylation。运用MLN4924处理呼吸道合胞体病毒(Respiratory syncytial virus,RSV)感染的非洲绿猴肾细胞系后,细胞内Caspase-1生成减少,进而使成熟IL-1β生成不足而降低机体免疫能力,最终导致机体对病原微生物的抵抗力降低以及病毒大量复制[12]。以上资料表明,Neddylation对参与天然免疫反应的某些关键蛋白质进行翻译后修饰以影响IFN及其下游的抗病毒蛋白表达,间接影响病毒复制,最终影响病毒感染性疾病的发生和发展等。
免疫细胞可直接参与或调节机体免疫反应,巨噬细胞(Macrophages)、树突状细胞(Dendritic cells,DC)和T细胞等在抗病毒反应中发挥重要作用。有研究报道,Neddylation通过修饰细胞周期相关蛋白而调节细胞周期进程,影响巨噬细胞的增殖和凋亡,运用MLN4924处理巨噬细胞后发现,巨噬细胞的细胞周期被阻滞,从而影响细胞增殖[13]。运用MLN4924处理DC后发现,不但DC的成熟及其分泌细胞因子功能均被抑制,而且激活T细胞的能力也受到限制[14]。Jin等研究发现,T细胞适配(Adaptor)蛋白Shc的Neddylation对通过细胞外调节蛋白激酶(Extracellular regulated protein kinases,Erk)信号通路激活自身行使免疫功能是必不可少的,且NEDD8缺失直接影响CD4+T细胞的免疫功能[15]。以上资料表明,Neddylation通过蛋白质翻译后修饰作用影响免疫细胞的细胞周期、细胞成熟与分化以及分泌细胞因子等调节机体免疫功能,间接影响病毒复制,最终影响病毒感染性疾病的发生和发展等。
5 展望
Neddylation是与泛素化修饰相似的蛋白质翻译后修饰方式。MLN4924是Neddylation的特异性抑制剂,其具有明显抑制肿瘤细胞生长的作用。近年研究发现,Neddylation通过直接和间接方式调节病毒的复制及其致病性,但在不同种类病毒中,Neddylation对于调控病毒复制的效果不同,产生该现象的具体原因有待于进一步深入研究。综上所述,对Neddylation详细作用及其机制,尤其是其在病毒感染中的具体功能的进一步研究,使其有望成为未来治疗病毒感染性疾病的重要手段之一。

