石榴花水提物的体内外抗炎作用
艾米娜什·哈力别克 , 特列克·阿依恒别克 , 王晓杰 , 艾克拜尔·依明 , 阿得力江·吾斯曼 , 赛福丁·阿不拉
(新疆农业大学动物医学学院 , 新疆 乌鲁木齐 830052)
炎症反应是一种重要的机体防御过程,其中巨噬细胞的激活是炎症反应的启动环节[1]。巨噬细胞能够启动体内的炎症介质产生,并调控炎症反应,释放炎性细胞因子等。脂多糖(Lipopolysaccharides,LPS)是革兰阴性菌细胞壁的重要成分,能激活炎症细胞引起炎症反应,在炎症反应过程中,LPS通过其Toll样受体4(Toll-like receptor 4, TLR4)激活巨噬细胞,从而导致促炎性细胞因子,如白细胞介素6(Interleukin-6,IL-6)、肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)等的产生[2],通过LPS刺激巨噬细胞产生促炎性细胞因子以建立体外炎症模型,可以模拟体内炎症反应过程,常用于抗炎药物作用机制的研究[3]。石榴花为石榴科(Punicaceae)石榴属(PunicL.)植物石榴(PunicgranatunL.)的干燥花瓣[4]。石榴在5~7月开花,花期长,不能结果的钟状花和部分筒状花会自然脱落,因此石榴花资源丰富,极具开发价值。现代药理学研究表明,石榴花富含多酚、黄酮等多种活性物质[5],具有良好的降血糖、降血脂、抗炎、抗氧化和抗肿瘤等功效。石榴花可用于治疗恶心呕吐、腹泻、蠕虫感染等胃肠道疾病,支气管炎等呼吸系统疾病,冠心病、中风等心脑血管疾病[6]。Sarker等[7]采用角叉菜胶所致鼠足肿胀动物模型观察石榴花的抗炎作用,结果表明,石榴花石油醚-醋酸乙酯、二氯甲烷如甲醇提取物,对角叉菜胶所致大鼠足肿胀炎症模型的抑制率分别为26.92%、27.97%和21.85%。Xu等[8]研究表明,石榴花乙醇提取物通过调节炎症中多种介质和细胞因子的合成而产生潜在的抗炎作用,但对石榴花水提物(Pomegranate flower extract water,PEW)的抗炎功效方面报道少有。因此,本试验通过四甲基偶氮唑盐[D3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]法测定PEW对巨噬细胞的安全浓度 ; 用PEW处理LPS诱导的炎症模型小鼠腹腔巨噬细胞后,测定巨噬细胞上清液中的一氧化氮(Nitric oxide,NO)、TNF-α和IL-6促炎介质的释放量,并通过耳郭肿胀试验,检测PEW对二甲苯所致的小鼠耳郭肿胀的抑制作用,综合体内外试验探明PEW的抗炎效果,为石榴花的进一步开发和利用提供科学依据。
1 材料与方法
1.1 实验动物 昆明小鼠50只,雌性,体重(20±2)g,购自新疆医科大学实验动物中心,生产许可证号:SCXK(新)2019-0001。
1.2 药物及试剂 石榴花,购自新疆维吾尔自治区民族医院;营养肉汤,购自北京索莱宝科技有限公司;胎牛血清,购自江苏恩莫阿赛生物技术有限公司;双抗,购自美国Genview 公司;DMEM培养基、PBS,均购自HyClone公司;MTT、二甲基亚砜、二甲苯、NO试剂盒,均购自江苏碧云天生物技术有限公司;TNF-α、IL-6酶联免疫吸附试验(ELISA)试剂盒,均购自杭州联科生物技术股份有限公司。
1.3 试验仪器 TDL-40B离心机、TDL-40B型号离心机,上海安亭科学仪器厂产品;SHE-3000酶标分析仪,北京赛尔福知心科技有限公司产品;PL2002电子天秤,上海托利多仪器公司产品;显微镜,Nikon公司产品;酶标仪,上海亚荣科学仪器公司产品;二氧化碳培养箱,德国Eppendorf 生物科学公司产品。
1.4 方法
1.4.1 石榴花水提物的制备 称取已干燥粉碎过的石榴花300 g过24目筛,经蒸馏水浸泡2 h,在温度为95 ℃、料液比1∶10的条件下提取2 h,重复2次,合并提取液并浓缩至1 g/mL,对浓缩液高压灭菌,冷却后置于4 ℃冰箱备用。
1.4.2 小鼠腹腔巨噬细胞的分离 制备试验前3 天,给小鼠腹腔注射6%淀粉肉汤(1 mL/只)。小鼠颈椎脱臼处死后,放入盛有75%酒精的烧杯中浸泡3 min。取出小鼠,置于无菌纱布上,腹面朝上,用镊子提起小鼠下腹部皮肤,剪开一小口,撕开皮肤,完全暴露腹膜。吸入10 mL PBS缓冲液,用镊子提起腹膜,向腹腔中注入PBS缓冲液,然后吸出腹腔液。将吸出的腹腔液注入15 mL离心管中,以2 000 r/min离心5 min,弃上清后,收集沉淀,即得腹腔巨噬细胞。用完全培养基悬浮细胞,细胞计数板计数。用完全培养液调节细胞密度至1.0×106个/mL,将细胞悬液加到96孔细胞板中,100 μL/孔,置CO2培养箱,37 ℃培养4~6 h使巨噬细胞贴壁[9]。
1.4.3 MTT法检测石榴花水提物对小鼠腹腔巨噬细胞安全浓度 细胞培养至贴壁之后,弃掉细胞上清液,试验组加入100 μL不同浓度的PEW。同时设置空白对照组,只加配制好的完全培养基100 μL, 每组设置4个复孔。再次将96孔板放置于CO2培养箱中培养24 h。24 h后,小心地吸去每孔中的细胞上清液,加入20 μL配置好的MTT溶液,再次放入CO2培养箱中培养4 h。作用4 h后,将每个孔中的培养液弃去,并在每孔中加入150 μL DMSO溶液,震荡5 min,观察到蓝紫色的结晶完全溶解后,酶标仪测定570 nm下的吸光度(Optical density,OD值)[10]。计算公式:细胞存活率/%=试验组不同样品OD均值/空白对照组OD均值×100%。
1.4.4 Griess法检测小鼠腹腔巨噬细胞释放的NO含量 取密度为1.6×106个/mL的巨噬细胞悬液1 mL, 加入到6孔板中,每组设置3个复孔,置于CO2培养箱中培养24 h。24 h之后弃掉细胞上清液,每孔中加入500 μL完全培养基后,试验组加入100、50 μg/mL和10 μg/mL的PEW 500 μL,空白对照组加入500 μL的DMEM培养液。培养4 h后,吸掉上清液,除了空白对照组以外均加1 mL LPS,空白对照组加入1 mL 完全培养基。将6孔板放入到CO2培养箱中继续培养24 h。之后按照NO检测试剂盒说明书检测小鼠腹腔巨噬细胞培养上清液中的NO含量[10-11]。
1.4.5 ELISA法检测小鼠腹腔巨噬细胞分泌的TNF-α和IL-6含量 与上述NO含量测定同样的方法准备细胞上清液,参照ELISA试剂盒说明书进行TNF-α和IL-6含量的测定[12]。
1.4.6 石榴花水提物对小鼠耳郭肿胀的影响 取小鼠25只,每组5只。适应性喂养3 d后,试验前小鼠禁食不禁水12 h,随机分为模型对照组[生理盐水10 mL/(kg·bw)],阳性对照组[地塞米松600 mg/(kg·bw)],PEW高剂量组(每只500 mg/mL),PEW中剂量组(每只100 mg/mL),PEW低剂量组(每只50 mg/mL)。以上各组连续灌胃7 d,0.5 mL/只,1 次/d。最后1 d给药1 h后,将100%二甲苯0.2 mL均匀涂抹于每只小鼠左耳郭两面致炎,右耳做对照。30 min以后颈椎脱臼处死,剪下双耳,采用直径为7 mm的打孔器在左右耳的同样部位打下耳片。电子天平称量,以耳片的质量差作为耳肿胀度,计算肿胀抑制率[13]。
耳肿胀度=左耳耳片质量-右耳耳片质量
耳肿胀抑制率=(模型组肿胀度-给药组肿胀度)/模型组肿胀度×100%
1.4.7 统计分析 计算平均值和标准差,数据以Means±SE表示,用SPSS 21.0软件进行方差分析,以P<0.05作为差异显著性判断标准。
2 结果
2.1 石榴花水提物对小鼠腹腔巨噬细胞的安全浓度 如图1所示,与空白对照组相比,PEW在浓度125 μg/mL时对细胞活力无显著影响(P>0.05),表明PEW在此浓度对细胞无毒性作用。与空白对照组相比,当PEW浓度在62.5 μg/mL和31.25 μg/mL时,细胞活力明显上升(P<0.05),表明PEW在此浓度范围内可提高细胞增殖能力且不会对细胞产生毒性作用。因此根据上述结果,在后续试验中将PEW的添加浓度确定为100、50 μg/mL和10 μg/mL,分别为高剂量组、中剂量组、低剂量组。
2.2 石榴花水提物对小鼠腹腔巨噬细胞释放NO的影响 如图2所示,与空白对照组相比,LPS炎症模型组NO含量显著升高(P<0.05),与LPS炎症模型组相比,PEW均能显著降低小鼠腹腔巨噬细胞NO含量(P<0.05),高剂量组抑制效果最佳。
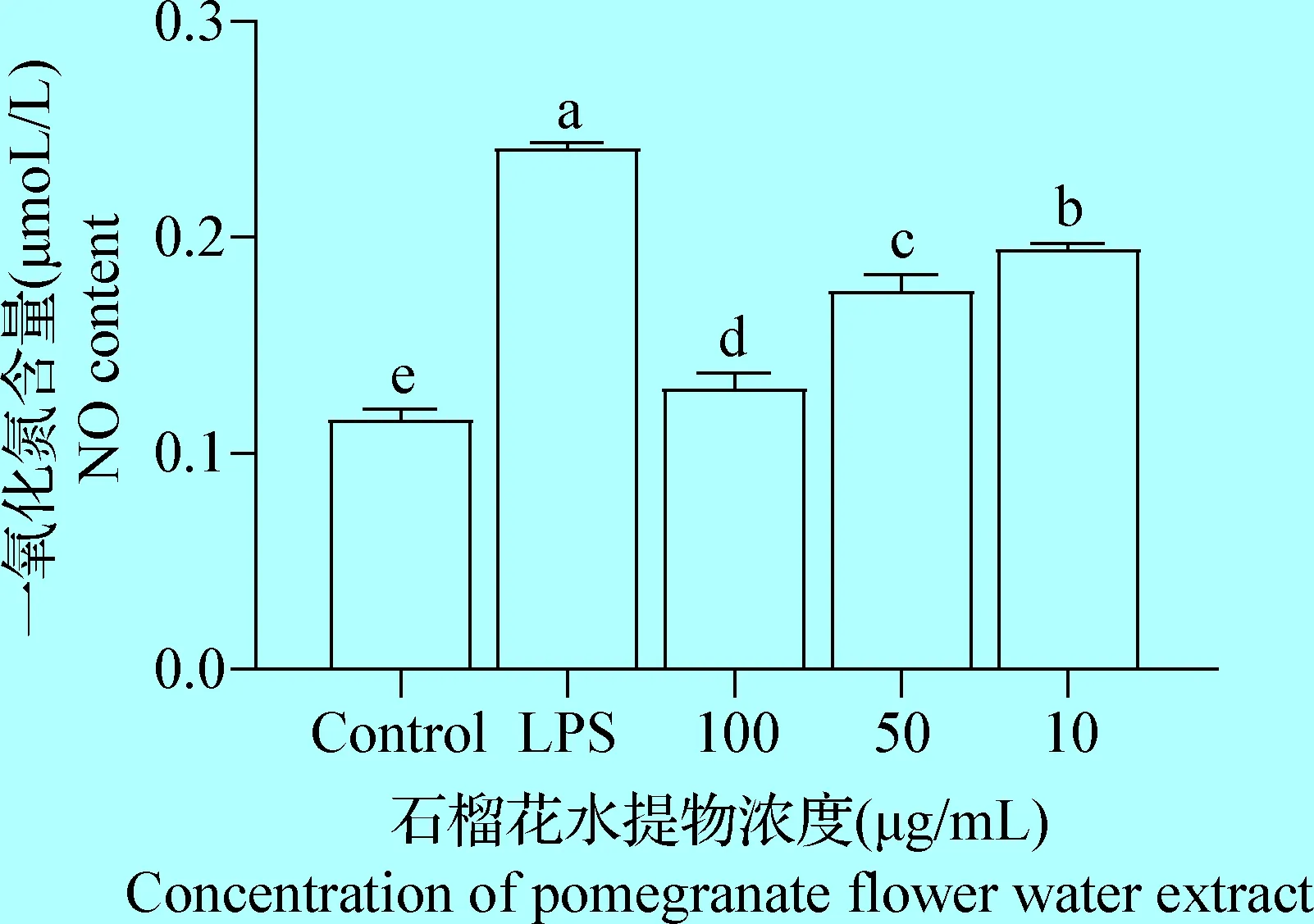
图2 石榴花水提物对LPS 诱导的小鼠腹腔巨噬细胞上清液中NO含量的影响Fig.2 Effect of pomegranate flower water extract on NO content in supernatant of LPS induced mouse peritoneal macrophage
2.3 石榴花水提物对小鼠腹腔巨噬细胞分泌TNF-α和IL-6的影响 如图3所示,与空白对照组相比,LPS组能使IL-6、TNF-α分泌量显著升高(P<0.05);与LPS炎症模型组相比较,PEW高、中、低组显著降低了小鼠腹腔巨噬细胞中的IL-6分泌量(P<0.05), 同时,PEW高、中剂量、低剂量组显著降低了小鼠腹腔巨噬细胞中的TNF-α分泌量(P<0.05)。
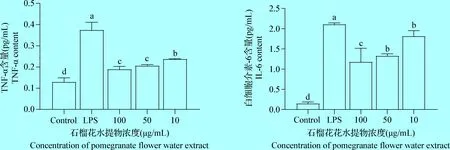
图3 石榴花水提物对LPS诱导小鼠腹腔巨噬细胞促炎性细胞因子含量的影响Fig.3 The effects of pomegranate flower water extract on the content of pro-inflammatory cytokines in LPS induced mouse peritoneal macrophages
2.4 石榴花水提物对小鼠耳郭肿胀的影响 结果如表1所示,与模型对照组相比,PEW高剂量组能显著抑制小鼠耳郭肿胀(P<0.05),并且高剂量组的抑制效果最好;与阳性对照组相比较,高、中、低剂量组无显著差异(P>0.05)。
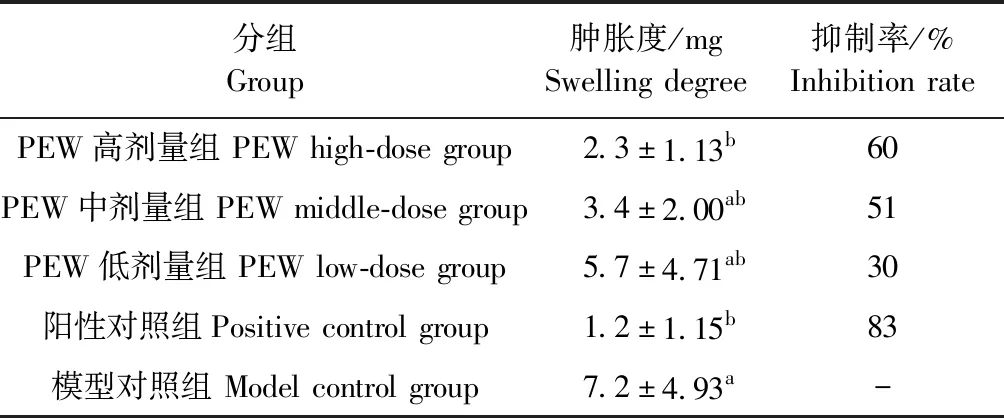
表1 石榴花水提物对二甲苯致小鼠耳郭肿胀的影响Table 1 Effects of PEW on auricle swelling induced by xylene in mice
3 讨论
植物提取物评估先决条件是确保植物提取物的毒性作用受细胞、代谢或信号通路的影响,从而抑制促炎因子的产生,进而发挥抗炎作用,通常,后者为药物的真实药效表现。故在药物无毒剂量下进行试验是考察药物药效的基础[14]。本试验通过MTT法检测PEW对小鼠腹腔巨噬细胞活性的影响,结果显示,PEW在125~31.25 μg/mL对小鼠腹腔巨噬细胞无毒害作用,在62.5 μg/mL和31.25 μg/mL吸光度的显著升高是因为该浓度下PEW能够刺激巨噬细胞分泌大量琥珀酸脱氢酶(SDH),巨噬细胞数量虽未发生变化,但巨噬细胞的活性增强及大量SDH的分泌导致该浓度下吸光值的升高。
LPS可有效激活巨噬细胞内相应的转录因子,从而使相关炎性基因和蛋白的表达发生改变,促使巨噬细胞合成并分泌多种炎性因子如TNF-α、NO、IL-6和MCP-1等[15]。NO是一种多功能介质,参与大量的病理和生理过程。巨噬细胞在内的免疫细胞受到刺激时会产生大量NO。NO是巨噬细胞发挥吞噬功能的基本条件,随着NO的增加,巨噬细胞具有更强的吞噬功能[16]。TNF-α是巨噬细胞被激活时产生的一种细胞因子,是在炎症反应中产生最早的炎症介质,研究发现,当机体受到LPS刺激时多个脏器可迅速大量地合成TNF-α,进而加强中性粒细胞的趋化作用,并与机体随后合成的细胞因子IL-6等协同作用,从而增强巨噬细胞活性并扩大炎症反应[17]。IL-6是炎症发生过程中重要的细胞因子,能与其他炎性因子起到协同作用,放大炎症反应,从而对机体造成损伤,可作为判断炎症反应程度的指标[18]。王翠芳等[19]研究表明,35%和75%乙醇洗脱沙葱黄酮均能极显著降低经LPS刺激下巨噬细胞NO的分泌,且具有剂量依赖性。韩璐等[20]通过试验表明,当紫锥菊不定根提取物浓度为50 μg/mL时,NO的释放量显著低于LPS组,这表明紫锥菊不定根同样具有抗炎作用。王翠芳等[19]研究表明,35%乙醇洗脱沙葱黄酮通过调节NO、TNF-α和IL-6炎症介质的生成发挥抗炎症作用。本试验结果显示,PEW在100 μg/mL和50 μg/mL时,均能显著抑制LPS诱导炎症模型巨噬细胞NO、TNF-α、IL-6的分泌,故说明PEW可通过调节NO、TNF-α、IL-6炎症介质的生成发挥抗炎作用。
炎症是在致炎因素作用下,具有血管系统的活体组织对损伤因子所发生的防御反应。首先表现为局部血管扩张,毛细血管通透性增加,病程稍长则出现组织变性和纤维化。王思芦等[21]研究表明,中、高剂量明日叶均能显著降低二甲苯所致小鼠耳肿胀程度,小鼠的耳片病理切片观察,中、高剂量组的耳切片白细胞数量明显较少,肿胀较轻等组织变化,表明明日叶具有提高机体体液免疫及抗炎的功能。本试验结果显示,PEW高剂量组对二甲苯致小鼠耳郭肿胀的抑制可高达60%,说明PEW起到了抗炎的功效。
综上所述,通过体内外炎症模型试验可知,PEW通过提高巨噬细胞的吞噬功能、影响细胞因子和炎症介质的分泌,从而发挥良好的抗炎活性作用,因此,认为PFW可以作为治疗炎症相关疾病的抗炎药,但其有效成分及分子作用机制尚不明确,有待进一步研究。

