胸主动脉腔内修复术在急性主动脉夹层合并严重低氧血症中的治疗作用*
丁 垚,王 哲,赵 渝,陈子徽,李 强,张 诚△
重庆医科大学附属第一医院:1.胸心外科;2.血管外科,重庆 400016
急性主动脉夹层(AAD)是由于主动脉内膜撕裂,导致血液进入主动脉内膜和中膜之间,并压迫内膜和中膜,从而产生假腔[1]。AAD可引起主动脉破裂、重要器官灌注不足、心肌缺血、主动脉逆行血流、心包填塞、呼吸功能障碍,其病死率极高[2-3]。AAD是一种常见的心血管危急重症[4]。部分AAD患者术前合并低氧血症需要机械通气治疗,但接受机械通气治疗可导致围手术期严重并发症的发生[5]。因此,预防和治疗严重低氧血症对降低围术期AAD病死率具有重要意义[6]。本文旨在探讨胸主动脉腔内修复术(TEVAR)对AAD合并严重低氧血症的安全性和有效性。
1 资料与方法
1.1一般资料 回顾性分析2015年8月至2020年8月重庆医科大学附属第一医院胸心外科和血管外科因AAD合并严重低氧血症入院患者28例。纳入标准:(1)年龄18~80岁;(2)入院时经主动脉CT血管造影(CTA)明确诊断为AAD Stanford B型患者;(3)入院3 h内动脉血气分析示氧合指数(OI)≤200 mm Hg;(4)发病至入院时间小于14 d。排除标准:(1)存在免疫系统、慢性阻塞性肺疾病、结缔组织病、慢性肾衰竭、终末期肝病、结缔组织疾病、感染性疾病及恶性肿瘤;(2)手术前3 h内无动脉血气分析检查记录及无吸入氧浓度记录;(3)心功能不全或左室射血分数小于45%;(4)外伤导致的主动脉夹层;(5)发病前有明确导致低氧血症的基础疾病如慢性阻塞性肺疾病、严重肺部感染、心力衰竭、严重贫血等[7-8]。所有患者均签署书面知情同意书。本研究为非随机对照试验,通过重庆医科大学附属第一医院伦理委员会的伦理审查,伦理号:2017-179。
1.2分组情况 根据治疗方案不同分为手术组22例和非手术组6例。手术组患者均待入院7 d后行TEVAR治疗[9-12];非手术组患者为入院7 d内保守治疗期间因呼吸衰竭死亡或入院后家属放弃手术治疗并签署知情同意书的患者。
1.3治疗方案
1.3.1保守治疗 针对AAD患者,入院后立即予以吗啡止痛,同时根据病情予以降血压、控制心率对症治疗。针对低氧血症,予以鼻导管/面罩吸氧,若呼吸困难症状无明显改善,予以无创呼吸机通气治疗,若患者呼吸困难症状仍无改善,或出现意识障碍、气道分泌物过多无法自行咳嗽排痰、呼吸肌疲劳等症状,予以有创机械通气治疗。气道分泌物过多且咳嗽困难的患者,予以雾化吸入乙酰半胱氨酸(进口药品注册证号:H20150548,300 mg)、静脉滴注氨溴索注射液(天津药物研究院药物有限公司,国药准字:H20041473,30 mg)对症治疗。合并肺部感染患者,根据病原菌培养及药敏结果予以抗菌药物治疗。全身炎性反应重,出现急性肾衰竭的患者,予以血液滤过治疗。合并基础疾病如痛风、糖尿病等,予以降尿酸、降血糖等治疗,保守治疗7~10 d后复查胸主动脉CTA。
1.3.2手术治疗 经保守治疗7 d后,主动脉血管壁水肿减轻,TEVAR治疗导致夹层逆撕、破裂或患者死亡的风险降低,行手术治疗。患者全身麻醉,腹股沟切开或经皮穿刺置入血管鞘后进入主动脉真腔。经5F猪尾导管,用320 mg/mL碘造影剂行血管造影证实主动脉夹层或壁间血肿,根据血管造影测量锚定区直径,覆膜支架直径大于真腔直径10%。使用静脉药物将血压控制在大约90 mm Hg,以避免支架植入时摆动或移位,然后在预先确定的锚定区释放覆膜支架(美敦力、微创心脉科技)。支架释放后造影查看支架贴壁情况和内瘘情况,确保支架形态和位置满意,复查主动脉造影显示远端真腔显影良好、内脏动脉显影良好。术后予以机械通气、降血压、调脂等对症治疗,待患者意识、肌力、循环稳定后拔除气管插管,拔管后6 h复查动脉血气分析。术后1周复查主动脉CTA,明确有无夹层逆撕、支架移位、内漏、断裂、内脏缺血及肺部炎症等情况。
1.4数据收集 (1)收集患者年龄、体质量指数(BMI)、吸烟指数、基础疾病病史资料。(2)收集患者氧分压(PaO2)、二氧化碳分压(PaCO2)、OI、入院血压、红细胞计数(RBC)、血红蛋白(Hb)、清蛋白(Alb)、血清肌酐(SCr)、血清尿素氮(BUN)、肌钙蛋白(cTnT)、脑钠尿肽(BNP)等相关数据。其中入院动脉血气收集点为入院1 h内第1次血气分析结果,手术组术前动脉血气收集点为进入手术室前3 h内血气分析结果,术后动脉血气收集点为术后拔除气管插管后第1个24 h内第1次血气分析结果,并根据氧分压及吸入氧浓度计算OI。入院血压为患者入院1 h内未使用降压药物前测得的右上肢血压。其余指标均为入院后24 h内检查结果。
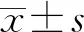
2 结 果
2.1两组基线资料比较 AAD合并严重低氧血症患者28例,其中男性25例(89.3%)、女性3例(10.7%),平均年龄(53.25±13.74)岁,入院后均明确诊断为主动脉夹层Stanford B型。患者均接受了数字减影血管造影(DSA)引导下腔内介入治疗,术中使用主动脉覆膜支架。非手术组患者中夹层累及肠系膜上动脉2例,手术组中夹层累及肠系膜上动脉0例,两者比较差异有统计学意义(P=0.040)。手术组与非手术组基线资料单因素分析见表1。
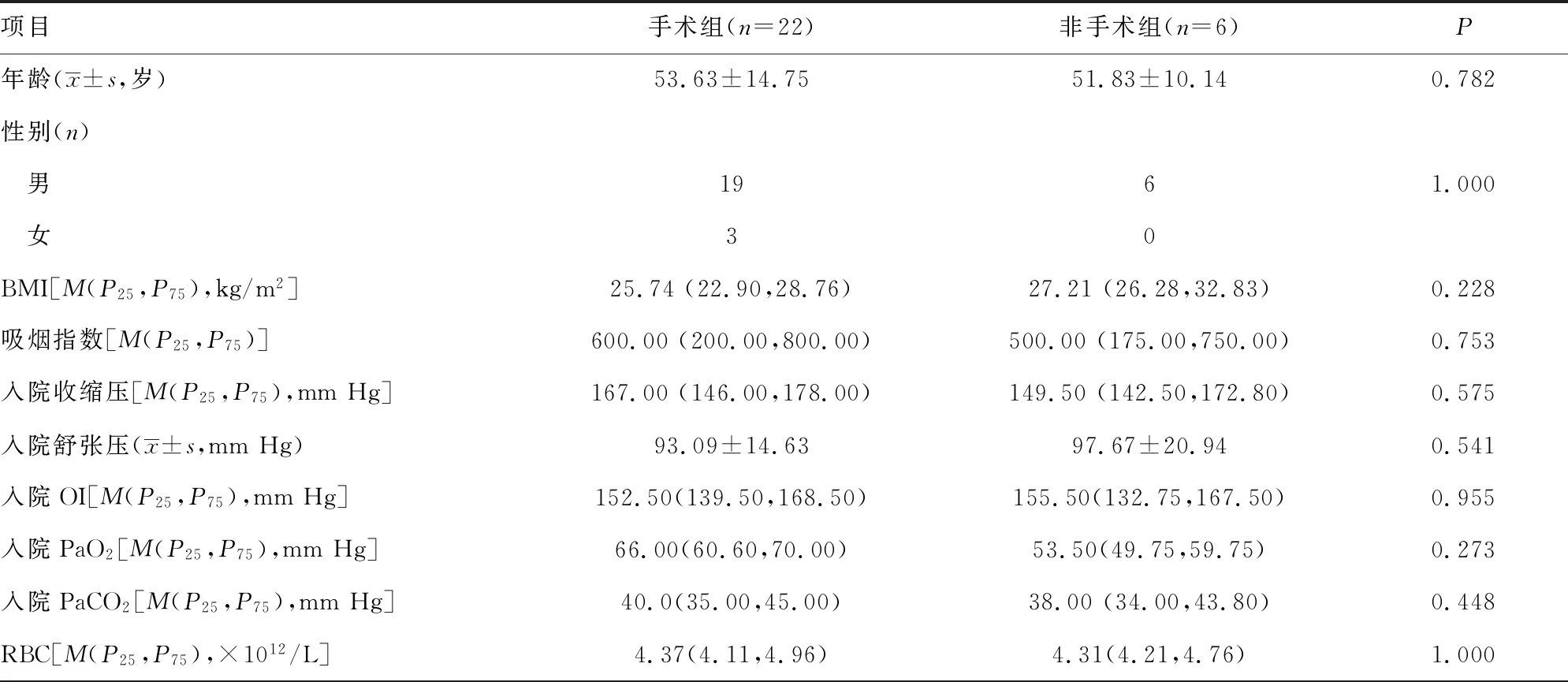
表1 手术组与非手术组基线资料单因素分析结果
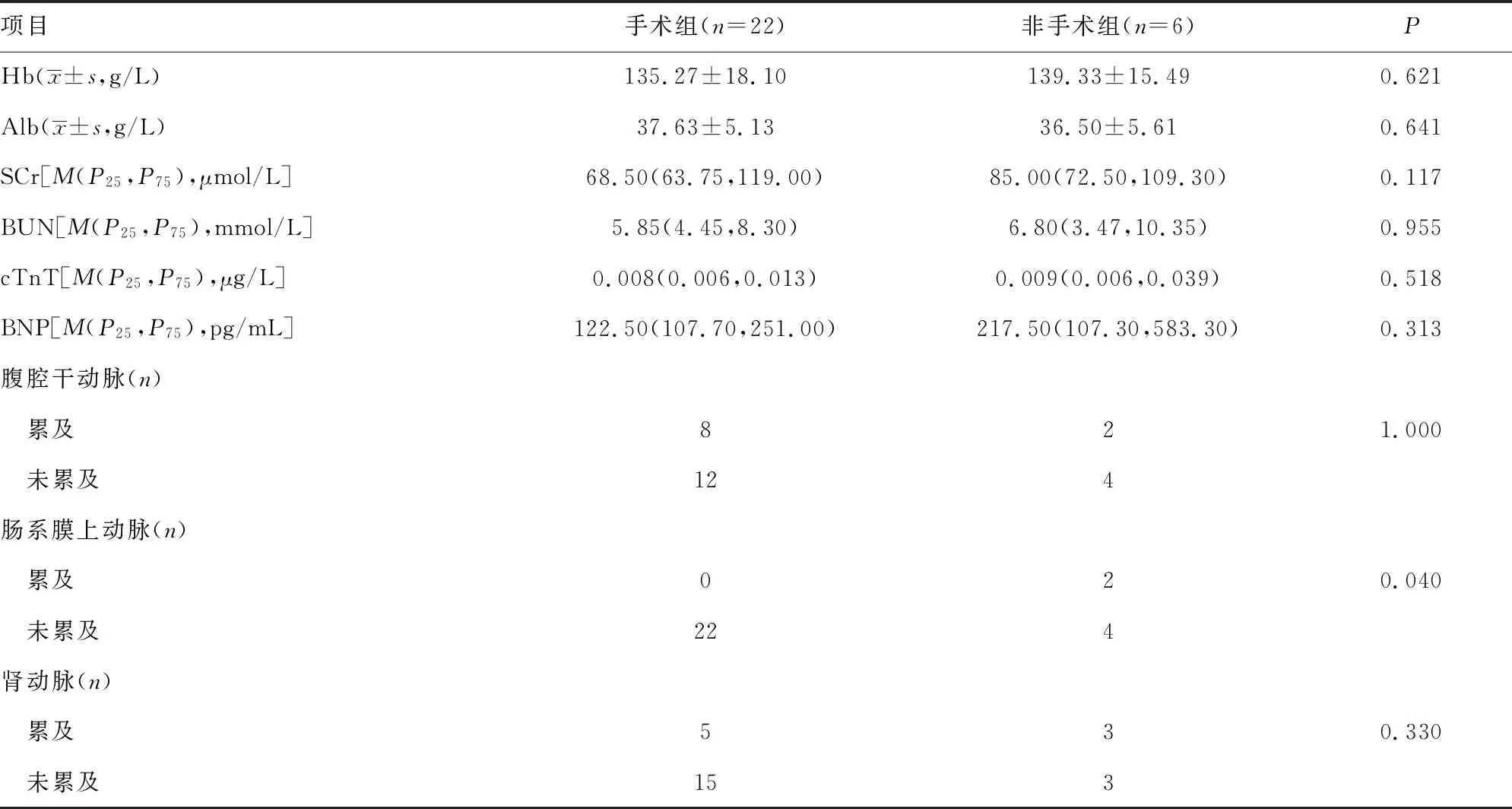
续表1 手术组与非手术组基线资料单因素分析结果
2.2两组患者预后情况 手术组和非手术组均有1例因呼吸衰竭行气管插管机械通气治疗,分别占手术组和非手术患者的4.5%、16.7%。手术组死亡1例(4.5%),死亡原因为术后AAD逆撕破裂,术后ICU平均停留时间(2.6±0.1)d,术后平均住院时间(8.6±2.1)d;1例术后第2天出现一过性意识障碍(4.5%),经抢救后意识恢复后顺利出院;1例术后出现凝血功能障碍(4.5%),经对症治疗后出院。非手术组死亡6例(100.0%),死亡原因均为呼吸衰竭。
2.3手术组患者氧合恢复情况 手术组患者术前3 h经保守治疗后的OI较入院时无明显改善(P=0.104);经手术治疗后OI较术前3 h明显改善(P<0.001)。见表2。
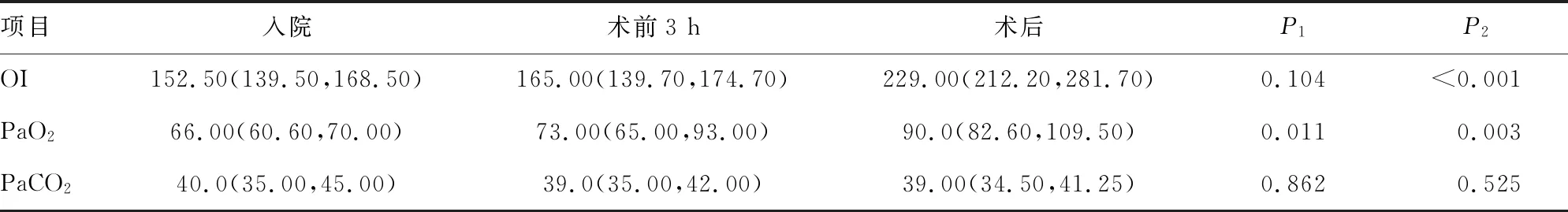
表2 手术组患者入院、术前3 h、术后OI、PaO2、PaCO2单因素分析[M(P25,P75),mm Hg]
3 讨 论
AAD患者由于其病理生理特点的原因低氧血症的发生率很高[13]。既往研究指出将术前低氧血症定义为OI≤200 mm Hg[8]。ADD合并低氧血症的发生概率为47%~50%[7,14]。传统开放手术创伤巨大,急性呼吸窘迫综合征等术后严重并发症率高和较高的围术期病死率[15]。TEVAR已经成为治疗AAD Stanford B型的首选治疗方案[16]。因AAD患者在发病0~5 d中,OI与发病时间呈负相关[7],本研究均待患者发生AAD Stanford B型7 d后,OI稳定后行手术治疗。INAMI等[17]提出缺氧和炎症介质上调血管内皮生长因子的表达,导致血管炎症、基质降解和新生血管生成,主动脉壁变弱,从而影响AAD假腔内闭合,未闭合的假腔是AAD预后的独立危险因素[18]。AAD发病后,低氧血症患者C反应蛋白和降钙素原明显升高,炎性反应剧烈,血管中层暴露在血液中,促使炎症细胞释放细胞因子,诱发应激反应,破坏机体抗炎性反应与系统性炎性反应平衡,同时激活体液免疫、细胞因子,促使大量细胞因子入血进入肺组织,大量炎症细胞聚集在肺组织内,引起炎症因子“瀑布样”释放,血管壁通透性增加,损伤肺组织内皮细胞,诱发急性肺损伤,最终导致低氧血症和急性肺损伤[19-21]。73%AAD患者存在高血压的既往史,较低的收缩压会增加低氧血症的发生风险,这与低血压引起的肺循环改变和组织灌注不足相关[7]。
及时行TVEAR治疗AAD可有效隔绝AAD,避免主动脉中层暴露于血液中,防止炎症因子的继续释放导致血管通透性降低,支架覆盖夹层破口降低了AAD破裂的风险,因此,适度升高患者血压可以改善肺灌注,避免低氧血症及肺损伤的发生。本研究初步证实了TVEAR对ADD合并严重低氧血症患者的OI有明显的改善。
本研究存在一定的局限性:纳入样本太少,未能统计分析导致非手术组患者死亡的危险因素及预测因子。未纳入ADD未合并严重低氧血症患者作为对照组,无法分析导致AAD合并低氧血症的相关危险因素。本研究为回顾性研究分析,无法采集白介素、机体免疫功能检查等特异性数据。AAD并发严重低氧血症是AAD常见的并发症之一,对患者的预后可能产生严重不良影响,TVEAR治疗能改善AAD并发严重低氧血症患者的OI,值得临床推广与应用。

