不同分期支气管哮喘患者外周血EOS、IL-25、IL-35与肺功能FEV1的关系分析
高 莹,宋 迪,张 云,刘 蕾
北部战区总医院呼吸内科,辽宁沈阳 110016
随着环境污染和人口老龄化的加剧,各种呼吸道疾病的发病率越来越高。支气管哮喘是临床上常见的呼吸系统疾病,其临床主要表现为呼吸困难、咳嗽、胸闷等症状,反复发作可导致喘息等症状,严重影响患者的生活质量[1-2]。既往研究发现,哮喘患者外周血嗜酸性粒细胞(EOS)显著升高,EOS阳离子蛋白作为EOS活性和转归标志,已经广泛用于哮喘的诊断和疗效判定[3-4]。此外,有研究发现白细胞介素(IL)-25、IL-35在支气管哮喘发病机制中起着重要的作用[5-6]。IL属于作用于多种细胞的一类因子,其中IL-35是最新发现的IL-12细胞因子家族成员,可以抑制炎性反应,防止过度的自身免疫反应发生[7-8]。IL-25与IL-17有同源性,它是由活化记忆T细胞产生的一种炎前细胞因子,能诱导多种趋化因子和细胞因子的表达,在炎症和造血过程中发挥重要作用[9-10]。本研究通过观察不同分期支气管哮喘患者的外周血EOS、IL-25、IL-35水平变化,分析其与肺功能的关系,现报道如下。
1 资料与方法
1.1一般资料 选取2018年3月至2019年3月在本院接诊的70例支气管哮喘患者作为研究对象。包括初诊急性发作期35例(急性发作组),其中男21例、女14例,年龄23~61岁,平均(36.95±13.51)岁;治疗后缓解35例(临床缓解组),其中男26例、女9例,年龄22~63岁,平均(37.81±13.62)岁,两组一般资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)符合《支气管哮喘防治指南》[7]中的诊断标准;(2)无其他严重疾病;(3)无药物过敏史。排除标准:(1)严重肺部疾病;(2)对本次治疗药物过敏;(3)免疫功能异常;(4)患有感染疾病。
1.2方法 采集研究对象肘静脉血4 mL,3 500 r/min离心10 min,提取血清,采用双抗体夹心酶联免疫吸附法测定外周血EOS、IL-25、IL-35;采用肺功能测试仪HI-101测定肺功能第1秒用力呼气容积(FEV1)。
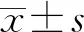
2 结 果
2.1各组外周血EOS、IL-25、IL-35及肺功能FEV1比较 急性发作组患者外周血EOS、IL-25高于临床缓解组,IL-35、肺功能FEV1明显低于临床缓解组,差异有统计学意义(P<0.05),见表1。
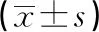
表1 各组外周血EOS、IL-25、IL-35及肺功能FEV1比较
2.2EOS、IL-25、IL-35和不同分期支气管哮喘患者肺功能FEV1的相关性分析 经Pearson相关分析得知,支气管哮喘患者外周血EOS、IL-25与肺功能FEV1表达呈负相关(r=-0.301、-0.565,P<0.05)、血清IL-35与肺功能FEV1表达呈正相关(r=0.508,P<0.05)。
2.3外周血EOS、IL-25、IL-35与肺功能FEV1在支气管哮喘中的诊断价值分析 EOS诊断支气管哮喘的ROC曲线下面积(AUC)为0.688,95%CI为0.564~0.812;IL-25诊断支气管哮喘的AUC为0.917,95%CI为0.897~0.990;IL-35诊断支气管哮喘的AUC为0.928,95%CI为0.865~0.991;肺功能FEV1诊断支气管哮喘的AUC为0.891,95%CI为0.815~0.968;EOS+IL-25+IL-35+肺功能FEV1诊断支气管哮喘的AUC为0.997,95%CI为0.989~1.000;EOS+IL-25+IL-35+肺功能FEV1单独检测分别与联合检测AUC比较,差异均有统计学意义(Z=-4.952、-1.556、-2.250、-2.795,P<0.05);联合检测EOS+ IL-25+IL-35+肺功能FEV1特异度、准确度分别为91.93%、93.46%,明显高于各指标单独检测结果,见图1、表2。

图1 外周血EOS、IL-25、IL-35及肺功能FEV1单独检测和联合检测诊断支气管哮喘的ROC曲线

表2 外周血EOS、IL-25、IL-35及肺功能FEV1单独检测和联合检测诊断支气管哮喘的诊断效能
3 讨 论
支气管哮喘是一种以气道高反应性和慢性气道炎症为特征的过敏性疾病。多种免疫炎症细胞和细胞因子参与了慢性气道过敏性炎症的过程。如果不加以治疗,可能会发展成呼吸衰竭,并严重导致患者肺功能下降[10-11]。由于其发病机制较为复杂,造成了治疗的艰巨性和复杂性,任何单一治疗都可能存在部分缺陷,因此进一步明确其发病机制,对今后治疗起着关键作用[12-13]。
EOS是白细胞的组成部分,具有杀灭细菌和寄生虫的功能,也是免疫反应和过敏反应过程中非常重要的细胞[14-15]。有研究显示,EOS介导的炎性反应是支气管哮喘发病的重要机制,其表达的过氧化物酶、阳离子蛋白和碱基蛋白在致炎过程中都发挥着重要作用,导致气道高反应性的发生[16]。本研究结果显示,急性发作组患者外周血EOS高于临床缓解组,且与肺功能FEV1表达呈负相关,分析是因为EOS可导致气道上皮损伤和脱落,大量气道黏液分泌,在气道高反应性和气道阻塞的发展中起重要作用。有研究表明,IL-25能够分化Th0细胞,并诱导IL-4、IL-5和IL-13的生成,进而诱导Th2型免疫反应,产生EOS,诱导杯状细胞增生,导致气道炎性反应的发生[17]。本研究结果显示,急性发作组患者IL-25高于临床缓解组,且与肺功能FEV1表达呈负相关,提示当患者发生支气管哮喘时,IL-25随之升高。原因可能为气道上皮损伤可增加IL-25的释放,并在哮喘气道炎症和气道高反应性中发挥作用。IL-35是最新发现的IL-12细胞因子家族成员,具有调节T细胞产生的特异性抑制性细胞因子可促进T淋巴细胞在抑制炎性反应中的作用[18]。本研究结果显示,急性发作组患者IL-35明显低于临床缓解组,且与肺功能FEV1表达呈正相关,原因可能为IL-35通过抑制效应性T细胞和促进Treg细胞的表达,通过诱导调节T淋巴细胞产生等达到维持免疫系统平衡的作用[19-20]。本研究结果显示,急性发作组患者肺功能FEV1明显低于临床缓解组,差异有统计学意义(P<0.05)。
本研究结果显示,EOS+IL-25+IL-35+肺功能FEV1与支气管哮喘的关系更为密切,EOS+IL-25+IL-35+肺功能FEV1单独检测分别与联合检测AUC比较差异均有统计学意义(P<0.05);其联合检测的特异度、准确度明显高于单独检测结果。但由于本次研究样本较少,且未分析治疗前后各项指标的变化,今后仍需扩大样本量,延长试验时间进一步深入研究。
综上所述,急性发作组患者外周血EOS、IL-25高于临床缓解组,IL-35、肺功能FEV1明显低于临床缓解组,差异有统计学意义(P<0.05),且EOS+IL-25+IL-35+肺功能FEV1联合检测具有较高的特异度、准确度,可在一定程度上评价支气管哮喘发作的严重程度,临床应用价值高。

