氨磷汀联合化疗治疗卵巢癌的临床疗效及对患者血清肿瘤标志物、预后的影响
靳桂红 王道军 马朝峰
卵巢癌在女性生殖系统肿瘤中的发病率仅次于子宫内膜癌和子宫颈癌,其发病机制尚未明确,但多项研究证实与年龄、遗传、环境等因素相关[1-2]。卵巢癌起病较隐匿,缺乏有效的筛查手段,约70%的患者确诊时已经处于中晚期,以铂类药物为主的同步放化疗是最常用的治疗方法[3-5]。但是,部分卵巢癌患者由于耐药性、严重不良反应等,不能顺利完成治疗,导致化疗效果不理想,预后较差。氨磷汀是1种广谱细胞保护剂,可以保护正常器官、组织不受化疗、放疗的影响,而对肿瘤组织则不具备保护作用[6-7]。目前,氨磷汀在卵巢癌患者放化疗中应用的报道较少,本研究讨论了氨磷汀联合化疗治疗卵巢癌的临床疗效及对患者血清肿瘤标志物、预后的影响。
1 资料与方法
1.1 一般资料
选取2014年6月至2019年6月医院收治的120例卵巢癌患者,按随机数字表法分为2组。实验组60例,年龄40~68岁,平均(54.94±5.23)岁;FIGO分期:Ⅱ期28例、Ⅲ期20例、Ⅳ期12例。对照组60例,年龄42~70岁,平均(55.32±6.68)岁;FIGO分期:Ⅱ期30例、Ⅲ期18例、Ⅳ期12例。2组患者一般资料比较无差异(P>0.05)。
1.2 纳入、排除标准
纳入标准:①经细胞学及组织学病理确诊为卵巢癌患者;②FIGO分期:Ⅱ~Ⅳ期;③既往未接受过卵巢癌化疗、放疗治疗,生存期>3个月;④经医院伦理委员会审批,患者自愿参与本研究。排除标准:①患有其他恶性肿瘤者;②合并急性、慢性感染或出血倾向者;③合并血液系统疾病或传染病等者;④合并严重心脑血管疾病者;⑤严重肝、肾、心功能障碍者;⑥合并精神疾病、沟通困难者。
1.3 治疗方法
2组患者均在治疗过程中进行抑酸、保肝和抗感染等常规处理。对照组:采取紫杉醇+卡铂化疗治疗,d1、d8、d15,紫杉醇80 mg/m2静脉滴注,卡铂AUC 5~6静脉滴注,21 d为1个化疗周期,共化疗3个周期。实验组:d1、d8、d15,紫杉醇+卡铂化疗剂量同对照组;在服用5-羟色胺阻滞剂等止吐药物后、化疗开始前30 min,将250~400 mg/m2氨磷汀+50 ml生理盐水在15 min静脉滴注完毕,调整患者体位并给予心电监护,21 d为1个化疗周期,共化疗3个周期。治疗结束进行影像学检查,并对治疗效果进行评估。
1.4 观察指标
①临床疗效。化疗前和化疗结束后2周,进行CT检查,按照RECIST实体瘤疗效评价标准[8],完全缓解(CR):可见病灶消失,至少持续4周以上扫描无异常;部分缓解(PR):肿瘤最大直径缩和最大垂直直径的乘积减小≥50%;疾病稳定(SD):肿瘤最大直径和最大垂直直径的乘积减小<50%,增大<25%;疾病进展(PD):1个或多个病灶的肿瘤最大直径和最大垂直直径的乘积增大≥25%。疾病控制率=(CR+PR+SD)/总人数×100%;②治疗前后T细胞亚群水平。采集化疗前后患者静脉血5 ml,取3 ml 6 h内进行染色处理,使用FACSCalibur流式细胞仪(美国BD公司生产),FACScomp软件检查仪器灵敏度并设置实验条件,利用MultiSET软件对辅助/诱导T淋巴细胞(CD4+)、抑制/细胞毒T淋巴细胞(CD8+)进行绝对计数分析,计算两者在T淋巴细胞中的百分比以及CD4+/CD8+比值;③血清肿瘤标志物水平。治疗前、治疗结束后分别取入组患者3 ml空腹静脉血,分离血清后利用电化学发光仪,检测血清腺癌相关抗原(CA153)、卵巢癌相关抗原(CA125)、癌胚抗原(CEA)水平,试剂盒由日本日立公司提供;④不良反应发生情况。根据通用毒性标准,将不良反应分为0~Ⅳ级,不良反应包括胃肠道反应、肝肾功能异常、疲乏、骨髓抑制、周围神经毒性反应等;⑤预后情况。对2组患者通过门诊和电话随访1年,随访率为100%。统计2组1年生存率。
1.5 统计学处理

2 结果
2.1 2组近期疗效比较
化疗结束后,实验组疾病控制率为91.67%(55/60),高于对照组的83.33%(50/60),差异无统计学意义(χ2=1.905,P=0.168),见表1。

表1 2组近期疗效比较/例
2.2 2组治疗前后T细胞亚群水平对比
治疗前,2组CD4+、CD8+、CD4+/CD8+水平比较,差异无统计学意义(P>0.05);治疗后,2组CD4+、CD4+/CD8+水平均低于治疗前,CD8+水平高于治疗前;其中,实验组的CD4+/CD8+水平高于对照组,差异有统计学意义(P<0.05),见表2。

表2 2组治疗前后T细胞亚群水平对比
2.3 2组血清肿瘤标志物水平对比
治疗前,2组血清CA153、CA125和CEA水平比较,差异无统计学意义(P>0.05);治疗后,2组CA153、CA125和CEA水平均低于治疗前;其中,实验组血清CEA水平均低于对照组,差异有统计学意义(P<0.05),见表3。

表3 2组血清肿瘤标志物水平对比
2.4 2组不良反应发生情况
2组骨髓抑制、周围神经毒性反应发生率比较,差异有统计学意义(P<0.05);2组胃肠道反应、肝肾功能异常、疲乏等不良反应发生率比较,差异无统计学意义(P>0.05),见表4。
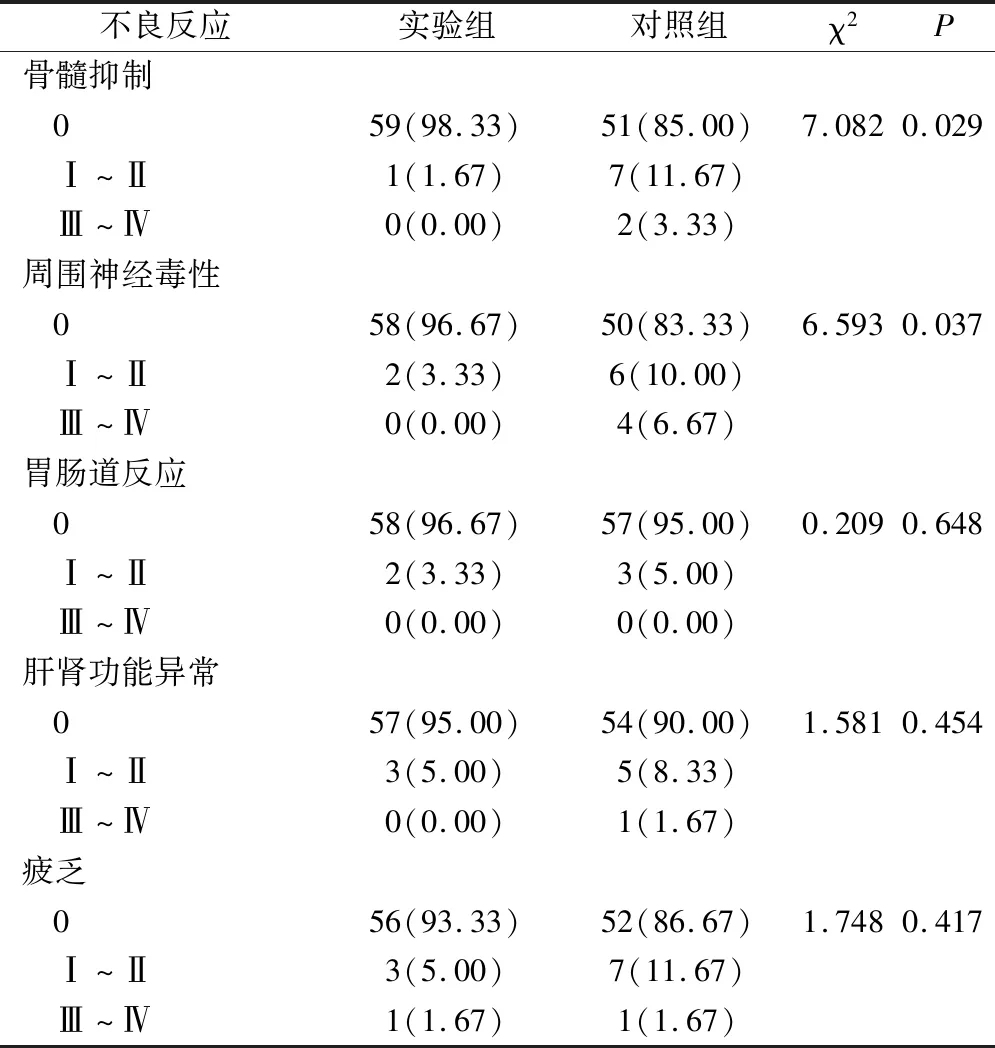
表4 2组不良反应发生情况(例,%)
2.5 2组预后情况比较
实验组1年生存率为80.00%(48/60),高于对照组75.00%(45/60),差异无统计学意义(χ2=0.430,P=0.512)。
3 讨论
中晚期卵巢癌的一线化疗药物包括紫杉醇和铂类药物的联合应用,骨髓抑制、肝肾脏毒性、神经毒性、过敏反应都是常见的不良反应,而一般较长期的化疗过程也会降低患者自身免疫力,导致其并发感染,在一定程度上影响了化疗的效果[9]。因此,应该重视对化疗患者健康器官、组织的保护。一项前瞻性研究比较了mFOLFOX6化疗、化疗联合氨磷汀对消化道肿瘤患者的治疗效果,结果发现联合氨磷汀可以降低血液不良反应、神经不良反应的发生,安全性较高[10]。姚艺玮等[11]的研究认为化疗前使用氨磷汀,可减少化疗药物对肝肾功能的损害。
目前,氨磷汀在卵巢癌患者的治疗中应用较少,本研究中,2组的疾病控制率相当,说明氨磷汀不会影响卵巢癌患者紫杉醇+卡铂化疗治疗的效果。血清肿瘤标志物在癌症的早期诊断、化疗疗效评估、预后预测方面具有广泛的应用,其中CEA为广谱肿瘤标志物,CA153主要用于乳腺癌、卵巢癌的诊断,CA125是判断卵巢癌患者的预后的主要指标之一[12-13]。本研究中,化疗治疗后3种标志物水平均有所降低,实验组血清CEA低于对照组,提示联合氨磷汀可以降低患者体内CEA水平,推测是因为氨磷汀保护机体正常细胞、减少化疗不良反应,有助于化疗过程的顺利进行。T淋巴细胞亚群是人体免疫功能的重要组成部分,主要由CD3+、CD4+、CD8+组成,CD4+T淋巴细胞可诱导和辅助细胞毒性T淋巴细胞发展成熟,同时增强B淋巴细胞的抗体,CD8+通过自身及抑制因子的作用,抑制抗体的形成,可负向调节免疫反应,因此CD4+/CD8+水平可以反映机体免疫功能的状态[14-15]。本研究中,实验组治疗后CD4+/CD8+水平高于对照组,提示联合氨磷汀的化疗治疗对卵巢癌患者的机体免疫功能影响更小,这可能与氨磷汀的细胞保护作用相关,具体可能通过以下途径进行:①WR-1065的自由巯基与铂类药物的活性代谢产物相结合,减少细胞毒性;②去除体内自由基;③预防细胞凋亡,保护健康细胞的正常功能。通过对患者化疗不良反应的统计,发现实验组患者出现Ⅰ~Ⅳ级骨髓抑制、周围神经不良反应的几率更小,与魏晓晨[16]和张蕾[17]等的研究结论一致,提示化疗治疗联合氨磷汀,可以提高卵巢癌患者的适应性,减少骨髓抑制、周围神经毒性反应的发生。本研究,2组1年生存率比较无差异,可能与本研究随访时间较短有关,有待继续延长随访时间,讨论多氨磷汀联合化疗治疗对卵巢癌患者中远期预后的影响。
综上所述,氨磷汀作为1种生物保护剂,联合化疗可减少卵巢癌患者骨髓抑制、周围神经不良反应的发生,显著改善肿瘤标志物、T淋巴细胞亚群水平。

