分子标记鉴定EMS 诱变高粱突变体的真伪
王春语 李政君 陈冰嬬 张丽霞
(1.辽宁省农业科学院高粱研究所,辽宁 沈阳 110161;2.辽宁省农业科学院农作物海南育种中心,海南乐东 572541;3.吉林省农业科学院作物资源研究所,吉林 公主岭 136100)
随着诱变育种技术的不断发展,诱变育种在高粱中逐渐兴起[1]。早在1970 年就利用X-射线、γ-射线、EMS(Ethylmethylsulfone,甲基磺酸乙酯)、MMS(Methyl Methanesulfonate,甲基磺酸甲酯)、DES(Diethyl sulfate,硫酸二乙酯)和NEU(N-Ethyl-N-nitrosourea,N-乙基-N-亚硝基脲) 诱变3 个栽培高粱品种,对其诱变率进行了比较研究,结果表明EMS 是最有效的诱变剂[2]。近几年,EMS 也在高粱诱变育种中得到广泛应用,分别以粒用高粱BTx623、恢复系晋粱 5 号和保持系V4B 等为实验材料,成功获得了叶色、矮化、叶形、分蘖、穗型、成熟期、早衰等不同的突变体[3,4]。另外,从1 600 个单株的高粱EMS 诱变群体中筛选出768 个突变体,并利用Tilling 技术在该突变体库中筛选出了编码咖啡酸甲基转移酶基因的2 个突变体[5]。
EMS 诱变处理随着处理时间的延长和处理浓度的增加,高粱种子发芽率和成苗率逐渐降低,即使正常出苗对后期营养生长和生殖生长都会产生很大的影响,如植株矮化、叶片皱缩、花期延迟和育性降低等[3~4,6,7]。EMS 处理后,M0代植株单穗结实率是非常重要的指标之一,结实率过高增加筛选压力且影响诱变效率;结实率过低种子数量过少而造成后代筛选鉴定的困扰,限制了突变体的数量。M0代诱变处理种子由于数量大通常采用开放授粉的方式进行加代繁种,容易接受周围其它高粱材料花粉而杂交出现假突变体的可能,因此,有必要开发一套实用的分子标记鉴定EMS 诱变突变体的真伪。
本研究基于26 份高粱材料的重测序数据,开发了大量≥3 bp 重复的SSR 分子标记。通过对分子标记有效性和丰度检测,选择PCR 扩增目标条带较单一、多态性丰富的30 个标记用于EMS诱变突变体真伪的鉴定。
1 材料与方法
1.1 实验材料
5 个RIL 群体株系分别为:10S008、10S242、9G008、9G015 和4WY006,其中10S008 和10S242均为BTx623 和Rio 杂交构建RIL 群体的2 个株系;9G008 和9G015 均为BTx623 和L316(中国农家种)杂交构建RIL 群体的2 个株系;4WY006 为BTx623 和13-9(高粱微核心种质)杂交构建RIL群体的1 个株系。5 个已知突变体(5M192、4A550、A129、A108 和ZY1)均为BTx623 经EMS诱变获得的突变体,5M192 和4A550 为蜡层缺失突变体,A129 和A108 为叶色突变体,ZY1 为叶型突变体,均为实验室已经定位或者克隆基因的突变体。5 个新筛选突变株3T133、4A317、2E52、4A478 和4A211 均为2019 年筛选获得的与亲本BTx623 存在表型差异的EMS 诱变株系。
30 份高粱微核心种质来自国际半干旱研究所,其中包括世界不同地区的农家种和栽培种。
粒用高粱BTx623,辽糯3 由辽宁省农业科学院高粱研究所提供。
以上实验材料均由辽宁省农业科学院高粱研究所分子改良实验室保存。
1.2 实验方法
1.2.1 SSR 分子标记开发
为了开发更多有效的高粱SSR 分子标记,本课题组对14 份不育系和12 份恢复系高粱材料进行10×重测序后开发SSR 分子标记[8]。开发SSR分子标记的标准为:2 bp 重复次数≥6 次、3 bp 重复次数≥5 次、4 bp 重复次数≥4 次、5 bp 重复次数≥3 次以及6 bp 重复次数≥3 次,重测序、数据分析及SSR 分子标记开发均由北京普朗泰科生物科技有限公司完成。
1.2.2 PCR 扩增体系及程序
PCR 反应体系总体积为20 μl,包括2×EasyTaq®PCR SuperMix (+dye) 10 μl,正向引物F 0.3 μl,反向引物R 0.3 μl,DNA 1 μl (≤100 ng)和ddH2O 8.4 μl。PCR 反应程序:95 ℃ 3 min,95 ℃ 30 s、58 ℃ 30 s、72 ℃ 30 s(35 cycles),72 ℃ 10 min。2×EasyTaq®PCR SuperMix (+dye)(货号:AS111-11)购买于北京全式金生物技术有限公司,引物由南京金斯瑞生物科技有限公司合成。
1.2.3 聚丙烯酰胺凝胶电泳
玻璃板用酒精擦洗干净,并用密封胶条、夹子和垫片将玻璃板固定好。将8 ml 30%丙烯酰胺预制胶(上海迪申生物技术有限公司,货号:B1610156)、4 ml 5×TBE 溶液、27.5 ml 蒸馏水、450 μl 10%过硫酸铵和50 μl TEMED(四甲基乙二胺)充分混均迅速灌入装好的玻璃板中,插上梳子,室温放置15 min 以上,配置成6%聚丙烯酰胺凝胶。将制备好的胶板放置于已经加入1×TBE 缓冲液的垂直电泳槽中,每个PCR 扩增样品上样1.5 μl,130 V、电泳40 min~1 h 后关闭电源。取胶,放入硝酸银染色液(0.5 g AgNO3充分溶于500 ml 蒸馏水)染色15 min,用蒸馏水冲洗染色后的胶3 次,然后放入显影液(10 g NaOH、0.2 g 碳酸氢钠充分溶于500 ml 蒸馏水中,再加入5 ml 甲醛混均,现用现配),轻摇至胶显出清晰的条带为止。照相,存储,记录、分析数据。
2 结果与分析
2.1 SSR 分子标记开发
基于26 份高粱材料的重测序数据以及SSR分子标记开发标准,共开发了24 441 个SSR 标记,其中2 bp 重复共有11 051 个,≥3 bp 重复的共有13 390 个(图1)。
为了便于聚丙烯酰胺凝胶电泳检测以及分析,选择≥3 bp 重复的SSR 多态标记用于本研究。分别选择100 个位于基因上和100 个位于非基因上的SSR 标记,以BTx623 和杂交种辽糯3为材料检测标记的有效性。其中,位于基因上的7 个标记以及位于非基因上的4 个标记在两份材料中无扩增条带,判定为无效标记(图2)。
因此,基因上和非基因上共有189 个SSR 分子标记PCR 可以有效扩增目标条带,分子标记开发成功率达到94.5%。
2.2 SSR 分子标记鉴定
为了检测SSR 分子标记的丰度,随机选择30份高粱微核心种质材料检测189 个标记在自然群体材料中的多态性。选择多态性≥2 的标记作为检测备用标记,符合此标准的基因上共有19 个标记,非基因上共有51 个标记(图3)。
为了提高标记鉴别能力以及实用性,从70 个标记中选择PCR 扩增目标条带较单一、多态性差异大、且便于聚丙烯酰胺凝胶电泳分析的30 个标记用于EMS 突变体真伪鉴定。30 个标记每条染色体平均分布3 个,其中3 个标记位于基因上,27个标记位于非基因上(表1)。
以基因上标记Chr8-3 为例,该标记在30 份自然群体材料中共有3 种多态类型,分别为I 型、II 型和III 型(图4);而非基因上标记Chr1-12 在30 份自然群体材料中共有8 种多态类型,分别为I 型、II 型、III 型、IV 型、V 型、VI 型、VII 型和VIII型(图5)。
2.3 SSR 分子标记验证
EMS 诱变后代通常采用开放授粉,易接受其它高粱材料花粉后杂交产生假突变体的可能性。选择5 个其他高粱材料和BTx623 杂交后获得的RIL 群体株系以及5 个BTx623 经EMS 诱变后获得的已知突变体验证30 个标记的有效性及鉴别能力。5 个不同RIL 群体株系与亲本BTx623 相比,PCR 扩增目标条带差异很大。10S008、10S242、9G008、9G015、4WY006 与BTx623 相比,30 个标记中存在差异的标记分别为10、11、12、10和9 个(图6)。而BTx623 经EMS 诱变后5 个已知突变体 A129、ZY1、A108、5M192、4A550 与BTx623 相比,30 个标记PCR 扩增条带无差异(图7)。
由此可见,本研究开发、筛选的30 个标记可以用于突变体真伪的鉴定。
2.4 EMS 诱变突变体鉴定
利用上述30 个SSR 分子标记鉴定2019 年新筛选到的有明显表型差异的株系是否为BTx623经EMS 诱变后获得的突变体。
3T133、4A317 和2E52 经PCR 扩增后,电泳结果显示30 个标记目标条带大小与亲本一致,为BTx623 经EMS 诱变后获得的突变体(图7)。4A478 和4A211 经PCR 扩增后,分别有6 个和5个标记PCR 扩增条带大小和BTx623 存在差异。经过田间表型调查,BTx623 叶主脉为蜡脉且无芒,而4A478 和4A211 为白脉、且存在无芒、有芒植株分离,因此,判定4A478 和4A211 为假突变体(图8)。
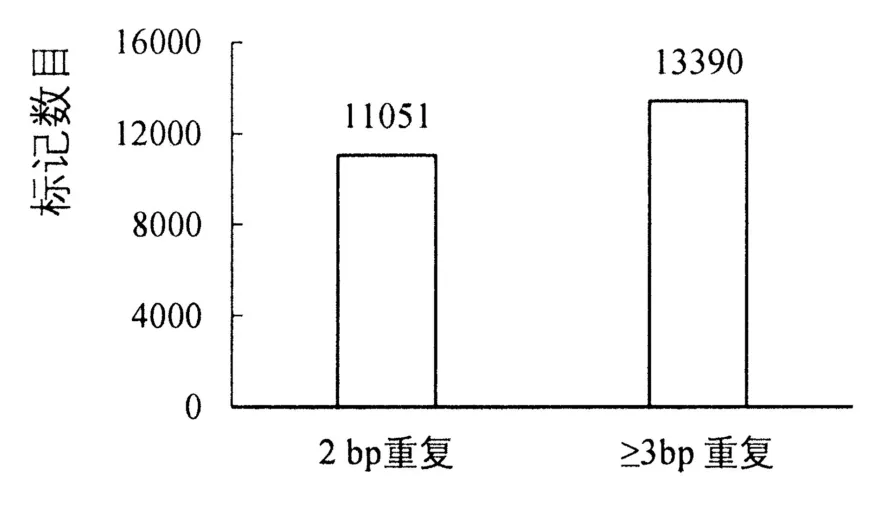
图1 SSR 分子标记种类及数量Figure 1 Types and numbers of SSR molecular markers
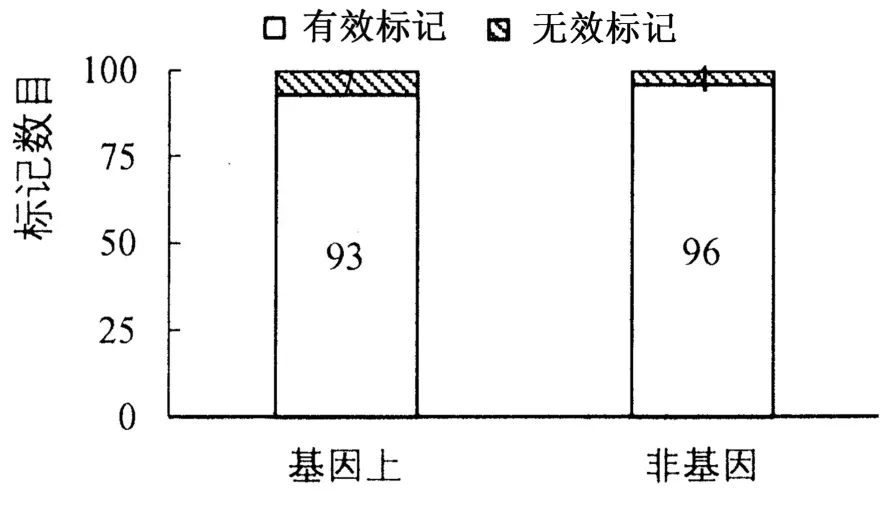
图2 基因上和非基因上200 个SSR 分子标记有效性检测Figure 2 Effectiveness detection of 200 SSR molecular markers on genes and non-genes
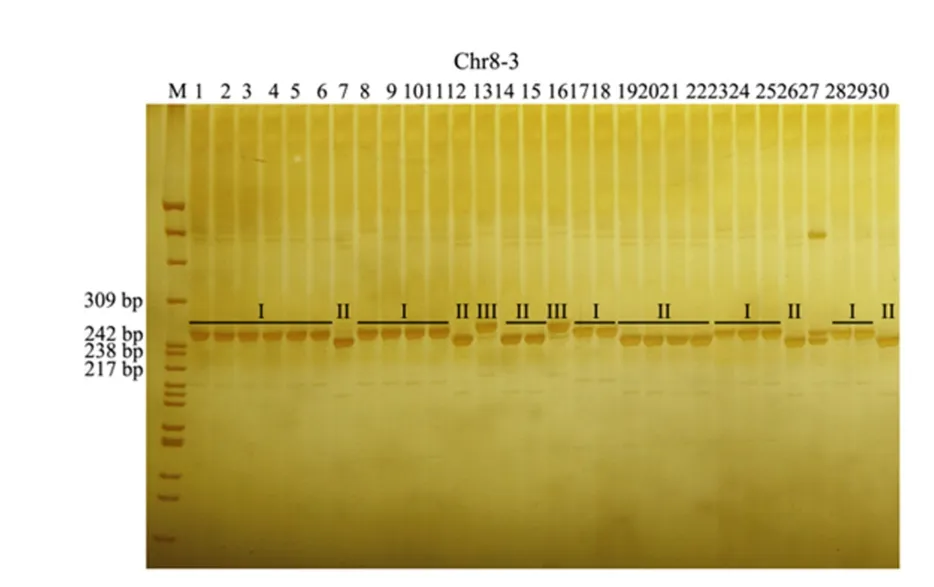
图4 基因上Chr8-3 标记多态性检测Figure 4 Polymorphism detection of Chr8-3 marker on gene
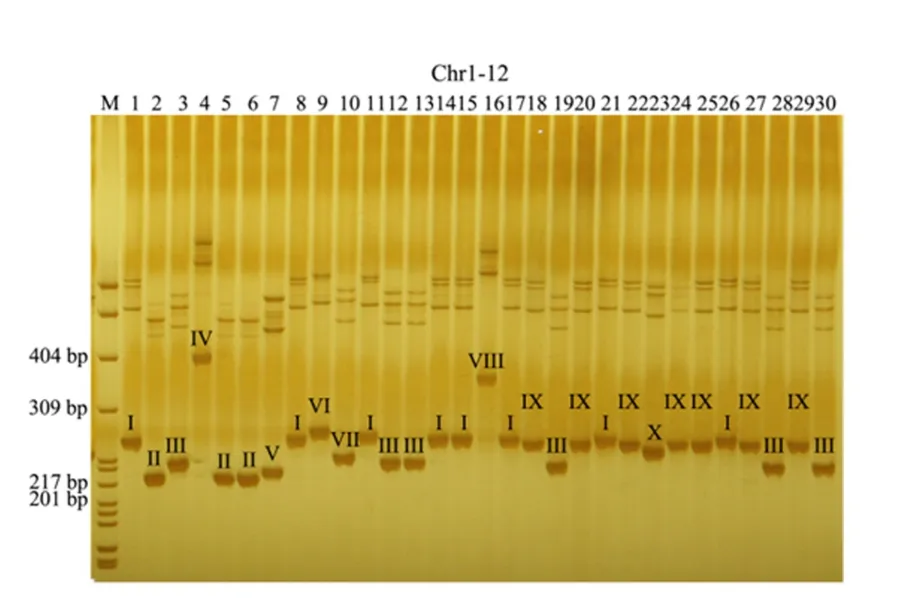
图5 非基因上Chr1-12 标记多态性检测Figure 5 Polymorphism detection of Chr1-12 marker on non-gene

图6 6%聚丙烯酰胺凝胶电泳检测BTx623 与5 个RIL 群体株系30 个SSR 分子标记的差异Figure 6 Differences of 30 SSR markers between BTx623 and 5 RIL lines detecting by 6% polyacrylamide gel electrophoresis
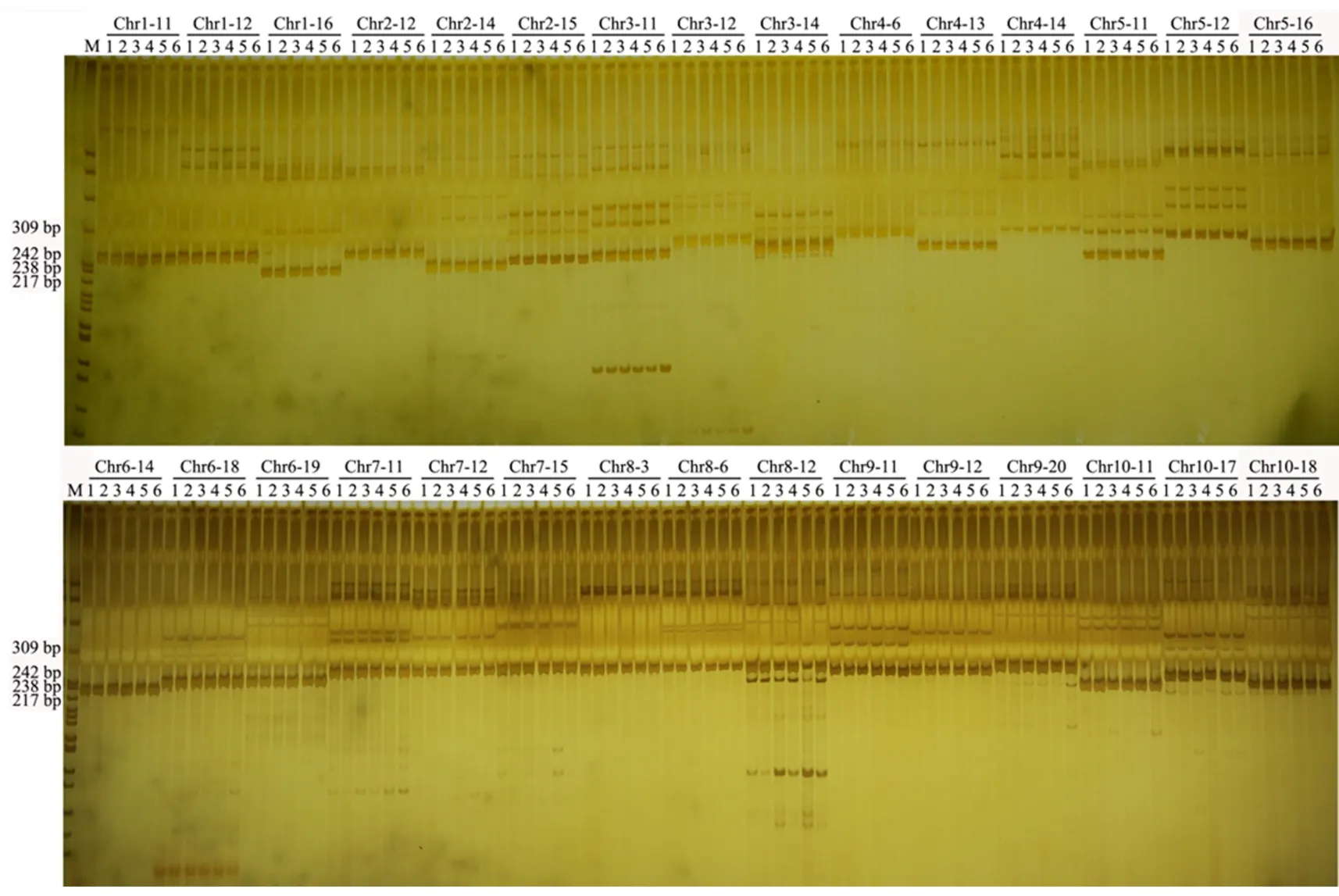
图7 6%聚丙烯酰胺凝胶电泳检测BTx623 与5 个已知EMS 突变体30 个SSR 分子标记的差异Figure 7 Differences of 30 SSR markers between BTx623 and 5 known EMS mutants detecting by 6% polyacrylamide gel electrophoresis

图8 6%聚丙烯酰胺凝胶电泳检测BTx623 与5 个新筛选EMS 突变体30 个SSR 分子标记的差异Figure 8 Differences of 30 SSR markers between BTx623 and 5 newly screened EMS mutants detecting by 6% polyacrylamide gel electrophoresis
3 结论与讨论
EMS 诱变剂处理浓度和处理时间对M0代种子的萌发率、出苗率、植株长势以及结实率都有较大的影响。高粱材料不同,EMS 处理时间和浓度也不同[3,7]。综合考虑M0代处理种子的出苗率、结实率和突变效率,对于粒用高粱BTx623 采用0.2% EMS 处理20 h 后,结实率为15.3%[3]。随着EMS 处理浓度和处理时间的增加,M0代植株的结实率显著较低,其中对花粉活力的伤害更大,柱头更容易接受外来花粉。为了保证诱变后种子的纯度,我们尝试M0代植株全部套袋自交,结果导致结实率更低、甚至不结实(数据未发表)。为了保证M0代植株正常结实通常种植于隔离区开放授粉,但是由于M0代植株花粉活力受损以及高粱是常异花授粉作物,即使这样仍然存在和其他高粱材料杂交的可能。当筛选到差异表型植株时,有必要鉴定这些植株是来自杂交还是诱变。
两个不同高粱材料杂交,由于染色体大片段交换,即使多代自交成为RIL 群体株系,与亲本相比,分子标记检测后不同株系之间差异很大。如10S008 和10S242 是BTx623 与Rio 杂交获得的2个RIL 群体株系,与亲本BTx623 相比,30 个分子标记中存在差异的标记分别为10 个和11 个(图6)。然而BTx623 经EMS 诱变获得的突变体则不同,30 个标记在不同突变体中PCR 扩增条带均与亲本一致(图7、图8)。
选择PCR 扩增条带单一、多态性丰富、且不同材料间片段差异大的分子标记更利于聚丙烯酰胺凝胶电泳结果分析、统计。由于基因在不同材料间的保守性,开发分子标记数量有限。基于26份高粱材料的重测序数据共开发了24 441 个≥2 bp 重复的SSR 分子标记,其中位于单拷贝基因(含编码区、UTR区、内含子区和启动子上下游2 kb)内共有6 733 个[8]。本研究筛选到的30 个SSR 分子标记,3 个标记位于基因上,27 个位于非基因上(表1)。位于基因上的标记往往多态性差、鉴别能力低,但是PCR 扩增目标条带较为单一利于分析(图4)。然而位于非基因上的标记,PCR 扩增非目标条带较多,但是多态性丰富,鉴别能力强(图5)。
EMS 诱变通常产生单碱基突变[9,10],但是也会造成单碱基、多碱基缺失,碱基缺失的概率一般不会超过高粱基因组大小的2%(数据未发表)。因此,适宜用SSR 分子标记的方法鉴定EMS 诱变突变体的真伪。利用30 个标记检测,如果是杂交后产生的假突变体,与亲本存在差异的标记数目通常较多(图6)。倘若与亲本相比,只有1 个标记存在差异,该突变体的真假还需要进一步验证。
本研究基于26 份高粱材料的重测序数据,经过对分子标记有效性以及多态性鉴定,筛选到≥3 bp 重复的30 个SSR 分子标记用于EMS 突变体真伪鉴定。

