微波一步固化脱水多花黄精切片的植物化学成分、水分状态及形态研究
李芷芊,李占明,*,吴雨凌,俞 玥
(1.新加坡国立大学苏州研究院,江苏苏州 215000;2.江苏科技大学粮食学院,江苏镇江 212100)
多花黄精是一种著名的药用和食用植物,具有延缓衰老、调节免疫力、降血糖血脂、抑菌抗炎等功效[1,2]。除此之外,黄精在食品领域中亦得到广泛应用。将黄精提取液添加至各种不同食材中,经发酵制成黄精酸奶,或经过简单混合制成富含黄精多糖的黄精饼干、黄精五仁饼、黄精膏、黄精酸奶、黄精酸豆奶、黄精饮料等富含黄精多糖的健康食品[3]。
干燥是常见的加工方法,能有效地减少水分含量,延长其贮藏期。常用的干燥方法主要有红外干燥、热风干燥、热泵干燥、冷冻干燥等。近年来,微波技术已广泛应用于蒸煮、干燥、漂白、杀菌等食品加工领域,与传统的热风干燥工艺相比,微波干燥具有更多的优点[4]。如能有效解决传统方法易导致变形且水分流失过多的现象,具有收缩率低、干燥效率高、节能等优点[5-6]。已成功应用于芹菜、苹果、蘑菇、大蒜等农产品的干燥,干燥效果良好[7-10]。将黄精切片干燥是黄精加工的常见方法,可有效保障多花黄精切片的品质。黄精切片在干燥过程中,水分受到强烈刺激,获得更高的能量,然后从物质中蒸发[11]。在此期间,水分与干物质之间的存在形式发生了较大的变化。在干燥过程中,物料内部水分的变化直接影响物料的干燥速度和干燥产品的质量,这对研究物料的干燥特性具有重要意义[12]。核磁共振技术是非侵入性、非破坏性的,能够很好地观察物料内部水分状态的一类新型技术,因此在食品领域得到了广泛的应用。低场核磁共振(LF-NMR)是一种新的水态分析技术,该技术通过测量LF-NMR 中的弛豫时间,可以描述水分子的运动和水分的存在状态[13]。
本实验以多花黄精切片为对象,采用LF-NMR 成像技术,从微观角度检测干燥过程物料中水分的流动性和水分的分布情况,测定了微波干燥后多花黄精的颜色变化、总酚含量和抗氧化性,并利用扫描电镜表征黄精切片干燥后的微观结构变化[14]。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
新鲜多花黄精于2020 年12 月30 日采集,采集地为福建省龙岩市。
1.1.2 试剂
没食子酸、氯化铁、冰乙酸(阿拉丁);无水乙醇(Enox);无水碳酸钠(BBI Life Science);福林酚(艾科);2,4,6-三(2-吡啶基)三嗪(TPTZ)(麦克林);盐酸(润捷化学);1,1-二苯基-2-三硝基苯肼(DPPH)(麦克林)。
1.2 仪器与设备
DHG-9015A 鼓风干燥机,上海一恒科学仪器有限公司;微波炉,广东格兰仕微波炉电器制造有限公司;Quanta250环境扫描电子显微镜,美国FEI;NMI20-060H-I 核磁共振成像分析仪,苏州纽迈分析仪器股份有限公司;XD-3000A 旋转蒸发仪,上海贤德实验仪器有限公司;YS3010 测色仪,美国3NH。
1.3 方法
1.3.1 材料准备
制备新鲜多花黄精切片,切片厚度约为5 mm,并于4 ℃下保存备用。
1.3.2 干燥工艺
(1)热风干燥工艺
传统加工方法参照《中华本草》[16]。其处理方法分为固化干燥和未固化干燥,固化过程有蒸法和漂烫法两种。每组样品为30 g 黄精切片,用蒸汽分别蒸三组样品10、20、30 min。另一组样本在沸水中漂烫20 min,冷却样品,然后把样品放入60 ℃的热风干燥箱[17]。未固化干燥则是新鲜样品样品不需经过处理,直接放入60 ℃的热风干燥箱进行干燥。第1 组:蒸10 min 后热风干燥;第2组:蒸20 min 后热风干燥;第3 组:蒸30 min 后热风干燥;第4 组:热水漂烫后热风干燥;第5 组:未固化热风干燥。
(2)微波干燥工艺
第6 组:微波干燥。新鲜黄精切片在微波干燥装置中进行干燥,功率为120 W。得到干燥前后样品的质量后,使用公式(1)测量黄精中水分含量。

式中,Wt-含水率,g/g 干质量;t-干燥时间,min;Mt-新鲜物料质量,g;M0-干燥后物料质量,g。
1.4 颜色测试
采用YS3010 测色仪(美国3NH)测定鲜黄精、热风干燥黄精和微波干燥黄精的色泽。L(亮度)、a*(红-绿)和b*(黄-蓝)是反射测量的参数[17]。颜色的变化根据公式(2)来计算。
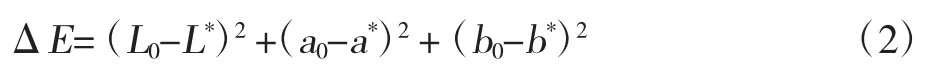
1.5 LF-NMR 测量
使用低频核磁共振分析仪测量LF-NMR 值。仪器采用0.5 T 永磁体,质子共振频率为21 MHz。对黄精样品采用脉冲序列获得了质子衰变信号。90°和180°的脉冲宽度时间分别为5.52 μs 和10.00 μs。仪器设置为0.4 ms(回波时间)、8 000 ms(等待时间),并进行8 次重复扫描,从15 000 个回波中获取数据。使用MultiExp Inv Analysis 软件(苏州纽迈分析仪器股份有限公司)对水的弛豫时间(T2)和信号振幅的面积进行分析[17]。
1.6 MRI 核磁共振成像
序列参数设置:重复时间TR=800 ms,回波时间TE=16.13 ms,视野FOV=256 mm,切层厚度为5 mm;将样品放入核磁管中,然后置于磁场中射频线圈的中心位置。采用自旋回波脉冲序列获得黄精切片的质子密度图。
1.7 扫描电镜分析
在处理后的样品顶部采集1 mm 厚的切片,放置在一个扫描电镜置物台上,喷涂一层铂。所有样品均在加速电压为25.00 kV 的高真空条件下进行检测,表征其微观结构。
1.8 总酚含量的测定
1.8.1 没食子酸标准曲线
准确称取13 mg 没食子酸对照品,置于50 mL 容量瓶中,加入20 mL 70%乙醇充分溶解后,定容至50 mL,摇匀备用。将0、20、40、60、80、100、120、140、160、200 μL的参比溶液分别精确抽取到5 mL 容量瓶中,然后加入3.2 mL 蒸馏水和200 μL 福林酚参比溶液。摇匀后静置6~8 min,加入500 μL、15%Na2CO3溶液。摇匀,室温避光2 h,测定波长765 nm 处的吸光度。以参比物浓度为横坐标,吸光度为纵坐标,绘制标准曲线[18]。
1.8.2 总酚含量的测定
准确称取黄精粉1g 放入试管中,加入70%乙醇10mL,用250 W、40 kHz 超声提取30 min,过滤后取滤液,重复提取3 次。旋转蒸发后用70%乙醇稀释至1 mL。准确提取40 μL,按1.8.1 中的方法测定黄精总酚含量。
1.9 抗氧化活性
1.9.1 铁还原抗氧化能力的测定(FRAP 法)
在酸性条件下,利用抗氧化剂还原Fe3+-TPTZ 生成蓝色Fe2+-TPTZ,然后在593 nm 处测量蓝色Fe2+-TPTZ的量。通过比较获得样品的总抗氧化能力。
FRAP 工作溶液的配制:配制0.3 mol/L 醋酸缓冲溶液(pH 3.6)、0.01 mol/L TPTZ(2,4,6-三(2-吡啶基)三嗪)、0.04 mol/L 盐酸溶液、0.02 mol/L 氯化铁溶液,三种溶液以10∶1∶1 的体积比混合,加热至37 ℃,待用[19]。
Trolox 抗氧化剂:准确称取0.01 g 维生素E 于50 mL容量瓶中,用70%乙醇溶解后稀释定容,浓度为500μg/mL。然后将其稀释成50、100、150、200、250、300 μg/mL 的标准溶液备用。将上述标准溶液5 μL 加入150 μL TPTZ 溶液中,37 ℃反应10 min,在593 nm 处测定吸光度,绘制标准曲线。样品与Trolox 抗氧化剂测定条件相同,对照组为70%乙醇。
1.9.2 DPPH 自由基清除率的测定
测定方法参照文献[19],先配制0.2 mmol/L DPPH 无水乙醇溶液,室温避光保存备用。然后取20 μL 黄精多酚溶液于96 孔板中,再分别加入0.2mmol/LDPPH 溶液180μL。室温下放置30 min 后,以70%乙醇为对照组,在517 nm波长处测定吸光度A0;然后测定0.2 mmol/L DPPH 180 μL溶液与20 μL、70%乙醇混合物的吸光度A1。平行测定3次,计算平均值,然后计算吸光度和清除率。VC 将用作标准的抗氧化剂。DPPH 自由基清除率的计算公式见式(3)。
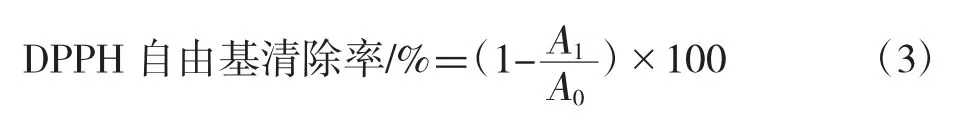
2 结果与分析
2.1 不同干燥工艺对总酚含量(TPC)的影响
如表1 所示,热风干燥条件下蒸熟样品的干燥时间最长(13~15 h),干燥后样品的最终含水量约为4%~5%,未固化热风干燥样品的干燥时间为(10 h),干燥后样品的最终含水量约为5%。第1 组、第2 组和第3 组的样品分别蒸10、20、30 min,其中蒸20 min 后的样品的TPC 值最高,说明了蒸适当的时间可以提高多酚的含量。用120 W 微波干燥黄精切片,定期观察干燥时间和水分含量。相比之下,微波干燥(0.5 h)比传统的热风干燥(8~15 h)快。
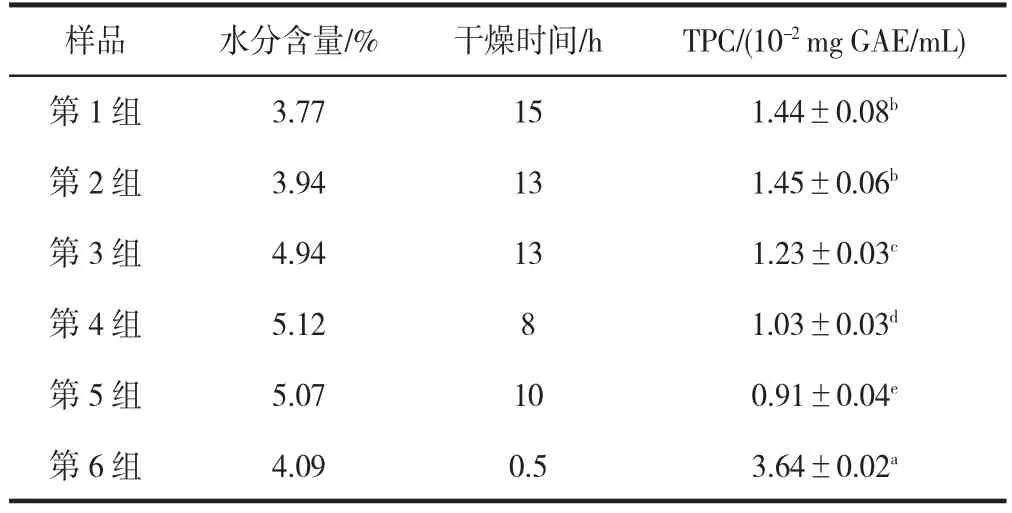
表1 不同干燥工艺对总酚含量的影响Table 1 Effect of different drying processes on total polyphenol content
表1 也显示了不同干燥方式对黄精切片TPC 的影响。蒸后热风干燥的样品总酚含量高于漂烫后热风干燥和未固化热风干燥的样品,说明蒸处理提高了提取过程中黄精多酚类物质的回收率。这与张中义等[20]关于蒸汽处理后大蒜TPC 含量的测量的结果一致,表明蒸处理可以提高多酚的回收率。与传统的热风干燥工艺相比,微波干燥后黄精的TPC 值最高。王红利等[21]也发表了关于甘蓝的类似报道,即与热风干燥相比,微波干燥的白菜多酚含量最高。微波干燥能更好地保留多酚,可能是多酚氧化酶分解多酚的能力在高温条件下不可逆地受到抑制甚至失活,从而减少了多酚的氧化,积累了黄精中总酚的含量[22]。也有研究表明,干燥时间也会对多酚含量产生直接影响[23]。
可见,与微波干燥相比,热风干燥需要更长的干燥时间,干燥时间越长,多酚氧化酶作用时间越长,黄精多酚的相对损失越大。此外,微波加热可使细胞内的温度迅速上升,液态水蒸发产生的压力在细胞膜和细胞壁上形成小孔,促进胞内物质的释放[24]。
2.2 不同干燥工艺对黄精颜色的影响
黄精干燥样品和鲜黄精切片的表面颜色(ΔE)变化见表2。第3 组颜色变化最大(38.35±0.17),其次是第2组(38.11±0.41)和1 组(36.49±0.24)。第4 组表面颜色的变化(ΔE=28.24±0.60)小于第3 组、第2 组和第1组。微波干燥样品的表面颜色变化最小(16.05±0.18)。与其他方法干燥的样品相比,第6 组样品表面的两个颜色参数(L*、a*)与新鲜样品的差异最小。这些结果与秦樱瑞[25]所报道的新鲜桑叶微波干燥比热风干燥颜色变化小的结论一致。微波干燥将介质加热过程中植物基质内部的水推到表面,由于表面温度接近,水分立即蒸发,可以防止表面过热,而这通常是干燥过程中颜色发生变化的主要原因。
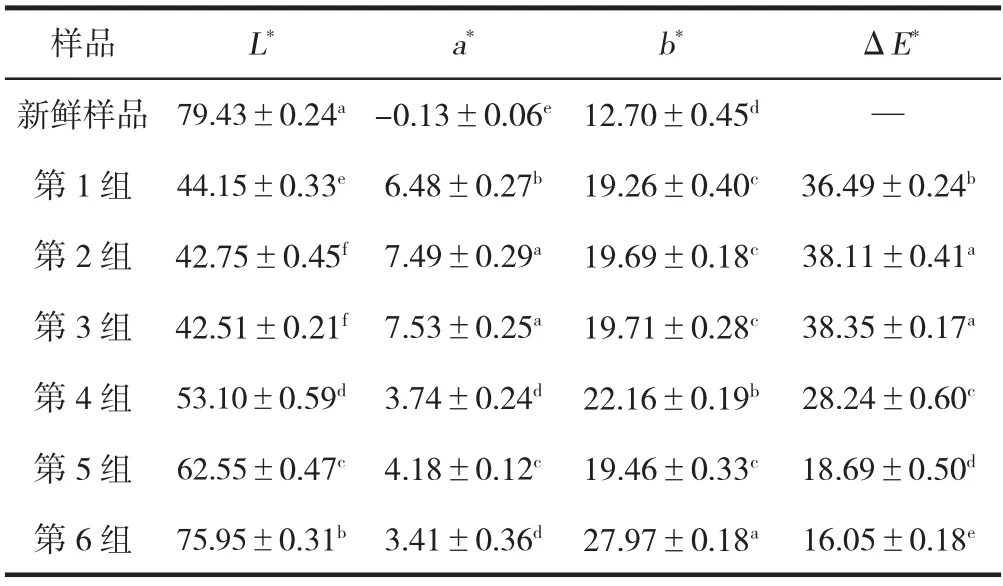
表2 不同干燥方法对黄精颜色的影响Table 2 Effect of different drying methods on the color of Polygonatum cyrtonema Hua
2.3 抗氧化性
当体内的抗氧化能力低于氧化水平时,形成自由基的积累,机体处于氧化应激状态,从而导致衰老和某些疾病[26]。多酚类抗氧化剂可以通过提供供氢体、螯合金属离子等抑制氧化反应。由于氧化是一个相对复杂的过程,抗氧化活性不能仅用一种方法来评价[27]。
在测定抗氧化性的方法中,FRAP 法和DPPH 是常用的测定方法。FRAP 法是基于氧化还原反应,其中Trolox 抗氧化剂当量用于反映总抗氧化能力。DPPH 在有机溶剂中是一种稳定的自由基,在乙醇溶液中呈紫色。与自由基清除剂反应后,颜色变浅,抗氧化能力可以用清除率来表示[15]。两种抗氧化方法均能客观地反映黄精对不同自由基的清除能力。本试验采用DPPH 法和FRAP 法测定黄精总抗氧化能力,探讨不同干燥方式对黄精抗氧化活性的影响。
2.3.1 DPPH 自由基清除率测试
由图1 中可知,用各种不同的干燥方法进行处理的黄精DPPH 自由基清除率是截然不同的,蒸10 min 后热风干燥为59.574%,漂烫后热风干燥为45.084%,未固化热风干燥为40.220%,微波干燥为72.801%。
可见,蒸后的黄精对DPPH 自由基的清除能力高于热风干燥后的黄精,这可能是因为黄精中的多酚成分在热处理条件下更容易从结合多酚释放为游离多酚,从而提高了对DPPH 自由基的清除能力。由图1 可知,微波干燥后DPPH 自由基清除率最高,所以黄精微波干燥后清除自由基的能力显著高于其他干燥方法[28]。
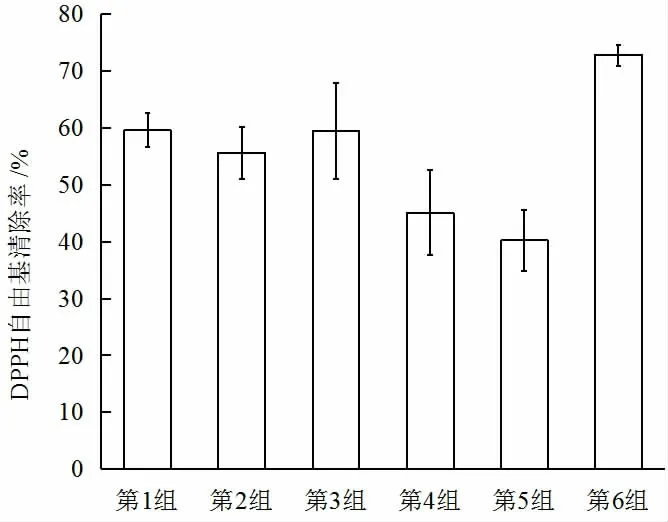
图1 DPPH 自由基清除能力Fig.1 DPPH free radical scavenging ability
2.3.2 铁还原抗氧化能力的测定(FRAP 法)
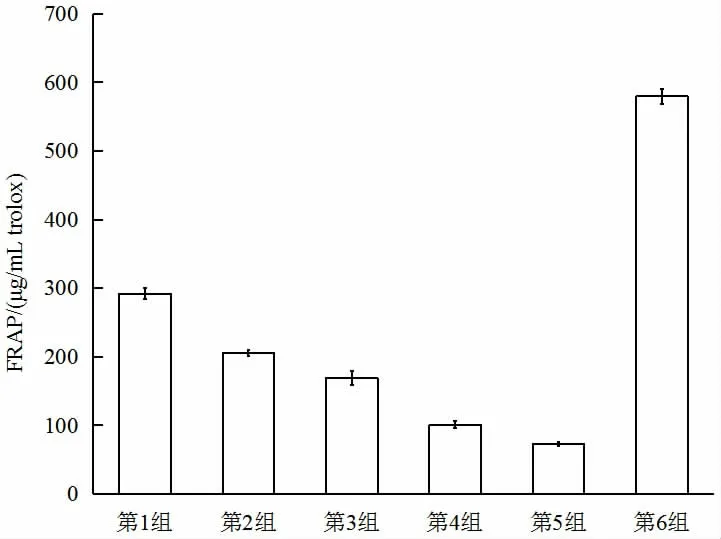
图2 不同干燥方式对Fe3+还原能力的影响Fig.2 Effects of different drying methods on Fe3+reducing ability
根据1.9.1 的方法测定Trolox 标准抗氧化溶液,得到抗氧化性在0~300 μg/mL 范围内呈线性关系,标准曲线的回归方程为Y=0.002 4x+0.185(R2=0.998 9)。
不同黄精干燥样品的FRAP 抗氧化能力排序为微波干燥>蒸10 min 后热风干燥>蒸20 min 后热风干燥>蒸30 min 后热风干燥>热水漂烫20 min 后热风干燥>未固化热风干燥。微波干燥能较好地反映黄精的抗氧化能力,这可能是因为微波干燥可更好地保留黄精中对抗氧化能力起作用的活性物质[29]。
2.4 微波干燥黄精切片的LF-NMR 分析
从图3 可以看出,在整个微波干燥过程中,随着干燥时间的延长,黄精切片质子弛豫时间(T2)和信号振幅呈下降趋势。弛豫时间T2 与含水量密切相关,水分子与其他组分之间的相互作用也是引起质子弛豫过程变化的重要因素。
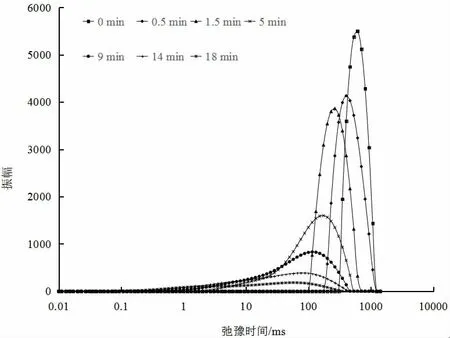
图3 黄精在微波干燥过程中的水分状况Fig.3 The status of water in Polygonatum cyrtonema Hua during microwave drying
在干燥初期,黄精中游离水含量较高,由于游离水流动性好,不受大分子物质束缚,黄精在干燥初期表现出较长的弛豫时间T2。干燥一段时间后黄精的游离水含量显著降低。同时,干燥使其内部结构发生变化,释放碳水化合物等组分,降低了水的流动性,导致松弛时间缩短。在干燥后期,黄精中主要是结合水,它们与蛋白质、多糖等大分子物质通过氢键紧密结合,松弛时间短。因此,T2 弛豫时间的变化可以间接反映微波干燥过程中水态和组织结构的变化[30]。
2.5 黄精切片微波干燥过程中的MRI 图像变化
通过MRI 技术获得黄精在干燥过程中的图像变化(图4),其中红色代表高水分,黄色代表低水分,绿色代表最少水分。磁共振成像显示黄精在干燥过程中水分含量由内向外逐渐降低。14 min 时黄精图像逐渐模糊,说明内部水分含量和状态发生了变化,内部自由水消失,只剩下少量结合水。随着干燥时间的延长,内层和内部组织的水分浓度在18 min 时被破坏,达到干燥的临界点,水分含量过低导致图像模糊。
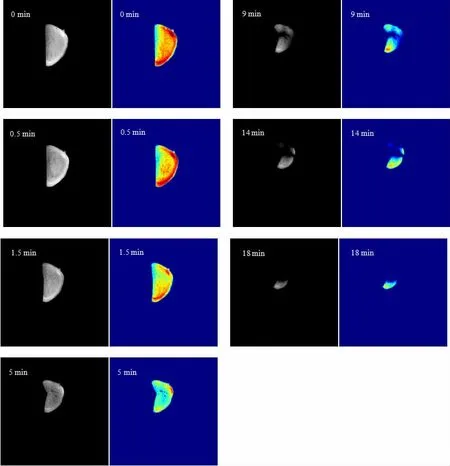
图4 新鲜黄精切片微波干燥过程的MRI 成像Fig.4 MRI image of fresh Polygonatum cyrtonema Hua slice during microwave drying
2.6 扫描电镜分析
材料的微观结构反映了在干燥过程中材料的结构是否保持良好,也是材料质量的参考指标[31]。采用扫描电镜分析干燥对组织完整性和孔网的影响。从图5 可以看出,黄精组织内部呈规则的蜂窝状结构。这种结构具有较强的机械性能和防护性能,使材料在干燥过程中始终保持良好的刚性,不易发生严重变形。图5中A-H 与I、J 的对比反映了蒸对热风干燥过程的影响。未固化的黄精在热风干燥后表现出明显的蜂窝状结构,而蒸后的黄精微观结构表现出严重的组织收缩、细胞塌陷和收缩变形,表明蒸加热过程对材料的组织结构造成破坏。通过扫描电镜观察,发现微波干燥黄精的微观结构变化大于热风燥。微波干燥黄精的微观结构略有收缩,并伴有少量微裂纹和细胞壁破裂;而未固化热风干燥的产物组织结构最好,收缩轻微,细胞结构基本完好。
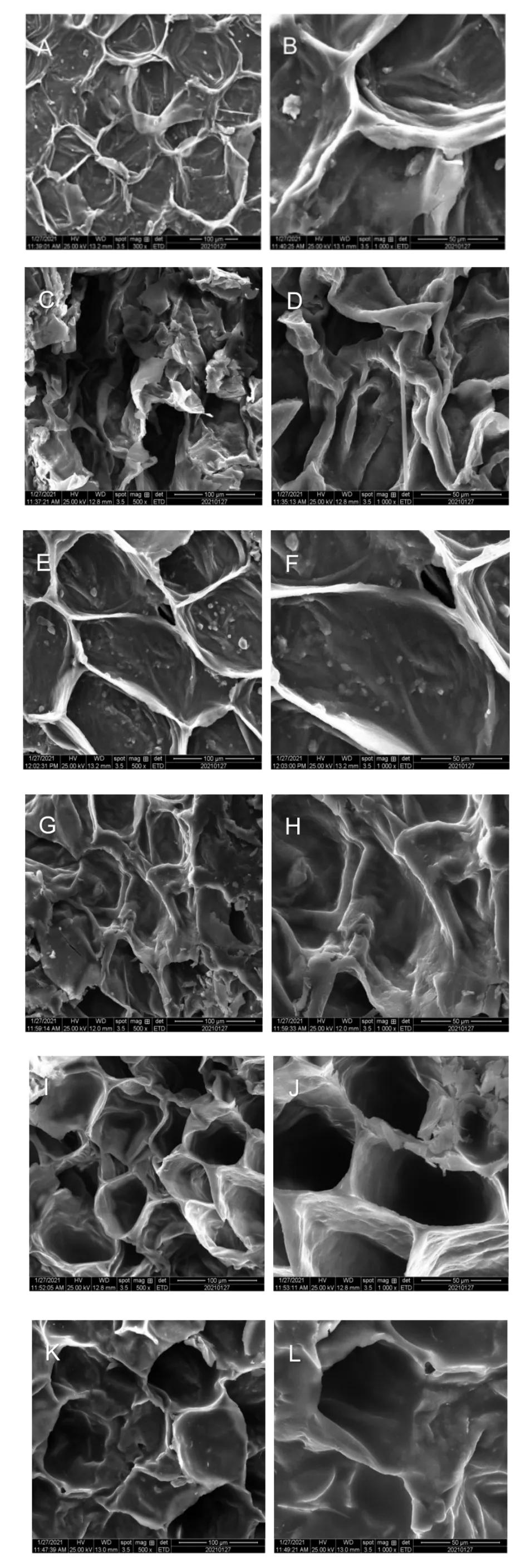
图5 不同处理黄精样品的500 倍和1000 倍扫描电镜图Fig.5 Scanning electron micrographs of 500X and 1 000X for different Polygonatum cyrtonema Hua samples
3 结论
采用不同的干燥方法加工鲜黄精切片的结果表明,微波干燥后黄精的TPC 含量最高(0.036 4 mg GAE/mL)。不同加工方法处理后黄精切片具有不同的抗氧化活性,微波干燥对DPPH 自由基的清除率高达72.8%。FRAP 法测得的总抗氧化能力为微波干燥>蒸后热风干燥>漂烫后热风干燥>未固化热风干燥。微波干燥和热风干燥黄精的FRAP 法测得的抗氧化能力与DPPH 自由基清除能力一致,微波干燥黄精的抗氧化能力较强。同时,微波干燥是保持黄精色泽的较好方法。随着干燥过程的进行,黄精中水分不断被去除,水分由内向外逐渐流失。干燥后期,由于水分含量低,MRI 成像模糊。除此之外,通过扫描电镜观察发现,微波干燥黄精切片的显微结构变化大于热风干燥;而且固化后热风干燥会破坏黄精的微观结构。本研究的开展为药食两用黄精资源的产品开发及深加工提供了一定的理论基础。微波干燥黄精所用时间最短,色差值、微观结构均为最佳,且总酚含量和抗氧化能力均高于其他干燥方法,综合干燥效率和产品质量分析,使用微波干燥处理黄精是适宜的方法。

