唾液腺导管癌的诊疗研究进展
马平川 李春洁 李龙江
口腔疾病研究国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医院头颈肿瘤外科 成都 610041
唾液腺导管癌(salivary duct carcinoma,SDC)是发生于唾液腺的一种恶性程度较高的肿瘤,其发病率低但侵袭性较强,在唾液腺恶性肿瘤(salivary gland carcinoma,SGC)中的占比约为1%~3%[1]。SDC是由Kleinsasser等[2]于1968年报道,并在1991年出现在世界卫生组织(World Health Or-ganization,WHO)分类当中。根据2017年WHO唾液腺肿瘤组织学分类(第4版)中的描述,SDC可以分为2类,一类是原发肿瘤,另一类是起源于多形性腺瘤的SDC,后者也常被称作多形性腺瘤中的癌(carcinoma expleomorphic adenoma,CAx-PA)[3]。与其他SGC相比,SDC的诊疗既有一定的相似性也有其特殊之处,同时,由于SDC的发病率低,相关的临床研究难以较大规模的展开。
本文就目前对SDC的诊断与治疗的研究进展作一综述,旨在对该疾病日后相关的研究与发展提供一定的帮助和启发。
1 SDC的临床表现与病理学特点
1.1 临床表现
SDC可发生于所有唾液腺,其中最常发生于腮腺,约占全部SDC的80%[4-5],其次为下颌下腺,约占15%。SDC在50岁以上的男性中较多见[6],临床症状多表现为面颈部的肿块、肿瘤快速侵袭性生长、面神经麻痹或疼痛以及局部或远处转移[4-5],肿块的平均直径可达23 mm[7]。SDC在早期阶段就易发生复发或远处转移,易出现周围神经侵犯、囊外播散,预后较差,对患者的生命威胁较大。
1.2 病理学特征
SDC的病理学特点以及分子生物学特征与乳腺导管癌有着相似之处。SDC常表现为典型的导管样结构伴粉刺样坏死、筛状孔或罗马桥样(Roman-bridge-like)结构。SDC肿瘤细胞多表现出典型的顶浆分泌嗜酸性瘤细胞的特点,具有丰富的细胞质,胞浆呈嗜酸性,细胞的游离面可见有顶端游离的分泌物,且常有多形性细胞核,伴有大核仁与核分裂象[8]。SDC常见的分子改变包括p53肿瘤蛋白(tumor protein p53,TP53)基因、磷脂酰肌醇-4,5-二磷酸3-激酶催化亚基α(phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit alpha,PIK3CA)、H-ras癌基因、人第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome 10,PTEN)的丢失[9-10],细胞增殖核抗原(nuclcar-associated antigen,Ki-67)的高表达也是其特点之一,并且丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的激活可能是SDC的主要致癌驱动因素[11-12]。除此之外,SDC肿瘤细胞的2个重要分子标记物为雄激素受体(androgen receptor,AR)与人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2),这2种分子标记物在SDC患者中阳性率较高且具有一定的特异性,对SDC的诊断、靶向治疗以及预后的预测有着重要意义,将在后文加以详述。
2 SDC的诊断方法
2.1 影像学诊断
常用的诊断SGC的影像学检查手段包括超声(ultrasound,US)、CT、磁共振成像(magnetic resonance imaging,MRI)、正电子发射型计算机断层显像(positron emission tomography-computed tomography,PET-CT)均可以用于SDC的检查和诊断。其中,超声检查是SDC初步筛查的重要参考,能够清楚地显示出表浅肿瘤组织的位置及其与周围组织的关系,且对患者没有辐射,SDC的US图像多表现为边界不清、不规则分叶状的实质性低回声肿块,内部回声分布不均匀,可见无回声暗区(内部坏死、囊变和钙化),并且可以对周围淋巴结的性质做出判断[13],敏感性和特异性均较高。但是超声检查对较为深在的组织显示作用有限。对于位置深在的肿瘤,如发生在腮腺深叶以及小唾液腺的肿瘤则应当进行CT检查以及MRI检查。SDC的CT图像多表现为中等或低密度侵袭性生长的肿块,常伴有坏死囊性变或沙粒样钙化。而MRI则可以帮助评估软组织和神经受累情况,被认为是SGC的重要检查手段。SDC在T2增强图像上多呈现低-中信号强度,边界不清,肿瘤可侵袭周围软组织或咽旁间隙等结构[14]。因此,使用CT与MRI进行进一步的检查能够准确地判断位置深在的SDC性质以及周围软组织与神经的受累情况,也能够有效地与其他唾液腺肿瘤相鉴别。除此之外,PET-CT技术可以通过高代谢图像对诊断予以提示。PET-CT能更准确地识别转移性病变[15],在检测局部及早期远处转移方面具有重要作用,但在检测局部复发、判断肿瘤性质方面与CT和MRI相比没有明显优势[16]。
综上所述,超声检查可用于较为表浅的SDC的初步筛查以及鉴别,CT与MRI可以用于判断肿瘤良恶性质并且检查位置较为深在的SDC,而PET-CT在怀疑发生远处转移的患者的检查上更具优势,各种影像学检查方法的正确选择和使用是准确诊断SDC并为其治疗提供指导的关键所在。
2.2 细胞学诊断
超声引导下的针吸细胞学检查(fine needle aspiration cytology,FNAC)主要是根据镜下肿瘤细胞形态对肿瘤性质做出判断。针吸活检检查可以在肿块处以及肿大的淋巴结中进行,细胞可能排列成扁平片状、簇状或者乳头状,单个细胞大而呈多角形,胞质丰富,伴有顶浆分泌特点,细胞核呈圆形或卵圆形,核仁突出,少数细胞也可能出现胞质空泡状。涂片中可能不存在正常的唾液腺组织而只存在乳头状多形性圆形细胞,呈腺样排列。FNAC诊断的敏感性与特异性均较高,其中顶浆分泌特点是重要的参考指标,能够对SDC的诊断与治疗提供参考[17]。
除了利用FNAC对细胞的形态加以辨别辅助诊断以外,对SDC细胞的特殊分子改变进行检测鉴别也是辅助诊断的另一种方法,SDC中常见的基因改变包括TP53、PIK3CA、H-ras以及PTEN基因的丢失[8],缺乏p63染色也可以区分SDC与转移性鳞状细胞癌。其中,常用的实验诊断方法包括免疫组织化学与荧光原位杂交(fluorescencein situhybridization,FISH)技术。
综上所述,SDC细胞学特点的诊断以及生物分子学的改变也是诊断参考的可靠依据之一。
3 SDC的治疗
3.1 手术治疗与辅助性放射治疗和化学治疗
SDC作为一种发病率较低但恶性程度高的唾液腺肿瘤,目前尚无统一的标准治疗方法。与其他SGC的治疗相似,大多数情况下对SDC患者依然采用传统的SGC的治疗方法,即手术扩大切除原发灶并结合颈部淋巴结清扫根治,同时辅助术后放射治疗和化学治疗[18]。
对于发生于大唾液腺如腮腺的SDC目前还是多采用腮腺浅叶或腮腺全切术[7]。腮腺切除范围和面神经的处理是手术设计的关键,且还应考虑下颌下及邻近血管和肌肉骨骼结构以及肿瘤与舌神经和舌下神经的解剖关系,充分结合患者实际情况做出合适的手术设计[19]。Olsen等[20]认为:由于腮腺浅叶与深叶都存在淋巴结,SDC出现淋巴结转移的比例较高,因此应该行腮腺全切术防止复发,其研究中的2名SDC患者在行腮腺全切与颈部淋巴结清扫手术后效果良好,术后病理结果可见转移阳性的深叶淋巴结。对于面神经的处理也是发生于腮腺的SDC手术关键之一,Park等[21]的研究显示:表情肌无力并不一定意味着肿瘤侵犯了面部神经。因此,关于面神经的切除可以根据术中的情况加以定夺。如果肿瘤组织只是接近面神经而并未与神经直接接触时,则应该在手术过程中将面神经精细分离并同时去净肿瘤组织,但是如果肿瘤已经侵犯面神经则应该手术过程中一并切除面神经以防止复发[22],Huang等[23]的研究中3名切除面神经的SDC患者在术后2年一直存活,Gilbert等[1]的研究也显示一并切除面神经在目前的治疗中较为常见。
SDC较其他唾液腺肿瘤更易发生淋巴结转移,有文献[24]报道:SDC的隐匿性淋巴结转移率达到24.4%,淋巴结转移率达到了54%;也有其他研究[4-6,25]中显示:SDC患者发生淋巴结转移的比例为46.6%~56%。因此,针对怀疑恶性程度较高的SDC患者,应手术时行颈部淋巴结清扫术,以彻底清除可能的隐匿性转移淋巴结,目前的研究中,大多数手术治疗患者也均同时接受颈部淋巴结清扫[3-4]。而对于有些低度恶性肿瘤则可以行选择性颈部淋巴组织清扫术[24],并应当在术后同时配合放射和化学共同治疗。
对于SDC的术后辅助治疗如放射治疗、化学治疗的具体适应证尚未有明确证实的结论与统一的标准,目前,也有回顾性研究[26]显示:接受术后辅助性放射治疗的患者病情控制与效果较好,放射治疗常用剂量为60 Gy左右(54~70 Gy)。Osborn等[6]对485名患者的回顾性研究显示:SDC患者在接受术后辅助放射治疗和化学治疗后,总生存期(overall survival,OS) 无显著差异。Jayaprakash等[25]对228名SDC患者的回顾性研究也显示:术后辅助性放射治疗对患者没有任何益处。但Kim等[26]的回顾性研究分析了15名接受了手术治疗以及术后放射治疗的SDC患者,结果显示:肺部是最常见的远处转移器官,手术治疗以及术后放射治疗对于局部控制的效果较好,但是对于远处转移的控制并不理想。Qian等[27]的回顾性研究也显示:术后放射治疗对于远处转移的治疗效果不明显。
综上所述,关于SDC的术后放射治疗有效性依然存在争议,目前的文献显示其效果也仅存在于病变的局部控制方面。关于SDC的术后化学治疗也并没有确切的定论。有研究[6]显示:其追踪涉及的SDC患者中有63.4%接受了术后放射治疗,并有29.3%的患者接受了化学治疗,但结果无论是术后放射治疗还是化学治疗对生存率都没有明显影响,类似的结果也在其他的文献[1]中出现,目前尚没有一个SDC标准的化学治疗方案。总体而言,虽然目前部分患者会在术后接受辅助性放射治疗和化学治疗,但是该治疗的效果并没有确切的结论。
3.2 靶向治疗
针对于SDC的特殊标记物以及分子生物学改变的靶向治疗是SDC治疗研究新的方向,其作用的位点主要是AR和HER-2,近年相关的文献回顾总结见表1[28-39]。
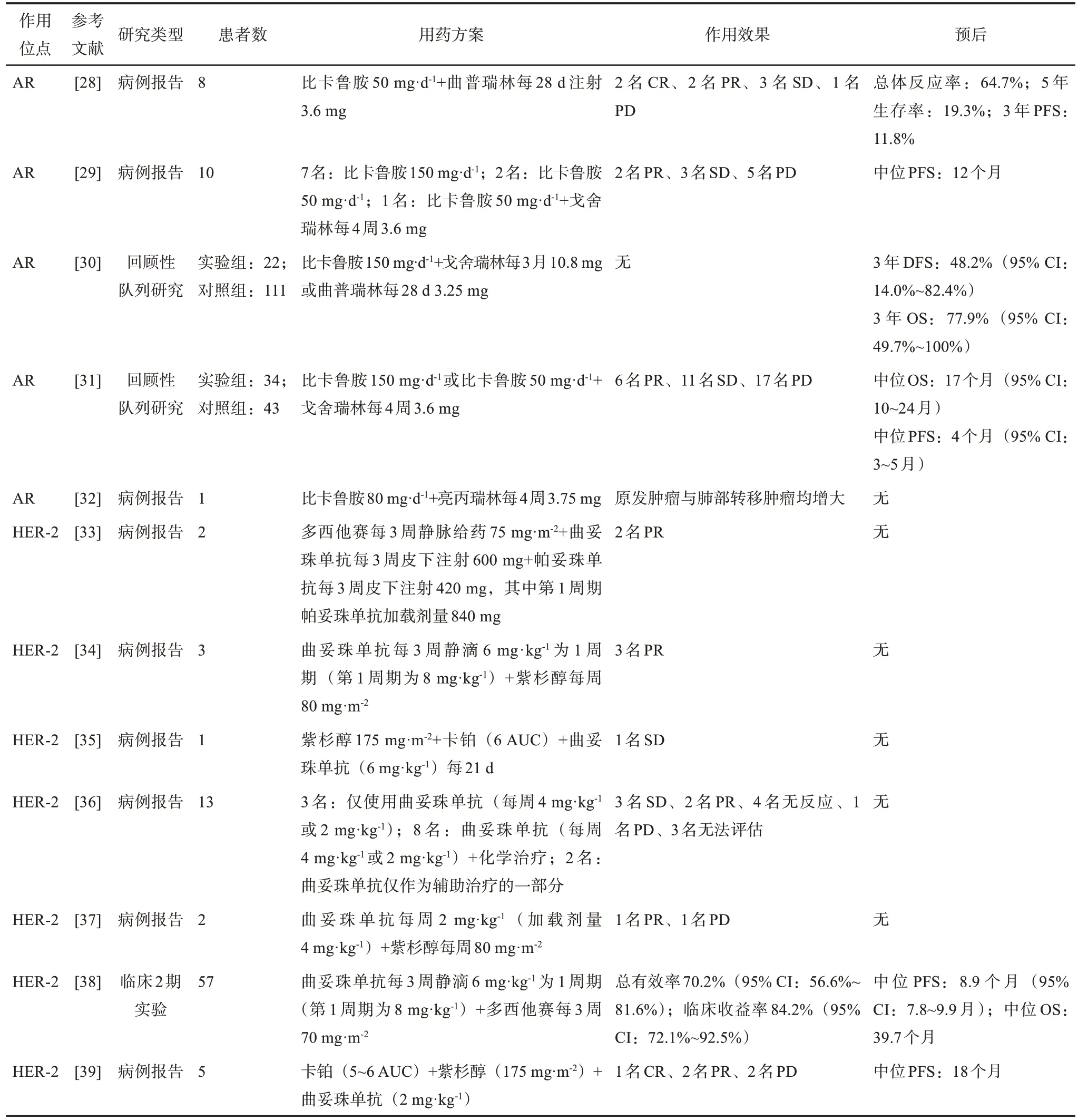
表 1 近年SDC靶向治疗的文献回顾Tab 1 Literature review of targeted therapy for SDC in recent years
AR是SDC较为确切的一种标记物,AR作为一种核类固醇激素受体,在人体组织中的生理性表达很低,可以通过直接与DNA结合或与其他的转录因子相互作用来调控多种效应基因,从而促进细胞的生长与分化。SDC的患者多数都存在AR阳性,Santana等[11]的研究显示:SDC的患者中AR阳性的比例为78%且AR出现免疫反应性的比例高达96%。另一项研究[40]显示:SDC患者AR免疫阳性比例达94%。大多数文献[23,41]的结果都显示AR阳性在70%左右,具有一定的特异性。同样,SDC患者中酪氨酸激酶受体-2(receptor tyrosine kinase 2,ErbB-2)阳性率也较高,ErbB-2是一种跨膜受体样蛋白,具有酪氨酸激酶活性,其上游基因是位于17号染色体上的HER-2基因。不同文献资料中ErbB-2的阳性率稍有差别,有文献[33]显示ErbB-2的过表达率为21%~44%,Gilbert等[1]的研究中显示相关的ErbB-2基因增殖阳性达到31%,Santana等[11]的研究则显示在SDC中ErbB-2达到了46%。其结果之间的差异可能与研究所使用的检测方法有关,荧光原位杂交技术与免疫组织化学技术是各研究中最常用的2种技术,不同的检测方法可能对结果存在影响。
针对AR的靶向治疗主要使用的是雄激素阻断治疗 (androgen deprivation therapy,ADT)。目前,ADT在前列腺癌的治疗中应用相对成熟,比卡鲁胺与促黄体生成素类似物(luteinizing hormone releasing hormone analogues,LHRH analogues)是常用的药物[28]。也有多项病例报告与研究显示对于SDC患者使用ADT效果明显。Jaspers等[29]的研究显示:每天予AR阳性的SDC患者口服150 mg比卡鲁胺,获得20%应答率,PFS提高了12个月。Locati等[28]的研究也提示ADT没有明显的不良反应,作用于SDC的患者总有效率为64.7%。van Boxtel等[30]的回顾性研究囊括了22名AR阳性的接受ADT的SDC患者与111名对照组SDC患者,结果 显 示 : 3 年 DFS 估 计 分 别 为 48.2% (95% CI:14.0%~82.4%)与27.7%(95% CI:18.5%~36.9%,P=0.037),DFS明显延长。Boon等[31]的回顾性研究中共评估了34名使用ADT的患者,临床有效率达到50%,临床获益中位数为11个月。但是也有文献显示ADT可能出现拮抗反应,如Wasano等[32]的病例报告中患者每日口服比卡鲁胺(80 mg·d-1),每4周皮下注射促黄体生成素类似物亮丙瑞林(3.75 mg)1次,患者在前3个月肿瘤体积出现缩小,但是之后肿瘤体积不断增大,治疗效果不明显,17个月时发生脑部转移。研究中ADT的用药方法相对较为统一,多为每日口服150 mg比卡鲁胺 或 50 mg·d-1比 卡 鲁 胺 + 每 4 周 皮 下 肌 肉 注 射3.6 mg LHRH类似物,但是关于其疗效和作用尚没有确切的定论。
对于HER-2位点,曲妥珠单抗是一种针对HER-2酪氨酸激酶受体胞外结构域的人源化单克隆抗体,已广泛用于乳腺癌术后辅助治疗和转移性乳腺癌的治疗,有文献[42]显示:在乳腺癌的治疗中,接受多西他赛和曲妥珠单抗治疗的HER-2阳性转移性乳腺癌患者的PFS中位数为12.4个月,OS中位数为40.8个月,在此基础上加入帕妥珠单抗可以使PFS和OS的中位数扩大到18.7和56.5个月。因此,有学者探索将其用于SDC治疗的可能性,但SDC治疗中ErbB-2位点的治疗效果暂时还没有确定的结论。van Boxtel等[33]的研究显示:使用曲妥珠单抗阻断ErbB-2对于SDC的治疗有一定的作用,其报道中患者出现部分治疗反应。De Block等[34]报道了2名SDC患者使用紫杉醇联合曲妥珠单抗治疗出现了部分反应。与之相似,Kaidar-Person等[35]也报道了联合使用紫杉醇、卡铂、曲妥珠单抗治疗SDC有效的案例。而Perissinotti等[36]的研究则显示:仅有部分患者对于曲妥珠单抗的治疗有部分反应。除此之外,Gibo等[37]2名患者的病例报告中,曲妥珠单抗给药的加载剂量为4 mg·kg-1,后保持每周2 mg·kg-1,联合紫杉醇每周80 mg·m-2。其中,病例1的患者无明显不良反应,停用药物后依然存活2年;但病例2的患者使用相同的治疗方案,未能改善肺部转移灶的情况并死于呼吸衰竭。Takahashi等[38]的研究中纳入的患者数量较多,共有57名患者,每名患者接受曲妥珠单抗加载剂量为8 mg·kg-1,之后每3周6 mg·kg-1,同时多西他赛70 mg·m-2,每3周给药1次;结果显示:总有效率为70.2%(95% CI:56.6%~81.6%),临床有效率为84.2%(95% CI:72.1%~92.5%),治疗效果较明显。
除了作用于AR以及HER-2这2个比较确切位点的靶向治疗以外,也有研究意在探究对于SDC患者的其他靶向治疗位点。Saintigny等[43]的研究显示:在SDC患者中较常出现PTEN基因的丢失以及磷脂酰肌醇-3-激酶(phosphatidylin-ositol-3-kinase,PI3K)通路关键分子的改变,并在体外证明了pan-PI3K抑制剂的治疗反应,提示其可能成为SDC的治疗靶点。除此之外,程序性死亡受体-配体1(programmed cell death-ligand 1,PD-L1)、H-ras、鼠类肉瘤滤过性毒菌致癌基因同源体B1(v-raf murine sarcoma viraloncogene homolog B1,BRAF)等也都有可能作为未来靶向治疗的作用位点[44]。总体而言,SDC的靶向治疗是目前研究的热点所在,虽然对于AR以及HER-2的靶向治疗文献相对丰富,但是正如前文所述,SDC患病率低,难以进行证据等级更高、更有确切结论的相关研究,而对于其他的靶向治疗目前也基本只处于理论阶段。因此,关于手术、放射治疗、化学治疗、靶向治疗的标准模式和方法尚未能建立,还需要后续进一步的深入研究。
4 SDC的预后
SDC是一种恶性程度高、容易发生转移的恶性肿瘤,预后极差。患者总体生存时间的中位数为3~4年,5年的总体生存率为40%左右[1,3],5年DFS和OS的加权平均值分别为46%和35%[45]。SDC的远处转移达到47%,最常见的是肺转移、骨转移,其次为肝转移、脑转移[1,5],发生远处转移之后患者的生存时间中位数只有13个月[46],且化学治疗与靶向治疗对于转移病灶的治疗效果均不理想[32]。
Jayaprakash等[25]的研究使用了监测、流行病学和美国国立癌症研究所数据库(Surveillance,Epidemiology and End Results,SEER) 中的SDC数据,分析得出228名SDC患者10年总生存率为42%,中位生存期为79个月。Villepelet等[47]的回顾性研究显示:3年DFS为44%。因此,许多研究旨在对SDC的不良预后因素进行研究分析,具体的预后因素分析如下。1)年龄:年龄是影响SDC预后的重要因素,小于50岁的患者5年生存率明显更高(86%∶59%,P=0.01)[25],多变量分析[5]也显示大于65岁的患者预后较差且总体生存率低(P=0.002),但是其他因素未见有明显总体生存率区别。2)分期:处于较早期的病变(Ⅰ/Ⅱ期)其预后效果更好,临床Ⅰ/Ⅱ期的患者其5年生存率更高(84%∶50%,P<0.001)[25]。单变量分析[1]也提示不同时期的病变其患者生存时间不同(T1期:4.57,T2期:6.57,T3期:2.51,T4期:2.12,P=0.009);多变量分析[6]显示处于Ⅰ~Ⅱ期的患者预后更好,而Ⅳ期预后较差。3)肿瘤大小:肿瘤大小小于3 cm的患者其生存率更高(>65%∶47%,P=0.006)[25],但是多变量分析[5]又显示肿瘤的大小对于患者的OS和PFS没有影响。4)淋巴结侵犯:单变量分析[48]显示存在淋巴结转移的患者PFS更低(P=0.035),单变量分析[27]也显示颈部淋巴结若出现累及,则患者的总体生存率更低(P=0.08)。Xiao等[24]的研究也支持此观点。5)性别:多变量分析[6]显示男性的预后更差,而女性的危险度更低(P=0.02)。除此之外,多变量分析[3]显示肿瘤囊外播散的患者预后更差(P=0.044)。但是也有研究的结果较为特殊,如单变量分析[26]显示年龄、性别、病情分期、淋巴结侵犯、血管侵犯、囊外扩散、根治性手术、同步放射和化学治疗、放射治疗剂量与预后指标如PFS或OS无关。总体来看,有一些因素存在争议,但是淋巴结转移因素较为确切,也被大多数文献所支持。
除此之外,一些特定的分子学改变也可能成为SDC预后的预测因素。研究[11]显示:AR(+)且ErbB-2(-)伴Ki-67低表达的患者预后最好,同时AR(-)且ErbB-2(-)的患者预后结果显示最差。Shimura等[49]的研究显示:TP53截断突变的SDC患者无进展生存期较短。Ryu等[50]的研究则显示:在HER-2阴性的SDC中,酪氨酸激酶的高表达可能与预后不良有关。关于SDC的预后预测因素目前也依然在研究当中,需要更有效、更大规模的回顾性或临床研究来进一步发展。
5 总结
综上所述,SDC是一种较为少见、发病率较低,但是恶性程度较高、侵袭性强、预后差的SGC,多发于中老年男性,最常见于腮腺。使用US、CT、MRI等影像学技术结合FNAC,并适当结合免疫荧光检查与FISH技术能够较好的对病变的位置、性质与发展做出早期准确的判断。
对SDC的治疗尚没有统一的标准,目前依然多采用原发灶切除并视情况进行颈部淋巴结清扫与术后辅助性放射和化学治疗提高患者生存率,其靶向治疗是当前研究的热点。
SDC预后较差,易发生淋巴结转移与局部复发,5年总体生存率仅为50%左右,其相关预后因素尚未有明确的结论,还需要后续试验的进一步验证探索。
利益冲突声明:作者声明本文无利益冲突。

