磁性纳米复合材料固定化酶的研究进展
韩 林,侯忠毕,张 敏,胡月月,姜 涛,李 健
(天津科技大学 化工与材料学院,天津 300457)
酶是生命体中最重要的大分子之一,其催化效率高、专一性强、反应条件温和,极具科学研究价值和工业应用意义[1]。但是大多数酶分子稳定性差、在极端条件下易失活,在均相催化中与底物/产物分离困难,导致生产成本高,所以酶促反应在工业化发展中严重受到限制[2]。相对于游离酶,固定化酶与其他材料结合,可提高酶的稳定性、易于分离,解决限制其进一步发展的瓶颈问题,所以固定化酶技术在工业化生产中的应用显得尤为重要[3-4]。随着纳米技术的飞速发展,新材料的开发为固定化酶提供了更广阔的平台[5-6]。磁性纳米材料不仅具有比表面积大、表面易于修饰、与酶分子尺度相近等纳米材料的优点,而且更具有独特的磁学性质,同时它还可以与多种材料复合,解决单一材料在固定化酶领域所存在的缺陷问题。因此,磁性纳米复合材料在固定化酶领域内得到广泛的研究[7-8]。本文中,笔者对近年来磁性纳米复合材料在固定化酶领域的应用进行系统分析,以期对固定化酶的应用提供参考。
1 磁性纳米复合材料
近年来,磁性纳米材料已经成为重要的纳米材料[9]。大量的高磁性材料,如四氧化三铁(Fe3O4)、氧化锰(MnO)、铁铂合金(FePt)等已经大量应用在反应催化[10]、生物医学[11]、成像[12]及数据存储[13]等领域。
磁性纳米材料可以通过外部磁场给药物和生物分子提供引导传递力量,进而达到固定和分离磁性标记生物实体的目的[14-16]。虽然磁性纳米材料具有低毒性、生物相容性和生物降解性等优点,但是又有很多缺点限制了裸磁性纳米材料在固定化酶领域的应用,如化学稳定性差、聚集倾向高、吸附酶量低等[17]。为了解决裸磁性纳米材料的这些问题,采用无机材料[18-20]或者有机材料[21-23]等与裸磁性纳米材料复合形成磁性纳米复合材料,从而应用于固定化酶领域。这样不仅可以提高磁性纳米材料的化学稳定性,而且还可延缓磁性纳米材料的氧化。科研人员正试图利用这些复合材料独特的物理或表面特性,使其在固定化酶、生物医学和临床应用中发挥巨大的作用[24]。
2 以Fe3O4为磁性组分的纳米复合材料
目前,在固定化酶领域应用最多的磁性纳米复合材料主要以Fe3O4磁性纳米粒子作为磁性组分,再根据不同的应用需要,选择合适的其他组分材料进行复合[18-23]。Fe3O4是同时含有Fe3+与Fe2+的反尖晶石结构,具有结构稳定性、良好的磁响应性、耐候性、耐光性及生物相容性等优点[25-26]。
2.1 Fe3O4@SiO2纳米复合材料
Fe3O4磁性纳米粒子在空气中容易被氧化,并且在酸性环境中会发生溶解,因此在一定程度上限制了它的广泛使用。而二氧化硅(SiO2)在空气或酸性环境条件下稳定性高、化学惰性强、表面基团丰富、易于修饰,尤其是在形成介孔结构后,纳米SiO2具有可控孔径、高比表面积等性质,使得Fe3O4@SiO2复合材料在固定化酶领域得到众多研究者的青睐[27-29]。
Tao等[27]以纤维素酶为模板,采用分子印迹法制备了磁性Fe3O4@SiO2纳米颗粒,并用精氨酸对纳米颗粒表面进行修饰,结果发现:固定化纤维素酶在较宽pH和温度范围内表现出较高的催化活性,半衰期是游离酶的2倍以上,经过7次重复使用后,仍然保持77%的残留活性。由此可见,纤维素酶固定在磁性纳米复合载体上提高了其自身活性、稳定性和刚性。
Xie等[28]通过共沉淀法制备了Fe3O4磁性内核,并利用Stober法在其外部形成了MCM-41型SiO2壳层,又在核壳结构的外表面进行氨基丙基化修饰,最后以戊二醛为交联剂将褶皱假丝酵母脂肪酶共价固定,结果发现:MCM-41层有效解决了Fe3O4颗粒的团聚问题,脂肪酶的固定率达到76%,饱和磁化强度值为26.3 T/g,可以通过外加磁场实现方便的分离,固定化酶反应器循环使用5次后,催化酯交换的效果基本保持不变,表现出良好的稳定性。
Bian等[29]用戊二醛将α-淀粉酶和葡糖淀粉酶共价固定在氨基修饰的Fe3O4/SiO2核壳纳米球上,然后通过Fe3+与丹宁酸(TA)配位络合物的自组装配位在酶分子的表面形成薄膜(图1),以防止固定化酶的“变性”与脱落,结果发现:在薄膜保护下,固定化酶在高温和极端pH环境下的稳定性更好,特别是对十二烷基磺酸钠(SDS)、乙醇、尿素等失活剂的抵抗性显著增强,循环使用9次,仍能保持55%的原始活性,储存15 d后,剩余活力高达85%,而游离酶只剩余25%。
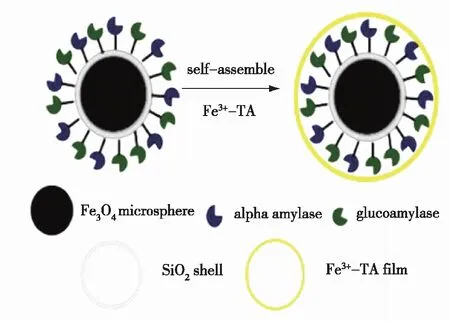
图1 Fe3O4@SiO2核壳纳米球与用于酶保护的Fe3 +-TA 薄膜复合材料制备过程[29]Fig.1 Schematic illustration of Fe3O4@silica core shell nanospheres with Fe3+-TA film for enzyme protection[29]
2.2 Fe3O4@石墨烯纳米复合材料
石墨烯是蜂窝状碳晶格的二维结构,具有较大的比表面积和优异的力学、结构、电学和热性能[30]。氧化石墨烯(GO)有较多的含氧官能团和较大的比表面积,具有较好的生物相容性,使之成为装载磁性纳米粒子和固定化酶的优良载体。同时由于共轭网络受到严重的官能化,氧化石墨烯薄片又具有绝缘的特质。所以氧化石墨烯与磁性纳米材料结合成的复合材料,不但有独特的磁性二维结构,而且还有制作简单、毒性低、表面修饰性强和酶装载量大等特点[31],在酶工程研究中受到了极大的关注[32-34]。
Amirbande等[32]先合成了超顺磁性氧化石墨烯(Go/MNP)纳米复合材料,再用2,4,6-三氯苯胺对纳米复合材料表面进行表面改性制得酶固定化载体(图2),结果发现:共价固定在磁性纳米载体上的葡糖淀粉酶仍然保留96%的活性,且显示出较高的热稳定性和储存稳定性;经过20个反应循环后,固定化酶仍然具有超过56%的初始活性。由于酶反应器的重复使用,载体与酶的结合强度降低,酶在循环使用中流失,因此造成了固定化酶的活性下降。
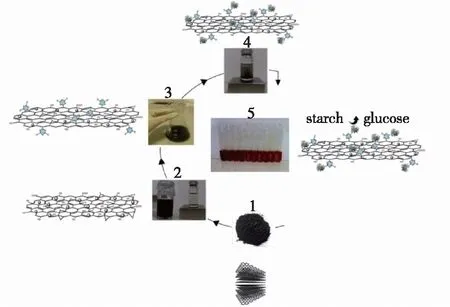
图2 葡糖淀粉酶在官能化超顺磁性氧化石墨烯纳米复合物(GO/MNP-CC/GLA)上的共价固定[32]Fig.2 Schematic representation the covalent immobili-zation of glucoamylase on functionalized super-paramagnetic graphene oxide nanocomposite (GO/MNP-CC/GLA)[32]
Heidarizadeh等[33]提出了一种新型的酶与载体表面的连接办法,用二硫代氨基甲酸酯取代传统的戊二醛在磁性纳米复合载体表面修饰,以此来实现酶与载体之间的共价连接,在改性的磁性Fe3O4/GO纳米复合材料表面成功共价固定脂肪酶,取得了较好的效果。以对硝基苯基月桂酸酯为底物,催化其水解为硝基苯酚和月桂酸,结果发现,固定化脂肪酶与游离酶无显著差别,在经过6个反应循环后仍保持75%以上的催化活性。
Chang等[34]通过原位沉淀合成了Fe3O4/GO纳米复合材料作为葡萄糖氧化酶的载体,其中Fe3O4磁性纳米粒子在该反应中同时起到模拟过氧化氢酶的作用,从而得到一种操作简单、性能稳定的检测葡萄糖和H2O2浓度变化的一步分光光度法,结果发现:固定化酶具有良好的稳定性,循环4次后,固定化酶的活性基本保持不变,该系统可以对0.5~600 μmol/L的葡萄糖进行检测,检测限为0.2 μmol/L;对H2O2的浓度检测范围为0.1~10 μmol/L,检出限为0.04 μmol/L。将该系统应用于人血清中葡萄糖含量的检测,样品的相对偏差为2.9%~4.5%。该酶反应器具有良好的适用性,为人血清中葡萄糖浓度检测提供了新的思路。
2.3 Fe3O4@金纳米复合材料
金纳米粒子表面可通过修饰接枝得到较为丰富的官能团,如硫醇基和二硫基,这些官能团能为酶分子的固定提供良好的载体,Fe3O4@金纳米复合材料还具有良好的导电性和生物相容性,能为维持酶的良好活性提供微环境[35-37]。
Peng等[36]使用一锅原位化学合成聚合法合成了Fe3O4-聚多巴胺(PDA)-Au-葡萄糖氧化酶磁性核壳纳米粒子,然后将合成的纳米粒子附着到制备的磁性玻璃碳电极,制备了一种高性能的生物膜传感器用于检测葡萄糖浓度(图3),结果发现:该生物膜对葡萄糖浓度的线性响应表现良好,响应范围为0.02~1.875 mmol/L,重复8次后,对浓度为1.0 mmol/L葡萄糖浓度检测相对标准偏差为4.1%,储存4周后,仍保持95%的初始安培响应,表现出良好的稳定性。
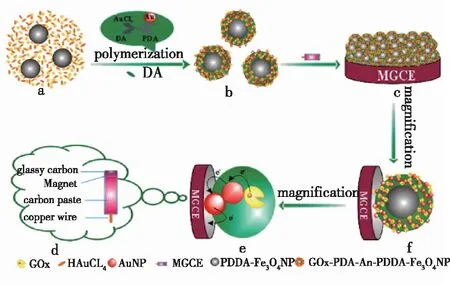
图3 制备GOx-PDA-Au-Fe3O4 MBNPs修饰磁性玻碳电极膜[36]Fig.3 Schematic illustration of preparation of GOx-PDA-Au-Fe3O4 MBNPs film modified magnetic glassy carbon electrode[36]
Cao等[37]通过金纳米粒子作为中间配体,在Fe3O4纳米粒子上可逆地固定了胰蛋白酶,通过HPLC和MALDI-TOF质谱来表征该反应器在15 min时间内对标准蛋白的消化情况,结果发现:对于肌红蛋白、细胞色素c和牛血清白蛋白,分别观察到93.8%、90.9%和54.1%的序列覆盖率;胰蛋白酶固定在磁性AuNP@Fe3O4纳米粒子上形成一种优异的生物催化剂,能够使蛋白质非常快速地被消化。该反应器稳定性好,重复多次后,仍能保持较高的酶活性,并可实现部分酶的再生,同时,可以用硼氢化钠剥离失活的酶,实现载体的重复利用,该反应器操作简单,可重复性高。
2.4 Fe3O4@高分子纳米复合材料
壳聚糖是一种价格低廉且含有大量氨基、羟基等官能团的多糖,可对其表面进行化学改性后用于酶固定化,用壳聚糖包覆磁性纳米颗粒可以很好地解决磁性纳米颗粒在液体介质中的聚集问题[38]。此外,对磁性纳米粒子用壳聚糖聚合物进行表面改性可以改善磁性纳米粒子的生物相容性,使其可以广泛应用于生物医学领域,如蛋白质固定化、药物传递系统、伤口愈合、组织工程和磁共振成像等[39-40]。
Long等[38]在壳聚糖水凝胶中对Fe3O4纳米粒子进行原位矿化,制备了磁性壳聚糖/Fe3O4纳米粒子,用于固定化普鲁兰酶,并考察了通过不同物理或化学固定化方法对酶反应器的影响,结果发现:通过不同方式固定化酶制备的酶反应器均保留了超过70%的游离酶酶活性,其中通过物理静电吸附在磁性纳米载体表面的固定化酶保留最多的游离酶活性,可以达到91%,但是稳定性不如多点共价附着的效果好;通过不同方式固定的酶与底物的亲和力均比游离酶增强。
Liu等[41]将对苯二胺溶液与Fe3O4纳米粒子混合,制备了磁性聚对苯二胺(PpPD)纳米复合材料,并将其作为固定化酶的载体(图4),并通过透射电镜(TEM)和傅里叶变换红外(FTIR)证实了PpPD/Fe3O4纳米纤维的成功合成。将漆酶(Lac)共价结合在载体上,用于活性蓝19染料的降解,结果发现:固定化漆酶的贮存稳定性、操作稳定性和热稳定性均高于游离漆酶;固定化漆酶在染料中1 h的染料去除率约为80%,而游离漆酶的去除率约为20%;循环8次后,固定化酶对染料的去除率仍保持在43%。该酶反应器具有较高的可重用性和染料的高去除率。

图4 将漆酶(Lac)固定在PpPD/Fe3O4纳米复合材料上的示意[41]Fig.4 Schematic illustration of laccase immobilization on PpPD/Fe3O4 nanocomposite[41]
Wang等[42]利用聚多巴胺(polydopamine,PDA)表面易于改性的特点,对Fe3O4@PDA纳米粒子用不同的官能团进行修饰,通过共价结合或离子吸附等不同方法用于固定普鲁兰酶,结果表明:在Fe3O4@PDA衍生物上共价固定的普鲁兰酶的热稳定性和活性恢复等要低于吸附在改性的纳米材料表面的普鲁兰酶。酶与载体的界面特性决定了生物酶催化剂的性质,非共价相互作用有利于保留酶的催化活性。
2.5 Fe3O4@MOF纳米复合材料
金属有机骨架化合物(MOF)兼具无机材料的刚性和有机材料的柔性特征[43]。近年来,以MOFs作为多孔材料固定化酶可显著提高酶的催化活性和化学/热稳定性,所以受到人们的普遍关注,但是它有密度低、不易与底物分离与处理的缺点[44-47]。将磁性的金属有机骨架(磁性-MOF)与磁性相结合形成复杂的结构,可以作为一种固定化酶载体潜在的候选材料。
Hou等[48]通过生物矿化作用将葡萄糖氧化酶(GOx)嵌入到磁性沸石咪唑酯骨架8(mZIF-8)中,制备了一种快速检测葡萄糖的比色检测器,mZIF-8不仅作为高酶负载量的酶多孔载体,还起到模拟过氧化氢酶的作用(它可以将葡萄糖氧化酶催化生成的H2O2分解为水,并氧化邻苯二胺(OPD)(图5)),结果发现,通过这种方法制备的酶检测器,因为酶的尺寸大于MOFs的孔径,可以防止酶的浸出,制备的酶反应器表现出良好的可重复利用性和对葡萄糖高度的特异性检测,重复12次后仍保留88.7%的活性;该酶反应器具有较宽pH和温度适用性,因为载体材料提高了酶在较为复杂的外界环境中的稳定性,而且合成简单,操作方便,对底物具有很高的检测灵敏性。

图5 GOx嵌入到mZIF-8制备比色传感器[48]Fig.5 Schematic illustration of the GOx embedded mZIF-8 process[48]
Ghasem等[49]通过超声辅助反胶束的方法(UARM法)制备了Ta-MOF@Fe3O4核/壳纳米结构,用于地衣芽孢杆菌Km12脂肪酶的固定(图6),结果发现:新型纳米结构中具有的金属中心和游离羧酸基团是脂肪酶固定化的良好固体支持物,固定化脂肪酶保留了95%的初始活性,比游离酶有更好的稳定性。
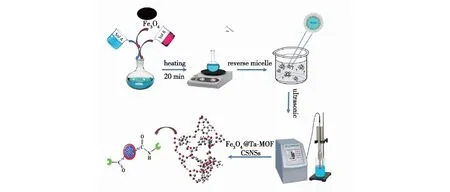
图6 超声反胶束(UARM)法合成的Ta-MOF@Fe3O4纳米[49]Fig.6 Schematic representation of Ta-MOF@Fe3O4 nanostructures synthesized by UARM method[49]
3 以其他材料为磁性组分的纳米复合物
除了Fe3O4以外,还有其他的磁性纳米材料被应用于固定化酶领域的研究,如CuFe2O4、Co3O4和CNi等[50-55]。
3.1 CuFe2O4基磁性纳米复合材料
CuFe2O4纳米粒子具有环境相容性好、催化活性高、易于分离等优点,在催化剂、固定化酶、传感器和电子学等领域得到了广泛的应用[51]。
Rouhani等[51]制备了CuFe2O4磁性纳米粒子修饰的石墨烯氧化物,并通过共价作用固定了云芝漆酶(图7),结果发现:与游离的漆酶相比,固定化酶反应器对温度和pH的敏感度较低,具有更宽的温度和pH适用性;存储30 d后,固定化酶仍保持83%的活性;重复10次以后,固定化酶没有明显的活性损失。
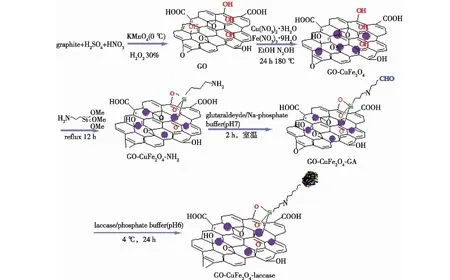
图7 GO-CuFe2O4-laccase的制备[51]Fig.7 Preparation of GO-CuFe2O4-laccase[51]
Kashefi等[52]将氧化石墨烯(GO)纳米片与CuFe2O4纳米粒子相结合,合成磁性氧化石墨烯(MGO),再用3-氨丙基三甲氧基硅氧烷(APTMS)对其进行氨基官能化后用来共价固定漆酶,合成的生物反应器用于偶氮类染料降解。基于中心复合设计(CCD)的响应面法(RSM)对方案模型进行了优化,得到了该生物反应器对染料最大降解率(95.33%)时的最佳反应条件:纳米催化剂用量290.23 mg/L、染料质量浓度19.60 mg/L,pH 4.23,得到的相关系数和调整系数分别为0.965 1和0.933 6,展现了模型的良好性。CuFe2O4纳米粒子与氧化石墨烯相结合,不仅可以为反应器提供磁性性质,便于酶反应器的重复性利用,还可以阻碍氧化石墨烯的团聚,维持其功能性。
3.2 Co3O4基磁性纳米复合材料
Co3O4为尖晶石结构,有较高的晶体场稳定化能,同时具有制备简单、稳定性高、分散度高等优点,被广泛应用于磁性材料、电化学及生物传感器领域[53]。
Ali等[53]将脲酶固定化到壳聚糖/氧化钴(CS/Co3O4)纳米复合材料上,并在玻璃滤纸上制备了电位尿素生物传感器,结果发现:Co3O4纳米粒子的饱和磁化强度值为2.82×10-3T,可测得的最大尿素范围为1×10-4~8×10-2mol/L,测试pH为3~11,具有较宽的pH适用性、检测快速响应性和保存稳定性。
Dalkiran等[54]将谷氨酸氧化酶(GCE)固定在Co3O4/壳聚糖/石墨烯复合膜修饰玻碳电极上,构建了一种快速检测谷氨酸的酶生物传感器,并通过调试各种因素确定了最佳的载酶量和检测条件,结果发现,该酶生物传感器对谷氨酸的亲和力更强,具有低响应时间(25 s)、宽泛的适用范围,可在4.0×10-6~6.0×10-4mol/L的浓度范围内实现线性检测,检测灵敏度为0.73 μA·L/mmol, 最小检测浓度为2.0 ×10-6mol/L,信噪比(S/N)=3,具有良好的稳定性、重复使用性和抗干扰能力,制作简单。
3.3 CNi基磁性纳米复合材料
碳包覆镍纳米粒子(CNi)比单碳层具有更高的镍特性,可以加快电子转移的速率,表现出良好的电催化活性。在外层多层碳的保护下,包覆金属镍即使在空气中暴露了几年,也不会被水解和氧化,因此具有相当的稳定性,能够克服纳米粒子的团聚[55]。
Yang等[56]构建了一种壳聚糖包覆的镍纳米粒子(CNi)纳米复合膜,并固定酪氨酸酶生成了一种新型的酶生物传感器用于邻苯二酚的检测,结果发现:该生物传感器具有快速响应(<8 s)、低检测限和宽线性范围等特性,线性浓度监测范围为0.25 nmol/L~27 μmol/L;重复10次后,相对标准偏差(RSD)为3.8%,表明该修饰电极具有良好的重复性;生物传感器在干燥保存2个月后仍然保留了其原始响应的60.3%,说明CNi在很大程度上维持了酪氨酸酶的活性,该生物传感器具有长期稳定性。
4 总结与展望
随着纳米材料的不断发展,磁性纳米复合材料已经在固定化酶领域方面显示出明显的优势,并取得了丰硕的成果。但同时,目前的研究中还存在一些问题:如研究的重点局限于固定化单酶而忽略对固定化多酶体系的研究,缺乏对于载体-酶分子界面作用的有效调控手段,磁性载体与酶协同催化的研究较少等。总之,酶固定化的研究涉及材料科学、生物科学、催化科学以及过程科学等诸多学科的交叉融合,因此相关领域的研究进展和成果都可以应用于生物、制药、能源、环境、食品等行业,具有巨大的发展潜力。

