木薯渣超低酸预处理后的酶水解及乙醇发酵
李富强,彭叶灿,郝加稳,曾灵玉,周敬红,阎欲晓*
(1.广西大学 轻工与食品工程学院,广西 南宁 530004;2.广西清洁化制浆造纸与污染控制重点实验室,广西 南宁 530004;3.广西大学 生命科学与技术学院,广西 南宁 530004)
随着地球上不可再生资源的日益枯竭以及化石燃料的应用对环境所造成的污染,利用农林废弃物等生物质生产燃料乙醇具有积极意义[1-2]。广西木薯种植面积、产量占全国总产量60%以上,位居全国第一。广西木薯淀粉加工厂每年生产淀粉约50 万吨,产生湿木薯渣(Cassava Residue,CR)约100 万吨[3],木薯渣中含有大量的淀粉、纤维素、半纤维素和少量的木素[4],其组分满足木质纤维素生物质精炼燃料乙醇的要求。木质纤维素类生物质生产燃料乙醇过程包括预处理、酶解、水解液发酵及产品的分离等过程[5]。理想的预处理能够提高酶解效率,降低生产成本[6-7]。目前常见的预处理工艺有水热预处理、稀酸预处理、蒸汽爆破预处理、弱碱性亚硫酸盐预处理等[8-9]。
酸预处理工艺是用于破坏木质纤维素基质最常用的技术[10]。由于木薯渣中含有的木质素较少,因此无需进行复杂且耗能大的预处理,使用超低浓度的酸即超低酸(Ultra-Low-Acid,ULA)预处理木薯渣应该是可行的。文献报道[11-13],利用0.01%~0.14%(w/w)H2SO4预处理生物质,不仅能获得较高的糖得率而且会减少单糖向发酵抑制物的转化生成,还具有对设备要求低、环境污染小、后期预处理液处理简单等优点。
木质纤维素乙醇发酵生产成本过高的原因之一在于纤维素酶高昂的价格[14],酶的成本占纤维素乙醇生产成本的40%~50%,因此回收及重复利用纤维素酶对于提高木质纤维素酶解效率,降低纤维素乙醇生产成本具有重要意义。
基于此,本文以ULA 预处理后的木薯残渣预处理液为基质,采用分步糖化发酵工艺,优化酶解工艺和发酵条件,开展木薯渣超低酸预处理发酵乙醇研究,同时探究固体残渣附着纤维素酶的回收再利用以及回用过程中抑制物浓度变化对发酵的影响。
1 实验
1.1 材料
实验原料为木薯渣,来源于广西明阳生化科技有限公司,是生产木薯淀粉后的废弃物,风干粉碎过40~60目筛网,密封保存;纤维素酶(Cellic CTec2),购于诺维信(中国)生物技术有限公司,酶活106 FPU/mL;D-葡萄糖、D-木糖、甲酸、乙酸、5-羟甲基糠醛(5-HMF)、糠醛、乙醇,均为分析标准品,购于上海阿拉丁试剂有限公司;浓硫酸(分析纯),购于天津致远化学试剂有限公司;发酵菌株为酿酒酵母(bio-57391),购于北京百欧博伟生物技术有限公司。
1.2 实验方法
1.2.1 木薯渣ULA 预处理
取1.5 g 绝干木薯渣(CR)与30 mL 0.17%(w/w)硫酸溶液(固液比为1∶20)混合到50 mL 容量的高温高压反应釜(五洲鼎创(北京)科技有限公司,WZ)中,反应压力为4 MPa,搅拌速度为250 r/min,预处理温度为160℃,预处理时间为22 min。反应结束后,立即用冰水快速降温。用真空抽滤装置分离反应后的固液组分,预处理液体用高效液相色谱(HPLC)测定其中的葡萄糖、木糖、甲酸、乙酸、5-HMF和糠醛;预处理残渣(记为CRULA)60℃烘干密封保存,用于酶解、组分测定和结构表征分析等。
1.2.2 预处理残渣的酶解
1.2.2.1 木薯残渣酶水解
在50 mL 批量具塞锥形瓶中分别加入0.5 g 绝干CRULA,用预处理液(pH=4.8)调节pH 值。纤维素酶水解只考察固液比为1∶15 的最佳酶用量,实验条件为50℃、pH 4.8,加入不同体积的纤维素酶(酶用量为20、40、50、60、70 FPU/g底物,水解3、6、12、24、36 和48 h 后取样。样品水浴灭活后10 000 r/min下离心8 min,取上清液稀释后用HPLC 测定葡萄糖浓度。
1.2.2.2 底物浓度对酶水解木薯残渣的影响
纤维素酶用量为70 FPU/g底物,其固液比分别为1∶15、1∶18、1∶20和1∶25,酶的水解条件与“1.2.2.1”中相应的水解条件一致。水解开始后在3、6、9、12 和24 h 分别取样、检测。
1.2.3 发酵种子液制备
斜面培养基(g/L):葡萄糖20,蛋白胨20,酵母提取物10,琼脂20,自然pH,115℃高压蒸汽灭菌20 min。
种子液制备:在250 mL 的锥形瓶中加入50 mL 无菌液体培养基(成分同斜面培养基,但不加琼脂,115℃灭菌20 min),从种子斜面中取菌落接种到培养基,于30℃、200 r/min 恒温振荡培养18 h,此记为活化第一代。取第一代的菌体50 μL 加入50 mL 液体培养基中,在30℃、200 r/min 下培养18 h,此记为活化第二代。在无菌的条件下,将第二代的菌液于4℃、10 000 r/min 离心5 min,倒掉上清夜;然后用无菌水将菌体重悬洗涤一次,再次离心;最后加入无菌水配置成0.1 g/mL 菌液作为发酵种子液备用。
1.2.4 乙醇发酵实验
发酵实验采用分步糖化发酵工艺进行。用厌氧瓶收集酶解上清液,再向其中加入发酵所需其他物质[15](硫酸铵2 g/L,一水硫酸锰0.01 g/L,磷酸氢二钾0.5 g/L,碳酸钙4 g/L,玉米浆干粉10 g/L),调节pH值为5,115℃高压蒸汽灭菌20 min,制备成酶解液发酵培养基。将制备好的酿酒酵母发酵种子液以10%(V/V)的接种量接种到酶解液发酵培养基中,然后在30℃,150 r/min 的恒温振荡箱中进行反应,分别在一定时间取样,样品在4℃、10 000 r/min 下离心8 min,取少量稀释酸化后用HPLC 测定乙醇和葡萄糖浓度。并以葡萄糖发酵培养基为对照。
1.2.5 附着纤维素酶的再利用实验
为了充分利用吸附在木薯残渣表面的纤维素酶,降低酶解反应的成本,进行了木薯残渣附着纤维素酶的再利用研究。
1.2.5.1 新鲜纤维素酶的补加量对后续酶解反应的影响
RUN 1 是木薯残渣按照“1.2.2.1”的方式进行酶解。RUN 2 操作步骤为:RUN 1 的水解液在10 000 r/min下离心8 min,分离出残渣和上清液。将残渣加入50 mL 具塞锥形瓶中,再向瓶中加入0.5 g 新鲜CRULA。RUN 2 纤维素酶的酶解反应条件为:固液比1∶15,酶解温度50℃、转速150 r/min,纤维素酶的补加量分别为0%、30%、60%、90%和100%(100%为纤维素酶70 FPU/g底物)。水解12 h 后取样,HPLC 测定葡萄糖浓度,用DNS 法测定总糖浓度。最终确定新鲜纤维素酶的最佳添加量。
1.2.5.2 固体残渣附着纤维素酶的再利用实验
反应底物为0.5 g 绝干CRULA和每次酶解循环离心后剩余的固体残渣,拟将附着在剩余残渣上的酶循环至下一个酶解体系中。反应条件:固液比1∶15,50℃、150 r/min 下反应12 h。酶液使用情况为:RUN 1为纤维素酶70 FPU/g底物,之后每个循环纤维素酶的补加量以10%减少。将RUN 1 和RUN 5 的酶解上清液用于发酵乙醇,探究抑制物对发酵的影响。附着纤维素酶再利用示意图如图1 所示。

图1 附着纤维素酶再利用示意图
1.3 分析方法
1.3.1 化学组分分析
木薯渣和预处理残渣中糖、木素等组分按照美国可再生能源中心的方法测定[16];淀粉含量的测定按照GB 5009.9-2016 中的酶水解法进行测定。
1.3.2 DNS 法测定总糖
取稀释到合适倍数的样品1.5 mL(以去离子水作空白对照)和3 mL 3,5-二硝基水杨酸溶液(DNS)于25 mL 的比色试管中,振荡均匀后,沸水浴加热5 min,流水冷却室温后,加去离子水定容到25 mL,充分摇匀后在540 nm 波长下测定其吸光度,根据葡萄糖的标准曲线计算总糖浓度。
1.3.3 HPLC 测定葡萄糖
采用Agilent 1260 Infinity Ⅱ系统,分离柱Bio-Rad®Aminex HPX-87H(300×7.8 mm),柱温50℃,检测器为RID,检测温度40℃,流动相5 mM H2SO4,流速0.6 mL/min,进样量20 μL,运行时间35 min[17]。
1.3.4 甲酸、乙酸和乙醇的测定
同HPLC 测定葡萄糖的方法一致。
1.3.5 5-HMF 和糠醛的测定
采用Agilent 1260 Infinity Ⅱ系统,分离柱Agilent®ZORBAX SB-C18(250 mm×4.6 mm×5 μm),柱温30℃,检测器为UV,波长为285 nm,流动相为甲醇∶1%醋酸=10∶90,流速1 mL/min,进样量10 μL,运行时间35 min[18]。
1.3.6 酶解液和乙醇发酵的计算
葡萄糖得率计算:

式中,Y1表示葡萄糖的得率,m1表示水解液中葡萄糖的质量,m0表示原料木薯渣中的葡萄糖质量。
乙醇得率计算:

式中,Y2表示乙醇得率,mi表示发酵产生的乙醇质量,mj表示发酵体系葡萄糖消耗的质量。
2 结果与讨论
2.1 木薯渣组分分析
根据课题组前期的研究结果[11],本研究所采用ULA 预处理工艺条件为160℃、22 min、0.17%(w/w)硫酸浓度。木薯渣的主要成分见表1,淀粉和纤维素的含量比较高。经过ULA 预处理后,淀粉和纤维素含量分别从36.84%和22.15%降到2.99%和20.27%,降解率分别为91.88%和8.49%,测得预处理液中含有19.54 g/L 的葡萄糖,而发酵抑制物甲酸、乙酸、5-HMF 和糠醛的浓度分别为0.281、0.101、0.032 和0.048 g/L,抑制物浓度远低于乙醇发酵最低抑制浓度[19-20]。说明相对于纤维素而言,淀粉对于酸很不稳定,在ULA 预处理过程中,淀粉大部分降解,因而水解液中葡萄糖浓度比较高,由于采用ULA 预处理的条件比较温和,糖类降解程度比较小,发酵抑制物浓度很低,因此预处理液可以用于酶解糖化。

表1 ULA 预处理前后木薯渣组分含量
2.2 木薯残渣酶解条件优化
纤维素酶用量是酶解糖化的决定性因素,也是影响生产成本的主要原因。因此实验对纤维素酶的加入量进行了初步选择,结果如图2a 所示。在固液比1∶15,50℃酶解24 h 条件下,考察不同加酶量对酶解效率的影响。随着纤维素酶载量的增加,酶解时间的延长,酶解得到的葡萄糖浓度越高。当纤维素酶载量为70 FPU/g底物时,酶解12 h 的葡萄糖浓度为47.2 g/L,24 h 时葡萄糖浓度为48.5 g/L;而当纤维素酶载量为60 FPU/g底物时,酶解12 h 的葡萄糖浓度为43.8 g/L,24 h 时葡萄糖浓度为45.4 g/L。考虑到酶的成本和时间因素,故最佳纤维素酶的添加量为70 FPU/g底物,酶解时间为12 h。
为了提高发酵乙醇蒸馏的经济性,发酵是要尽可能提高培养基中基质浓度。但过高的基质浓度会导致传质传热不均、溶氧困难等问题[21-22],影响发酵过程,因此合适的底物浓度显得十分重要。在纤维素酶载量70 FPU/g底物,温度50℃条件下水解24 h,考察不同固液比对于酶水解效率的影响,结果如图2b 所示,随着底物浓度的增加,葡萄糖浓度也随之增加,当固液比为1∶15 时,12 h 葡萄糖浓度为47.2 g/L,同时考虑到后续附着酶的回用次数、传质效率和发酵所需的葡萄糖浓度,故选择固液比为1∶15 作为最佳的底物浓度。综上,CRULA酶解反应的最佳条件为:纤维素酶的添加量为70 FPU/g底物、固液比为1∶15,酶解时间为12 h。
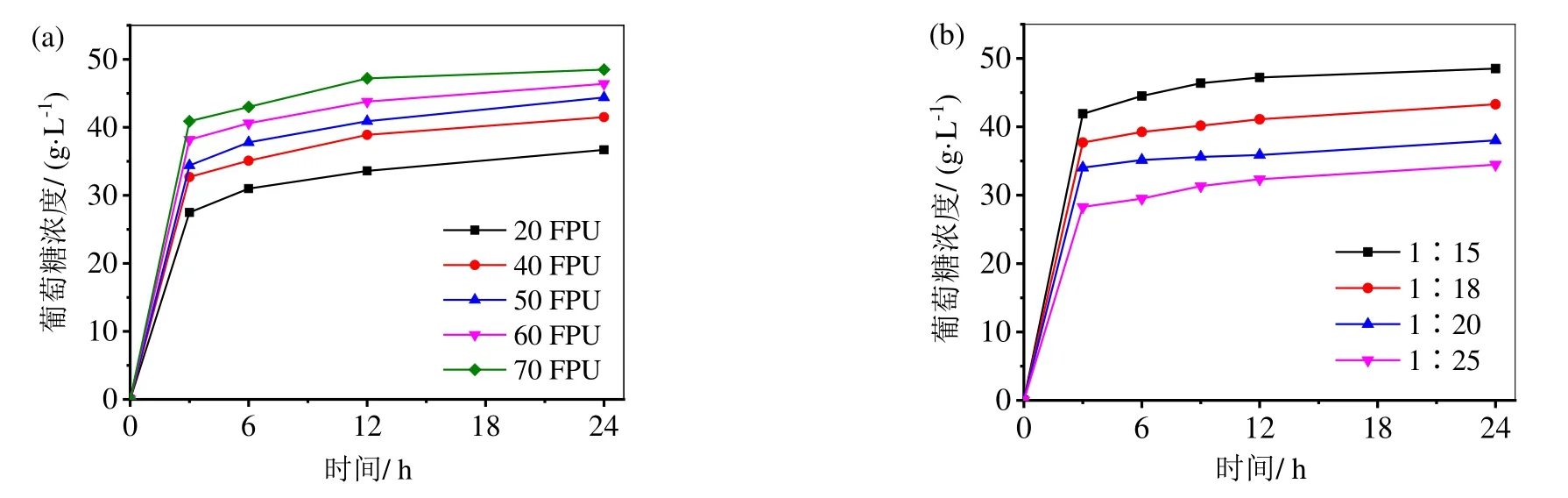
图2 CRULA 酶解反应条件的优化
2.3 预处理对酶水解效率的影响
在最优酶解条件下,对比CR 和CRULA的酶解反应,结果如图3 所示。从图3 可以看出,预处理后的木薯残渣酶解得到的葡萄糖浓度大于未预处理的,且酶解反应12 h 时,CR 葡萄糖得率为51.22%,CRULA葡萄糖得率为80.64%,显而易见,预处理后酶解葡萄糖得率得到提高。再次表明ULA 预处理是一种有效破坏CR 紧密结构从而提高其酶解葡萄糖得率的方法。
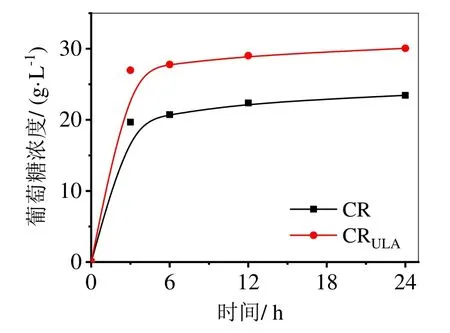
图3 ULA 预处理对木薯渣酶水解的影响
2.4 纤维素酶再利用中酶添加量的优化
为了降低生产成本,充分利用酶解残渣吸附纤维素酶,将酶水解后离心后得到的残渣用于下一次循环的酶解过程,拟减少每次循环酶解时新鲜纤维素酶的添加量。为确定新鲜酶的加入量,以RUN 1(新鲜酶用量为100%)的糖浓度为标准,探索酶再利用过程中RUN 2 新鲜纤维素酶的最佳添加量,结果见图4 所示。当实验中补加新鲜纤维素酶的剂量分别为0%、30%、60%、90%、100%时,所得的葡萄糖和总糖浓度。当不外加新鲜的纤维素酶(0%),只利用附着在酶解残渣上附着的纤维素酶进行酶解时,测得葡萄糖和总糖浓度分别为35.33 g/L 和50.81 g/L,这表明附着在残渣上的纤维素酶对底物有酶解作用。随着新鲜纤维素酶添加量的增加,酶解得到的糖浓度逐渐接近RUN 1 的量,当新鲜酶添加量为90%,得到葡萄糖和总糖浓度分别为47.68 g/L 和62.11 g/L,与RUN 1 得到的糖浓度(葡萄糖47.22 g/L,总糖60.61 g/L)相似,因此,可以确定附着在残渣上的纤维素酶起到10%的酶解效能。由此,每个循环以10%来减少新鲜纤维素酶的添加量。

图4 纤维素酶再利用过程酶添加量的优化
2.5 附着酶再利用次数对CRULA 酶解的影响
按照优化的酶加入量,进行了5 次酶解残渣附着纤维素酶再利用实验。结果如图5 所示,RUN 1、RUN 2和RUN 3 的糖浓度逐渐微量增加,但从RUN 4 开始糖浓度有所减少,RUN 5 葡萄糖和总糖浓度分别为48.00 g/L 和60.92 g/L,但仍高于RUN 1 的47.22 g/L 和60.61 g/L。原因可能是随着附着酶回用次数的增加,前几次酶解剩余残渣累积到后续循环中,造成其底物浓度增加,影响了酶解过程的传质效率,致使糖浓度略微下降。从RUN 5 获得的糖浓度与RUN 1 相似来看,表明固体附着纤维素酶五次循环再利用是可行的,既能满足糖的浓度又能减少新鲜酶的添加量,新鲜纤维素酶添加量从RUN 1 的100%降低至60%,节省了40%的新鲜酶,大大降低了酶的成本。
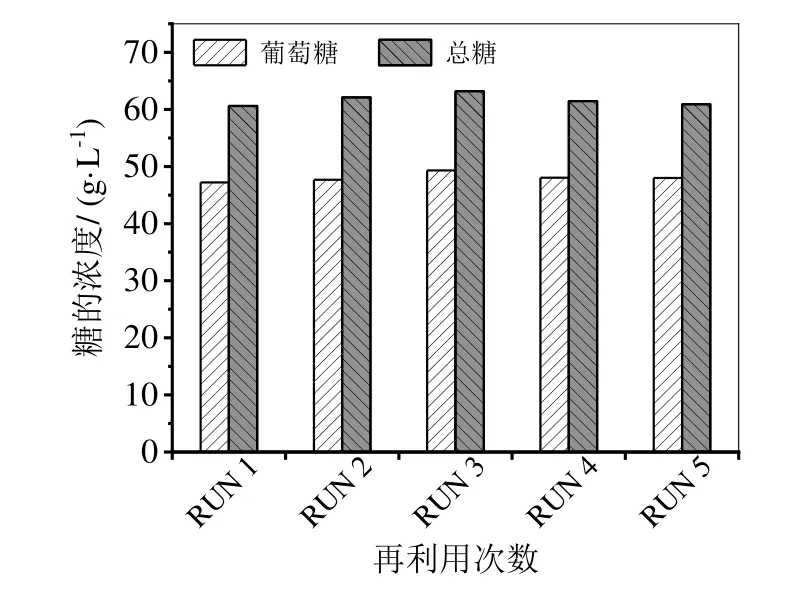
图5 固体附着纤维素酶再利用循环次数对木薯残渣水解效率的影响
2.6 附着酶再利用次数对抑制物的影响
为了进一步考察附着纤维素酶再利用过程对抑制物浓度的累积情况,测定了RUN 1 至RUN 5 酶水解液中甲酸、乙酸、5-HMF 和糠醛浓度,结果见图6 所示。随着附着酶再利用循环次数的增加,乙酸、5-HMF和糠醛浓度逐渐增加,RUN 5 的乙酸、5-HMF 和糠醛分别为0.599、0.034 和0.044 g/L,从RUN 1 到RUN 5分别增加了7.06%、17.53%和30.27%,而RUN 5 甲酸为0.240 g/L,回用时含量基本没有变化。以上数据表明在酶解残渣附着酶回用时,抑制物会随着残渣被带入到下一次循环中,致使抑制物累积增加,但是由于这些抑制物的浓度很低,对发酵过程没有抑制作用。资料表明[19-20],甲酸、乙酸、5-HMF 和糠醛对发酵的抑制浓度分别为9.2、12、5 和2 g/L。木薯渣采用超低酸预处理条件温和,抑制物浓度很低,非常有利于残渣附着酶的回用。

图6 固体附着纤维素酶再利用循环次数对抑制物浓度的影响
2.7 酶水解液的发酵
以纯葡萄糖发酵培养基为对照组,使用酵母(bio-57391)评估酶解液发酵乙醇的可行性,同时探究酶解液中抑制物对发酵的影响,结果见图7a 和7b 所示。在发酵初期,纯葡萄糖培养基和酶解液产乙醇的速率有较大差异,由表2 可知,酶水解液在6 h 和12 h 内乙醇产生速率分别为0.14 和0.35 g/(L·h),而纯葡萄糖发酵培养基的则分别为1.64 和1.61 g/(L·h),纯葡萄糖发酵乙醇速率远大于酶解液1,表明在发酵前期,酶解液中的抑制物对发酵速率有抑制作用。从图7b 和7c 中可知,纤维素酶回用实验所得酶解液(酶解液5)在6 h 和12 h 内乙醇产生速率分别为0.12 和0.23 g/(L·h),低于酶解液1 的乙醇产生速率,这表明附着酶回用五次后由于抑制物浓度的累积对发酵的抑制作用加大。发酵24 h 后,酶解液1 和酶解液5 乙醇浓度达到最大分别为21.67 g/L 和21.52 g/L。理论上1 g 葡萄糖发酵产生0.51 g 乙醇[23],实验中酶解液1 和酶解液5发酵后每克葡萄糖产生的乙醇量分别为0.46 g/g葡萄糖和0.45 g/g葡萄糖,分别为理论乙醇得率的90.21%和88.24%。从图7b 和7d 可以看出,未处理木薯渣得到乙醇最大浓度为10.53 g/L,小于预处理残渣的21.67 g/L,表明ULA 预处理工艺对提高木薯渣乙醇产量具有积极作用。
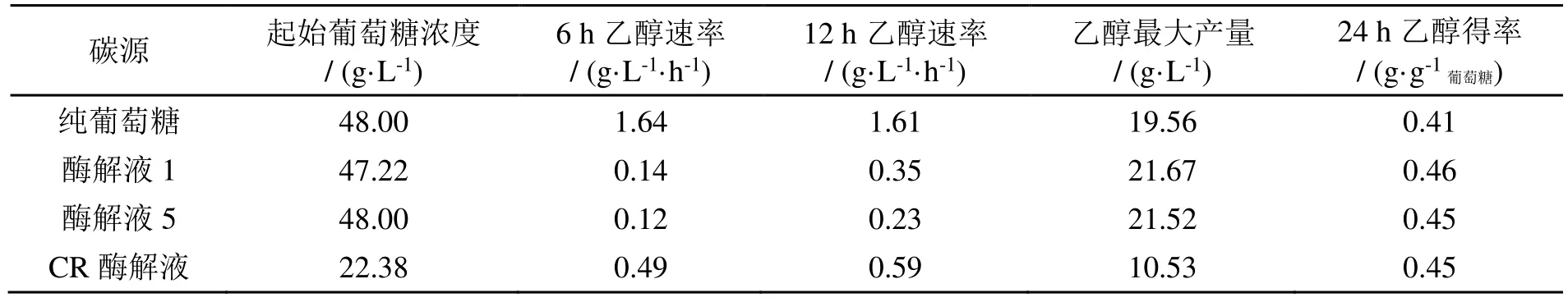
表2 酿酒酵母利用酶解液1、酶解液5、CR 酶解液和纯葡萄糖(对照)发酵生产乙醇
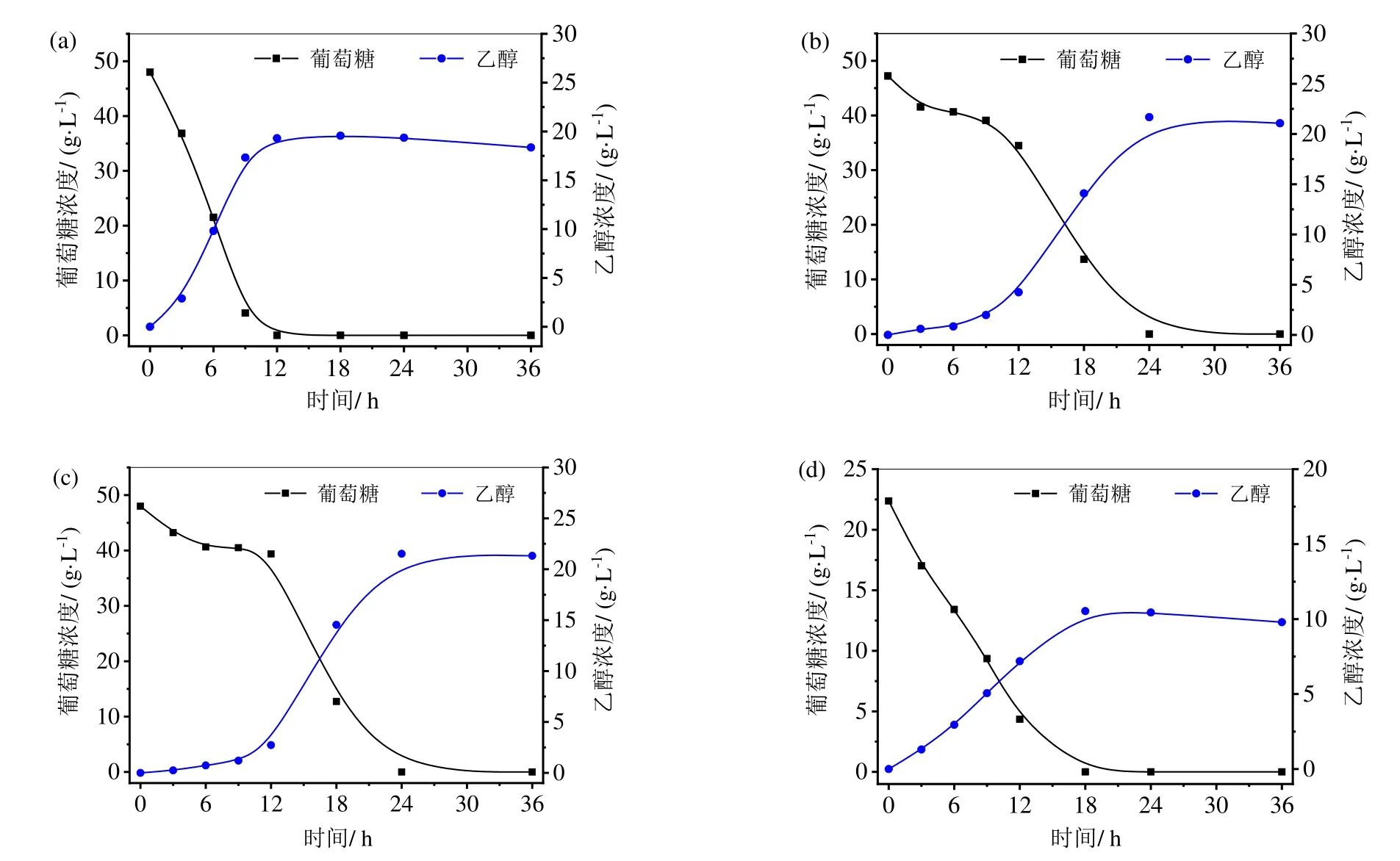
图7 木薯残渣酶解液1、酶解液5、CR 酶解液以及纯葡萄糖(对照)发酵生产乙醇
2.8 物料平衡分析
图8 为最佳工艺条件下预处理木薯渣、酶解以及发酵产乙醇的物料平衡分析。从图8 可以看出,100 g木薯渣中含有65.54 g 葡萄糖,经 0.17%(w/w)H2SO4,160℃下预处理22 min,预处理液中含35.17 g 葡萄糖,残渣中剩余25.85 g 葡萄糖,故经过预处理后预处理液中葡萄糖得率为53.66%;将预处理残渣与639 mL 的预处理液(含有12.48 g 葡萄糖)按照固液比1∶15 进行酶解反应,得到30.16 g 葡萄糖,表明残渣酶解后得到17.68 g 葡萄糖,故经过预处理和酶解后葡萄糖总得率为80.64%。再将酶解液按照10%(V/V)接种量接入酿酒酵母进行发酵,得到乙醇产率为13.84%,与陈红梅等[24]用H2SO4催化和自催化乙醇法预处理麦秆后发酵生产乙醇的得率(10.4%和11.6%)结果接近,表明ULA 预处理木薯渣生产乙醇的技术路线是可行的。

图8 最佳工艺条件下ULA 预处理木薯渣、酶解以及发酵产乙醇的物料平衡分析
3 结论
1)木薯渣超低酸预处理后的残渣CRULA酶解实验可知:纤维素酶70 FPU/g底物、固液比1∶15 和酶解时间12 h 的最优预处理条件下,酶解后葡萄糖得率为80.64%,比未经预处理的木薯渣酶解糖化效率(51.22%)好;以CRULA和部分预处理液的酶解液为发酵培养基进行乙醇发酵,乙醇最大浓度为21.67 g/L,乙醇得率为0.46 g/g葡萄糖,为理论乙醇得率的90.21%,乙醇产率为13.84%。
2)对固体残渣附着纤维素酶再利用实验结果表明,附着酶循环五次,第五次循环(RUN 5)得到的糖浓度与RUN 1 相似,纤维素酶的加入量可以从70 FPU/g底物(RUN 1)下降到42 FPU/g底物(RUN 5),节省了40%的新鲜纤维素酶;附着酶再利用时抑制物乙酸、5-HMF 和糠醛的浓度有小幅增加,但未对发酵过程有影响。

