HPLC-MS/MS法同时测定人血浆中利培酮和帕利哌酮的浓度
何秀玲,谭金华,宋天云,唐霞,夏小容,温预关(.暨南大学附属江门中医院Ⅰ期临床研究中心,广东 江门 529000;2.广州医科大学附属脑科医院药学部,广州 50370)
利培酮(risperidone)作为精神分裂症的一线治疗药物,具有较强的中枢5-羟色胺(5-HT)和多巴胺(D2)受体拮抗作用,口服吸收快,椎体外系不良反应发生率较低[1],被临床广泛使用。帕利哌酮是利培酮经细胞色素P450(CYP)同工酶代谢后的活性产物,有研究表明CYP2D6是利培酮最主要的代谢酶,其代谢表型分为超强代谢型、强代谢型和弱代谢型,利培酮在不同的代谢表型人群中的药动学参数有差异[2-3]。德国神经精神药理学与精神病药理学会推荐在使用利培酮、帕利哌酮等药物治疗时进行药物浓度监测[4],制订个体化给药方案,以期提高药物治疗疗效和安全性。目前国内采用HPLC-MS/MS法测定人血浆中利培酮和帕利哌酮的报道较少,现有的研究方法存在样品前处理复杂、分析时间较长、基质效应明显、定量限过高等不足[5-6]。为此,本研究在已有文献[7-9]的基础上,采用稳定同位素作为内标,建立同时测定人血浆中利培酮和帕利哌酮的方法,并进行方法学验证。
1 仪器与试药
1.1 仪器
LC-30AD高效液相色谱联用质谱仪Triple Quad TM 5500(日本岛津公司)和Applied Biosystems/(Sciex公司);XW-80A型旋涡混合器(原上海医科大学仪器厂);Milli-Q超纯水系统(美国Millipore公司);BP110S型电子分析天平(德国Sartorius公司);LC-456R型低速冷冻离心机(安徽中佳科学仪器有限公司);100~1000 μL手动移液器(Thermo公司)。
1.2 试药
利培酮对照品(批号:20180918,纯度:99.9%,中国食品药品检定研究院);帕利哌酮对照品(批号:20181015,纯度:99.6%,USP);内标:利培酮-d4(批号:20190220)、帕利哌酮-d4(批号:20190324)(TPC公司);甲醇、乙腈(色谱纯,德国Merk公司);甲酸(色谱纯,Adamas公司);醋酸铵、英脱利匹特-20%(Sigma公司);水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱为Waters Atlantis T3(2.1 mm×50.0 mm,5.0 µm),预柱型号:Security Guard Cartridges C18(4 mm×2.0 mm,Phenomenex);流动相A为含0.1%甲醇和5.00 mmol·L-1醋酸铵的水溶液,B为含0.1%甲醇的乙腈,梯度洗脱(0~3 min,22%B,3.0~3.1 min,22%~90%B;3.1~3.6 min,90%B;3.6~3.7 min,90%~22%B;3.7~5.0 min,22%B);流速为 0.4 mL·min-1。
2.2 质谱条件
电喷雾离子源(ESI),喷雾电压(IS)为4000 V,涡旋离子喷雾温度为550℃,气帘气(Cur)为35 psi(1 psi=6.895 kPa),雾化气(Gas1)为50 psi,辅助加热气(Gas2)为50 psi,碰撞气(CAD)为9 Unit,正离子多离子反应检测(MRM)。利培酮和帕利哌酮的定量离子对分别为m/z411.2→191.1和m/z427.0→207.0,去簇电压(DP)分别为95 V、100 V,入口电压(EP)均为10 V,碰撞能(CE)分别为39 V、35 V,内标利培酮-d4定量离子对为m/z415.2→195.1,帕利哌酮-d4定量离子对为m/z431.2→211.1。其二级质谱子离子扫描见图1。
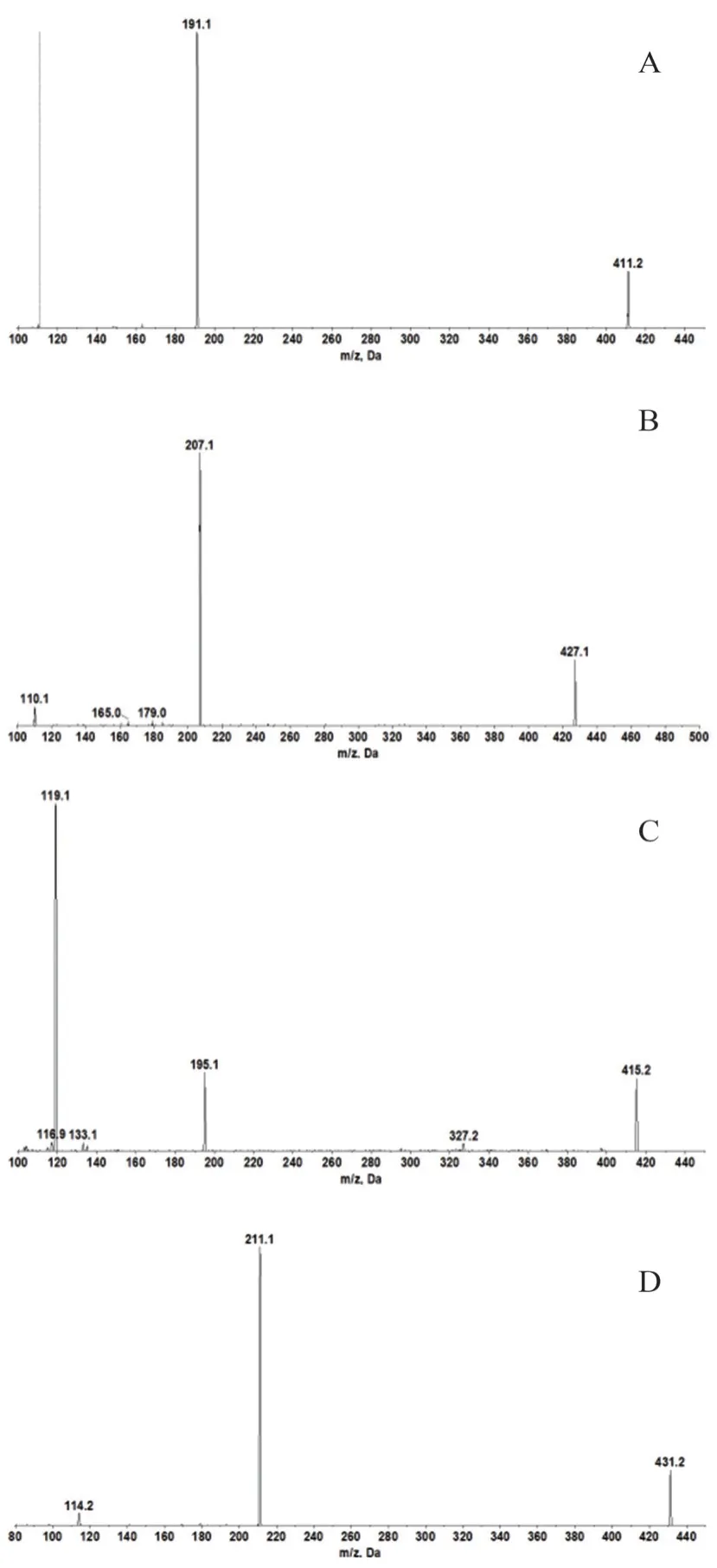
图1 利培酮(A)、帕利哌酮(B)、利培酮-d4(C)和帕利哌酮-d4(D)的二级质谱子离子扫描图Fig 1 Secondary mass spectrum product ion scan of risperidone(A),paliperidone(B),risperidone-d4(C)and paliperidone-d4(D)
2.3 对照品溶液和内标溶液的制备
2.3.1 对照品溶液的制备 用甲醇溶解利培酮和帕利哌酮对照品,得到0.500 mg·mL-1的对照品储备液。储备液存于透明玻璃瓶,在-20℃条件下长期保存。
2.3.2 内标溶液的制备 用甲醇溶解利培酮-d4对照品(2.5 mg/支)和帕利哌酮-d4对照品(1 mg/支),得到2.00 mg·mL-1的利培酮-d4储备液和1.00 mg·mL-1的帕利哌酮-d4储备液。储备液存于透明玻璃瓶,在-20℃条件下长期保存。
2.4 血浆样品处理
取50.0 μL的血浆样品加入预先加了内标工作溶液50.0 µL的96孔板,将96孔板振摇约1 min,再加入200 µL的甲醇,振摇约10 min,室温条件下4000 r·min-1离心10 min,取100 µL上清液转移至干净的96孔板中,用200 μL超纯水稀释,将96孔板充分振摇10 min后置于自动进样器进行HPLC-MS/MS分析。
2.5 方法学验证
2.5.1 专属性 取来自不同健康者的空白血浆6份,其中3份加入0.500 mg·mL-1的储备液和内标溶液,其中3份不做处理,除不加内标按“2.4”项下方法处理,进行分析,得色谱图2A、B;取服用利培酮剂量2 mg患者的血浆样品,按“2.4”项下方法处理,进行分析,得色谱图2C。利培酮和利培酮-d4的保留时间约为1.9 min,帕利哌酮和帕利哌酮-d4的保留时间约为1.4 min。在分析物和内标相应保留时间的地方,无干扰峰出现。血浆中无内源性物质干扰测定,专属性强。
2.5.2 标准曲线及定量限 将“2.3”项下配制好的溶液分别加入到空白血浆中制备成质量浓度为利培酮0.0500(LLOQ)、0.100、0.500、1.00、3.00、5.00、15.0、30.0 ng·mL-1;帕利哌酮0.0500(LLOQ)、0.100、0.500、1.00、3.00、5.00、10.0、15.0 ng·mL-1的溶液。按照“2.4”项下方法处理后进样,以分析物质量浓度为横坐标,分析物与内标物的峰面积比值为纵坐标,用加权(W=1/χ2)最小二乘法进行回归运算,得利培酮回归方程:y=0.9121x+0.001 274(r=0.9985),定量限为0.05 ng·mL-1,在0.05~30 ng·mL-1与峰面积线性关系良好;帕利哌酮回归方程:y=0.9495x+0.015 92(r=0.9983),定量限为0.05 ng·mL-1,在0.05~15 ng·mL-1与峰面积线性关系良好。
2.5.3 回收率及精密度试验 将定量限、低、中和高质量浓度质控工作溶液各6份分别与空白血浆涡旋混匀,按“2.4”项下方法处理后进样,连续测定3批,计算批内、批间的准确度与精密度。同法以空白血浆、除不加标准系列溶液和内标外,按“2.4”项下方法处理后,再加入相应质量浓度的利培酮和帕利哌酮,以0.2 mL流动相溶解,离心后取2 μL进样,以每一浓度两种处理方法的峰面积比值计算提取回收率,结果见表1。
2.5.4 基质效应 收集6个不同来源的空白人血浆,各取0.1 mL空白血浆,加入低、中、高质量浓度的工作液5 μL和内标20 μL,混匀,每个浓度平行制备3份。通过计算基质存在下的峰面积(由空白人血浆提取后加入待测物和内标测得),与不含基质的相应峰面积(待测物和内标的纯溶液)比值,计算每一待测物和内标的基质因子。进一步通过待测物的基质因子除以内标的基质因子,计算经内标归一化的基质因子。结果利培酮低、中、高3个质量浓度水平的内标归一化因子的RSD在1.7%~4.5%,帕利哌酮在2.0%~5.2%,基质效应对浓度测定的干扰极小,可忽略不计。
2.5.5 溶血效应和高脂效应 将2%的冷冻后全血加入空白基质中得到溶血基质,将一定比例的脂肪乳(脂含量为20 mg·mL-1)加入空白基质中得到高脂基质,用溶血血浆和高脂血浆分别配制低、中、高质量浓度的质控样品(每个浓度水平3个重复),处理后进样分析。结果利培酮溶血质控样品平均测定值与其理论值的偏差在1.12%~4.44%,帕利哌酮在2.52%~4.81%,认为在质量浓度测定时溶血和高脂的影响可以忽略不计。
2.5.6 稳定性试验 分别制备低、中、高3种质量浓度利培酮和帕里哌酮血浆样品,考察分别经过室温放置16 h、-70℃冻融5次和-70℃冻存61 d处理后血浆样品的稳定性。得到利培酮和帕里哌酮血浆样品的准确度均在±15%,稳定性符合相关要求,结果见表2。
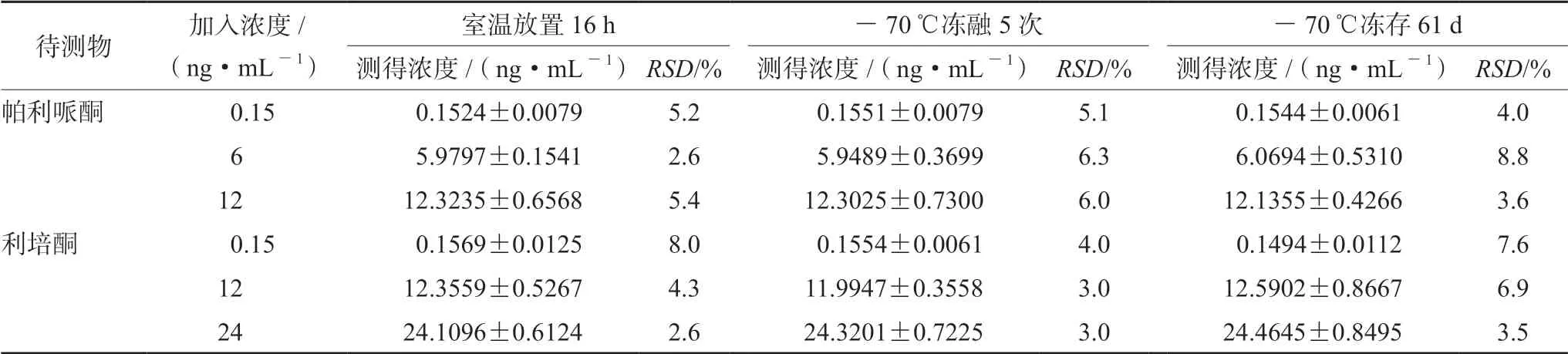
表2 血浆中帕利哌酮和利培酮的稳定性(n=6)Tab 2 Stability of paliperidone and risperidone in the plasma (n=6)
2.6 质控药品的监控
按“2.5.2”项下方法分别配制低、中、高3种质量浓度血浆样品,置-20℃冻存,备用,作为质控样品。制作随行标准曲线及检测低、中、高3种质量浓度双份质控样品,如果相对回收率均在85%~115%(低浓度可在80%~120%),即可认为仪器检测正常,否则须检查整个操作过程以及仪器原因。本文的结果符合相关要求。
2.7 药动学应用
6名健康受试者,男女各半,体质量(54.33±7.76)kg,年龄(30.33±7.06)岁,身高(168.08±7.09)cm。试验采用2周期的二重2×2拉丁方自身对照试验设计,6例受试者口服剂量均为2 mg,清洗期14 d。受试者于前一晚开始禁食至少10 h,给药前抽取空白血样4 mL,单次给药用200 mL温水送服,给药后0.25、0.5、0.75、1、1.5、2、4、6、8、12、24、48、72、96 h分别采集静脉血4 mL,装入肝素钠试管,3000 r·min-1离心10 min后,分离血浆,置-70℃储藏备用,测定后计算得主要药动学参数见表3。
表3 6名健康受试者口服利培酮2 mg后的主要药动学参数(±s)Tab 3 Main pharmacokinetic parameters of 6 healthy subjects after the oral administration of 2 mg risperidone (±s)
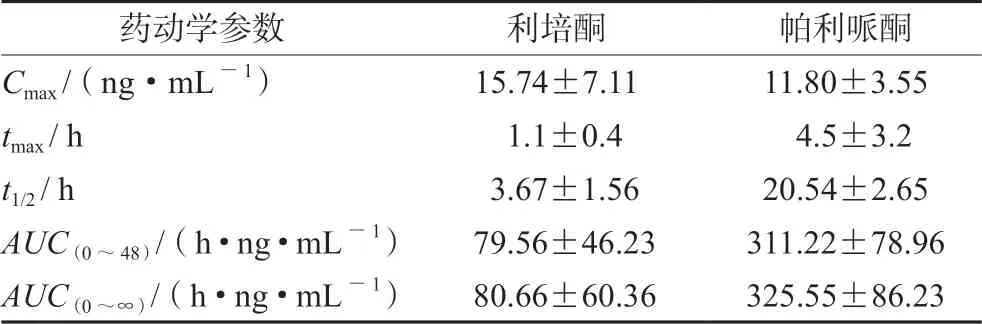
表3 6名健康受试者口服利培酮2 mg后的主要药动学参数(±s)Tab 3 Main pharmacokinetic parameters of 6 healthy subjects after the oral administration of 2 mg risperidone (±s)
药动学参数利培酮帕利哌酮Cmax /(ng·mL-1)15.74±7.1111.80±3.55 tmax / h 1.1±0.4 4.5±3.2 t1/2 / h 3.67±1.5620.54±2.65 AUC(0~48)/(h·ng·mL-1) 79.56±46.23311.22±78.96 AUC(0~∞)/(h·ng·mL-1) 80.66±60.36325.55±86.23
3 讨论
本研究曾选用ESI-MS,参照文献[2]采用甲醇直接沉淀蛋白的方法处理血样,但是方法学考察发现存在一定的基质效应。基质效应主要是由血浆内源性极性物质引起,在高比例有机相等度洗脱时,内源性物质和药物出峰时间较近,基质效应较为明显[10]。而在梯度洗脱方法研究中,首先采用较低比例的有机相冲洗,让极性物质先流出色谱柱,保证了极性物质和药物先后流出,大大降低了基质效应。此外梯度洗脱缩短了分析时间,同时压缩了色谱峰,使得色谱峰尖锐,提高了检测灵敏度。基质效应的消除方法中,使用稳定同位素内标是一个快速而有效的办法[7-9]。本研究选用稳定同位素标记内标,内标同位素纯度均在99%以上,选择合适的内标浓度,可对整个分析环节带来的误差进行有效控制,结果表明内标与分析物直接的交叉信号响应值低。与已有文献相比[1-3],本研究增加了对高脂效应和溶血效应的考察,结果两者均不影响浓度的测定,消除了药物临床试验中高脂餐和溶血效应对分析检测的干扰。本研究中利培酮和帕利哌酮LLOQ均为0.05 ng·mL-1,与已有文献[11]相比,方法灵敏度更高,能满足临床血药浓度检测和药动学研究。
帕利哌酮是利培酮在体内经CYP2D6和CYP3A酶转化生成的代谢物[12]。有研究表明AUC的个体[2-3]差异大与CYP2D6和ABCB1的基因多态性有关。本研究中利培酮和帕利哌酮的药动学参数AUC的标准差较大,与文献报道一致[11],为后续研究提供依据。

