新型α-葡萄糖苷酶抑制剂YG-18在小鼠体内的降糖作用、分子对接及急性毒性研究
阎成炟,郭崇真,张东虎,赵凌霄,林建阳*(1.中国医科大学附属第一医院药学部,沈阳 110001;2.中国医科大学药学院,沈阳 110122)
糖尿病是一种以高血糖为主要临床特点的常见的慢性内分泌性疾病。国际糖尿病联盟的数据显示,2015年全球糖尿病患病率为8.8%,预计2040年成人糖尿病患病率将上升到10.4%[1]。在我国成年人中,糖尿病的患病率高达11.6%[2],而其中占比非常高的便是2型糖尿病。2型糖尿病,即非胰岛素依赖型糖尿病,是糖尿病最常见的类型,占所有糖尿病病例的90%以上[3]。控制餐后血糖是治疗2型糖尿病的关键。
α-葡萄糖苷酶抑制剂可以抑制小肠刷状缘上的α-葡萄糖苷酶对碳水化合物的转化,从而延缓葡萄糖吸收,降低餐后血糖,在全球被广泛应用于2型糖尿病的一线治疗[4]。此外,除降糖活性,α-葡萄糖苷酶抑制剂还被发现与肿瘤转移[5]、干扰宿主细胞的N-寡糖链生物合成以阻止病毒复制有关[6]。α-葡萄糖苷酶抑制剂具有起效快速且安全性高的特点。目前,在临床上使用的上市药物主要是阿卡波糖(acarbose)、伏格列波糖(voglibose)和米格列醇(miglitol)。传统上对于α-葡萄糖苷酶抑制剂的开发与研究大多基于其拟糖骨架结构,例如亚胺糖、硫糖、二糖等结构[7-8]。然而,传统的研究开发面临着诸多问题,比如活性差、自然丰度低和立体化学过于复杂等[9]。因此,对于非糖α-葡萄糖苷酶抑制剂的开发具有广阔前景[10-11]。
根据前期报道[12],将苯磺酰胺查尔酮结构整合到苯并吡喃中,设计得到的3-[4-(苯基磺酰胺)苯甲酰]-2H-1-苯并吡喃-2-酮结构,具有成为非糖α-葡萄糖苷酶抑制剂的巨大潜力。在前期研究中,该系列化合物中体外活性最强的化合物YG-18(如图1)的半数抑制浓度(IC50)为(0.014±0.003)μmol·L-1,高于阳性对照药物阿卡波糖。为了探究该药物在体内的降低糖负荷后的血糖药效和作用机制、药物与酶活性部位可能的相互作用模式与安全性,本研究考察了该系列化合物中的YG-18在正常大鼠体内对蔗糖和葡萄糖负荷后的影响,并通过分子模拟分析研究了其对α-葡萄糖苷酶的抑制行为。最后,根据OECD急性毒性实验指导原则[13]观察了该药物单次口服4 h、48 h和14 d的毒性反应、脏器情况和存活状态的急性经口毒性。
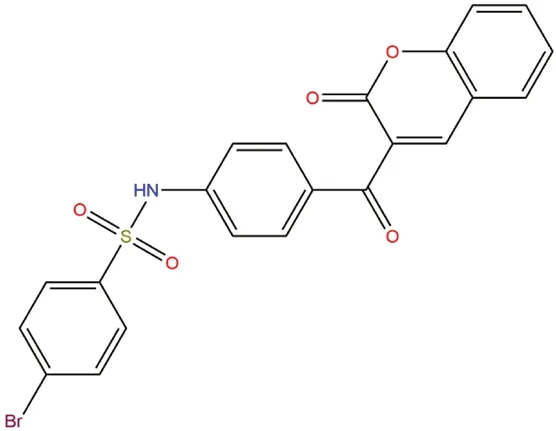
图1 YG-18的化学结构Fig 1 Chemical structure of YG-18
1 材料
1.1 试药
YG-18(沈阳药科大学药物化学教研室,纯度≥ 98.0%);阿卡波糖(艾览化工科技有限公司);二甲基亚砜(DMSO,天津市大茂化学试剂厂);聚氧乙烯蓖麻油EL、甘油(上海阿拉丁生化科技股份有限公司);纯净水(杭州娃哈哈集团有限公司);蔗糖、葡萄糖等试剂均为分析纯。
1.2 仪器
One Touch Ultra Vue血糖仪[强生(中国)医疗器材有限公司];SQP电子天平(赛多利斯科学仪器有限公司);D3024R离心机(大龙兴创实验仪器股份公司);体重秤(慈溪市天东衡器厂);恒温超声仪(上海柯祁仪器设备有限公司)。
1.3 实验动物
SPF级ICR小鼠(22~24 g),SPF级KM小鼠(22~24 g)[辽宁长生生物技术股份有限公司,动物生产许可证号:SCXK(辽)2020-0001]。
2 方法
2.1 YG-18单次给药对正常ICR小鼠蔗糖、葡萄糖负荷后血糖影响
小鼠适应性喂养两周后,ICR小鼠48只,随机分为正常组、阳性药物阿卡波糖组(Acar,9.6 mg·kg-1,ig)和YG-18组(7.23 mg·kg-1,ig)[14],每组8只,雌雄各半,每个实验组平行设置两组。其中药物溶媒由0.67% DMSO、5% 聚氧乙烯蓖麻油EL、3% 甘油与生理盐水组成。正常组给予空白溶媒进行灌胃给药。阿卡波糖组、YG-18组灌胃对应的药物。
禁食不禁水12 h后,平行设置的两组小鼠分别灌胃给予蔗糖(4.0 g·kg-1)和葡萄糖(2.0 g·kg-1)负荷,用尾部采血法,通过血糖仪测定空腹血糖及给药后0.5、1、2 h的血糖值,并计算血糖曲线下面积(AUC)。
2.2 分子对接实验
利用Chemdraw 19.0绘制出阿卡波糖与YG-18的化学结构,使用Chem3D 19.0将其转变为3D结构,并对其进行构象的优化。分子对接研究使用Discovery Studio v16.1进行。对接计算采用从PDB数据库中获得的α-葡萄糖苷酶与葡萄糖络合物(PDB代码:3A4A)的晶体结构。去除蛋白质结构中所有的结合水,并将所有的氢原子添进结构中。该蛋白质前期进行制备、优化和能量最小化处理。以α-葡萄糖苷酶共结晶的活性结合位点设置配体对接的空间,采用拉马克遗传算法进行对接实验。对接的多种结合结果中,选取了能量最低的构象为本次实验对药物与酶抑制方式的预测构象。最后,使用Pymol和Discovery Studio v16.1绘制药物与酶结合方式构象。
2.3 急性经口毒性实验
根据OECD急性毒性实验指导原则[13],将50只KM小鼠随机分为4组给药组与1组空白对照组,每组10只,雌雄各半。因YG-18无毒性资料可以参考且水溶性差,故给药组采用的是OECD急性毒性实验指导原则中推荐的175、550、1750、2000 mg·kg-1的序列给药剂量,并使用羧甲基纤维素钠配制混悬液灌胃给药,除限定浓度2000 mg·kg-1外,其余对数剂量间隔1/2。
禁食不禁水12 h后,空白对照组小鼠给予溶媒羧甲基纤维素钠单次灌胃处理,给药组单次灌胃给药处理,每组序贯进行。给药当日连续观察4 h,之后固定时间间隔观察48 h。如果组内死亡小鼠数量大于半数,则降低下一组小鼠给药剂量;如果组内死亡小鼠数量小于半数,则提高下一组小鼠给药剂量。每一组存活动物均观察14 d,后期死亡动物在统计时记为死亡。观察结束后处死小鼠,解剖后观察各组小鼠的器官的形态、颜色、质地等有无明显变化。
2.4 统计学方法
使用SPSS 25.0统计软件进行统计学分析,数据采用均数±标准差(±s)表示,分析模型选取单因素方差分析(one-way ANOVA),P<0.05表示差异有统计学意义,实验中的数据采用Graph Pad Prism 8绘制作图。
3 结果
3.1 YG-18单次给药对正常ICR小鼠口服蔗糖、葡萄糖负荷后血糖水平影响
为了验证YG-18在体外降低餐后血糖的药效和作用机制,选取正常ICR小鼠作为模型,单次给药后,分别记录蔗糖、葡萄糖负荷后的血糖水平的血糖值变化,观察其对血糖的影响,结果见图2。
YG-18在7.23 mg·kg-1的剂量下单次给药能降低正常小鼠蔗糖负荷后血糖的峰值(P<0.05),且YG-18组的血糖浓度-时间曲线下面积显著降低(P<0.001)(见图2A)。而在图2B中,YG-18在7.23 mg·kg-1剂量下单次给药对正常小鼠葡萄糖负荷后的各时间点的血糖和血糖浓度-时间曲线下面积均无明显影响(P>0.05)。

图2 YG-18(7.23 mg·kg-1)对正常ICR小鼠血糖及血糖浓度-时间曲线下面积的影响Fig 2 Effect of YG-18(7.23 mg·kg-1)on the blood glucose and the blood glucose concentration time curve in ICR rats
由此可以证明,新型化合物YG-18的体内降糖作用的靶点为α-葡萄糖苷酶,只能对非单糖转化为葡萄糖产生抑制作用,进而发挥降糖作用,而对直接摄入葡萄糖的血糖变化无法发挥作用。
3.2 分子对接
本次实验分别采用了3D与2D方式展示了药物-酶的结合构象,见图3、4。图3展示了α-葡萄糖苷酶-阿卡波糖之间的相互结合的3D与2D构象,图4展示了α-葡萄糖苷酶-YG-18相互结合的3D与2D构象。结果显示,阿卡波糖与酶结构中GLN 279、GLU 411和ARG442等氨基酸残基形成氢键,氢键也是其与酶结合的主要方式。YG-18可能会与酶结构中的GLN 279、ARG 315、GLU 411、ASN 415和ARG 442氨基酸残基形成氢键;除氢键外,其可能还与ASP 69、ASP 215、GLU 277氨基酸残基形成范德华力。YG-18展现出的α-葡萄糖苷酶抑制活性可能与这样的结合方式有关,且两种药物共同结合的ASP 69、GLU 277、GLN 279、GLU 411、ARG 442等氨基酸残基可能为抑制活性的关键氨基酸。

图3 阿卡波糖-α-葡萄糖苷酶结合体的3D(A)和2D(B)结构Fig 3 3D(A)and 2D(B)structure of acarbose-α-glucosidase
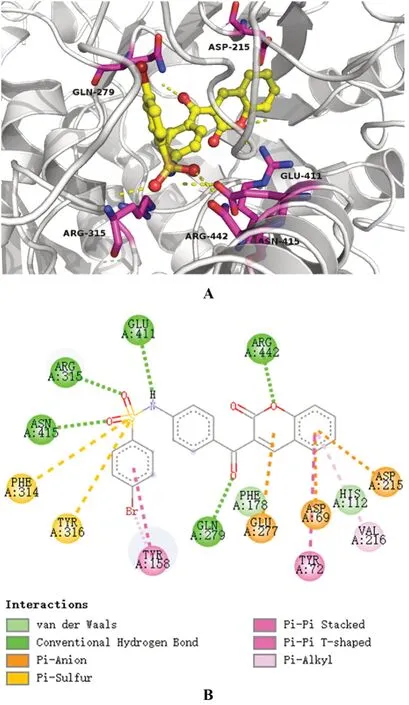
图4 YG-18-α-葡萄糖苷酶结合体的3D(A)和2D(B)结构Fig 4 3D(A)and 2D(B)structure of YG-18-α-glucosidase
3.3 急性经口毒性实验
OECD指导原则下YG-18单次给药的序列剂量中,未能得出该药物的LD50。各给药组给药后4 h内,小鼠开始出现不良反应,主要表现为腹泻,而腹泻为α-葡萄糖苷酶的主要不良反应之一。腹泻在给药后12 h内全部恢复。除腹泻外,各剂量组均无其他不良反应,未出现死亡,根据全球统一毒性分级系统(Globally Harmonized Classification System)分类,YG-18可以被认为是几乎无毒的。
在实验结束后对所有小鼠进行颈椎脱臼处死,解剖后观察,发现各组小鼠除有2只存在肠道梗阻外,其余小鼠器官的形态、颜色、质地都未发现显著异常。根据小鼠发生腹泻的毒性反应推测,该药物的毒性反应主要是通过α-葡萄糖苷酶导致碳水化合物吸收缓慢,从而导致腹泻。
4 讨论
在本次研究中,化合物YG-18降低了蔗糖负荷后正常ICR小鼠的血糖峰值,并明显降低了负荷2 h内的血糖浓度-时间曲线下面积。由此可见,YG-18虽然对于血糖峰值的影响不如阳性对照药阿卡波糖,但是在1 h时的血糖可以控制在与阿卡波糖相同的水平,且2 h内的血糖浓度-时间曲线下面积显著下降。在葡萄糖负荷后,阿卡波糖和YG-18组的血糖均未下降。根据α-葡萄糖苷酶抑制剂的作用特点,这证明YG-18是通过抑制小肠刷状缘上的α-葡萄糖苷酶起到降血糖作用的。
本研究利用α-葡萄糖苷酶共结晶蛋白模型分析了YG-18与α-葡萄糖苷酶相互作用的潜在机制,发现YG-18主要通过氢键、范德华力、π-阴/阳离子、π-π相互作用与α-葡萄糖苷酶结合,而阿卡波糖中主要的相互作用只有氢键和范德华力。两种药物通过不同结合作用共同抑制的氨基酸残基主要有ASP 69、GLU 277、GLN 279、GLU 411、ARG 442等,说明这些氨基酸残基可能是药物对α-葡萄糖苷酶产生抑制作用的关键氨基酸。
在急性经口毒实验中,虽然本次实验未能得出该YG-18的LD50值,但是在2000 mg·kg-1,小鼠在14 d内均未出现死亡及其他毒性反应,各脏器也未出现器质性改变,说明YG-18在2000 mg·kg-1剂量内具有很好的安全性,LD50>2000 mg·kg-1。
在合成工艺方面看来,目前,已上市的α-葡萄糖苷酶抑制剂阿卡波糖的工业合成途径主要为游动放线菌(Actinoplanes spp.)发酵生产[15],由于是微生物途径合成生产,在合成过程中需对菌株选育、发酵条件等条件严格控制,合成工艺非常复杂。与生物合成工艺相比,通过有机化学合成的新型α-葡萄糖苷酶抑制剂YG-18的工艺则较为简单,且后续路线优化过程简便快捷,可以大规模合成,合成纯度也可以保证。所以就合成工艺而言,通过有机化学合成的新型α-葡萄糖苷酶抑制剂具有很大的优势。
有研究表明,α-葡萄糖苷酶抑制剂不仅有降糖作用,还可以通过抑制肿瘤细胞表面N-糖基化蛋白的表达抗癌细胞迁移作用[16];此外,α-葡萄糖苷酶抑制剂还可以通过抑制宿主细胞中参与顺序修建病毒包膜糖蛋白N-连接寡糖的α-葡萄糖苷酶从而抑制病毒的复制,达到抗病毒作用,现在已被证明可以被其抑制的病毒有登革病毒(DENV),黄热病病毒(YFV)和寨卡病毒(ZIKV)等[17-19]。现有已上市的α-葡萄糖苷酶抑制剂吸收均较差,只在肠道内产生局部作用。然而无论是抗肿瘤还是抗病毒作用,仅依靠肠道内的局部作用显然是无法实现的,如新型α-葡萄糖苷酶抑制剂具有较高的生物利用度,可为后续开发研究其体内抗肿瘤、抗病毒作用提供支持。
综上所述,本研究为YG-18的降糖作用、潜在抑制机制和安全性提供了一定的参考和依据,同时也为后续对于3-[4-(苯基磺酰胺)苯甲酰]-2H-1-苯并吡喃-2-酮母核结构的化合物开发更加强效的α-葡萄糖苷酶抑制剂提供了依据。

