顺铂前药及双载药聚乙二醇化脂质体的制备、表征与体外抗肿瘤研究
王咏麒,朱娇娇,储晓婷,张亚超,桂双英,2,李真宝,2*(.安徽中医药大学药学院,合肥 23002;2.安徽省中医药科学院药物制剂研究所,合肥 23002)
顺铂(cisplatin,Pt)作为抗肿瘤药物在各种恶性肿瘤的治疗中发挥至关重要的作用,但因耐药和严重的剂量依赖性,其临床应用受到极大限制[1-2]。研究显示,顺铂的耐药机制源于多因素的细胞改变,包括顺铂的细胞积累减少、含硫醇分子[如抗坏血酸、半胱氨酸、谷胱甘肽(GSH)等]对顺铂的解毒、DNA修复水平升高和自噬诱导等,这些因素导致顺铂对肿瘤细胞的DNA损伤减少,导致治疗效果大大降低[1]。
前药策略是通过化学结构修饰来改善化疗药物的不良性质[3],四价顺铂前药[Pt(Ⅳ)]具有八面体结构,需到达还原环境后被激活释放二价Pt(Ⅱ)片段方可发挥药效[4-6]。与正常细胞相比,肿瘤细胞过量产生GSH(2~10 mmol·L-1),导致肿瘤细胞呈高还原性微环境,近年来研究表明,这些高浓度的GSH能使铂类药物失活[7-8]。下调或消耗胞内的GSH,能够克服顺铂耐药,提高抗肿瘤效果[6,9]。L-丁硫氨酸-亚砜亚胺(L-BSO)是GSH合成过程中的限速酶γ-谷氨酰半胱氨酸合成酶(GCL)的抑制剂,能通过抑制GSH的合成,增加肿瘤细胞对顺铂的敏感性,进而提高治疗效果[10-11]。
近年来,纳米技术在药物传递领域有着广泛的研究,主要是通过制剂学方法延长药物的体内循环时间,进而通过高渗透长滞留(EPR)效应提高药物在肿瘤部位的蓄积,以达到增强抗肿瘤效果的目的[12-13]。其中,聚乙二醇(PEG)化脂质体具有长循环、被动靶向和增加药物稳定性的特点[14],例如阿霉素脂质体(Doxil®)已被应用于临床实践中[15]。为了提高顺铂抗肿瘤效果,本课题构建双载药PEG化脂质体共递送水溶性的Pt(Ⅳ)前药和L-BSO。
1 仪器与试药
1.1 仪器
EX125ZH十万分之一电子天平(常州奥豪斯仪器有限公司);ME204E/02万分之一电子天平(上海梅特勒-托利多国际贸易有限公司);DF-101S集热式恒温加热磁力搅拌器(南京沃中仪器设备有限公司);R201C旋转蒸发器(巩义市英峪高科仪器厂);LF-1脂质体挤出器(加拿大AVESTIN);Zetasizer 3000 HS(英国Malven);JEOL-2010高分辨透射电子显微镜(日本电子);DMi1倒置荧光显微镜(德国Leica);318C+全自动酶标仪(上海赣闽分析仪器有限公司);HF90 CO2细胞培养箱(上海力康生物医疗科技控股有限公司);DSX-18L高压蒸汽灭菌锅(上海申安医疗器械厂);L4-6K台式低速离心机(湖南可成仪器设备有限公司);Specord S600紫外-可见分光光度计(德国Analytik Jena AG)。
1.2 试药
顺铂(纯度:95%,山东铂源药业有限公司);丁二酸酐(纯度:98%)、胆固醇(纯度>95.0%)(上海麦克林生化科技有限公司);L-丁硫氨酸-亚砜亚胺(纯度:99%,ACROS ORGANICS);蛋黄卵磷脂(上海艾伟拓医药科技有限公司);二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-mPEG2K)(Corden Pharma Switerland LLC);N,N-二甲基甲酰胺(DMF,无水级)、PBS、RPMI-1640培养基(大连美仑生物科技有限公司);胎牛血清(美国Gemini),青霉素-链霉素溶液、胰酶细胞消化液-0.25%胰酶(上海碧云天科技有限公司);CCK-8试剂盒(Biosharp);氮气(青岛华奥焊割仪表有限公司);BCA蛋白浓度测定试剂盒(上海生工生物工程有限公司);微量还原型谷胱甘肽测定试剂盒(Biological Industries);二氯甲烷(CH2Cl2)、30%过氧化氢(H2O2)、丙酮、乙醚、乙醇和磷酸为分析纯;甲醇为色谱纯。
1.3 细胞
小鼠乳腺癌顺铂耐药(4T1/DDP)细胞和小鼠乳腺癌(4T1)细胞由安徽中医药大学宋航教授课题组提供。
2 方法与结果
2.1 顺-二氯·反-二(丁二酸氢根)·顺-二氨合铂(Ⅳ)(DSCP)的制备
以顺铂为基础,使用30% H2O2溶液氧化顺铂以增加两个“-OH”轴向配体形成顺-二氯·反-二羟基·顺-二氨合铂(Ⅳ){cis,cis,trans-[PtCl2(OH)2(NH3)2]},进而在真空条件下与丁二酸酐发生酯化反应生成具有双羧基侧链的Pt(Ⅳ)前药——DSCP,合成路线见图1。

图1 顺-二氯·反-二(丁二酸氢根)·顺-二氨合铂(Ⅳ)的合成路线图Fig 1 Synthetic route of DSCP
2.1.1 顺-二氯·反-二羟基·顺-二氨合铂(Ⅳ)的合成及结构表征 称取顺铂1.12 g置于250 mL圆底烧瓶中,加入75 mL 30% H2O2溶液,在75℃条件下回流反应8 h,将反应液降至室温并于-20℃静置过夜,抽滤,无水乙醇洗涤固体,25℃真空干燥得亮黄色晶体1.05 g,产率83%,红外图谱(IR)和质谱(ESI-MS)结果见图2。IR(KBr,cm-1):3475,ν-OH;1587,δd-NH3;1445,1374,δS-NH3;1076,δ-PtOH;961,894,854,ρr-NH3;570,538,ν-PtO,ν-PtN。ESIMS+,m/z:[M+H]+,334.97。

图2 cis,cis,trans-[PtCl2(OH)2(NH3)2]的IR(A)和ESI-MS(B)图谱Fig 2 IR(A)and ESI-MS(B)of cis,cis,trans-[PtCl2(OH)2(NH3)2]
2.1.2 DSCP的合成及结构表征 称量cis,cis,trans-[PtCl2(OH)2(NH3)2] 200.4 mg(0.6 mmol)和丁二酸酐180.1 mg(1.8 mmol)置于50 mL圆底烧瓶中,加入8 mL无水DMF,氮气保护条件下,30℃避光搅拌24 h得澄清黄色溶液。减压旋蒸去除DMF得黄色油状物,使用12 mL冰丙酮溶解,将溶液缓慢滴入快速搅拌的60 mL冰乙醚中析出沉淀。过滤得固体,乙醚清洗数次,25℃真空干燥后得淡黄色粉末,产率60%,纯度为98.26%,核磁共振氢谱(1H-NMR)和ESI-MS结果见图3。ESI-MS+,m/z:[M+H]+,534.8755;1H-NMR(400 MHz,DMSO-d6):δ12.20(2H,COOH),6.53(br,6H,-NH3),2.49(4H,OOC-CH2-),2.37(4H,-CH2-COOH)。
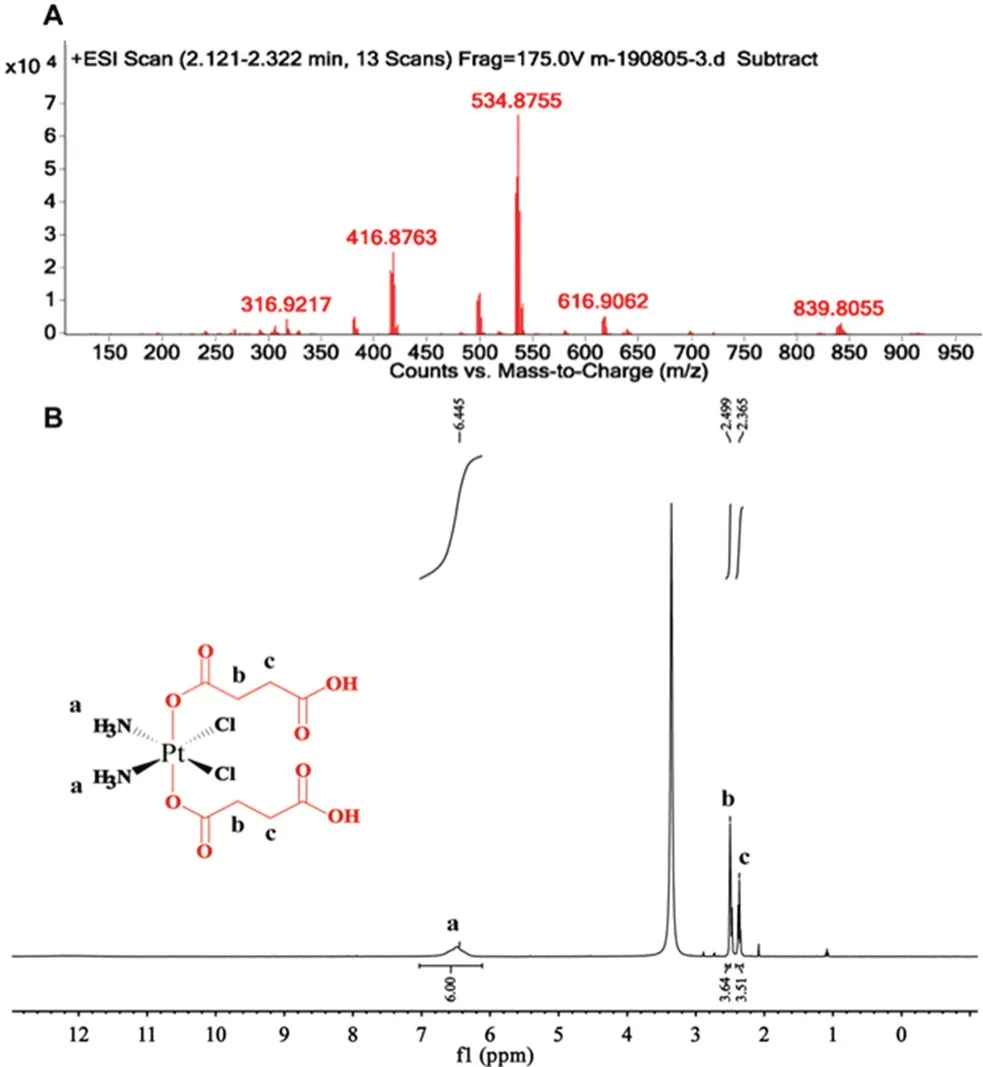
图3 顺-二氯·反-二(丁二酸氢根)·顺-二氨合铂(Ⅳ)的ESIMS(A)和1H-NMR(B)图Fig 3 ESI-MS(A)and 1H-NMR(B)of DSCP
2.2 DSCP Lip和DSCP/L-BSO Lip的制备
2.2.1 细胞培养 在含10%胎牛血清的RPMI-1640培养基的培养瓶中培养4T1/DDP细胞,培养箱温度37℃、含5%CO2,当培养瓶底部覆盖细胞密度为80%~90%时,传代进行后续实验。
2.2.2 DSCP和L-BSO投料比的筛选 称取适量的DSCP和L-BSO,采用去离子水溶解,按照不同摩尔比(12∶1、6∶1、3∶1、1∶1、1∶3、1∶6、1∶12)配制DSCP和L-BSO的混合溶液,取处于对数生长期的4T1/DDP细胞,用含10%胎牛血清的RPMI-1640培养基稀释成3×104个·mL-1接种于96孔板,每孔100 μL,置于37℃、5%CO2培养箱中培养12 h。弃去培养基,加入不同比例的DSCP和L-BSO混合溶液剂作为实验组(DSCP∶LBSO为12∶1、6∶1、3∶1、1∶1、1∶3、1∶6、1∶12,其中DSCP的浓度为30 μmol·L-1),同时设阴性对照组(不给药),每组6个复孔。给药48 h后,弃去培养基,加入不含血清的培养基稀释10倍的CCK-8溶液,每孔100 μL,3 h后用酶标仪在450 nm测定OD值,计算各组细胞生存率,结果见图4A。同时,采用CCK-8实验考察不同浓度L-BSO溶液对4T1/DDP细胞生存率的影响(见图4B)。细胞生存率(%)=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。

图4 不同比例DSCP和L-BSO混合溶液剂(A)及不同浓度L-BSO溶液(B)对4T1/DDP细胞存活率的影响(Mean±SD,n=6,*P<0.05,**P<0.01,***P<0.001,****P<0.0001)Fig 4 Effects of different proportions of DSCP and L-BSO mixed solutions(A)and different concentrations of L-BSO solutions(B)on the cell viability of 4T1/DDP cells(Mean±SD,n=6,*P<0.05,**P<0.01,***P<0.001,****P<0.0001)
由结果可知,L-BSO溶液对4T1/DDP细胞存活率的影响较小,DSCP和L-BSO混合溶液剂对4T1/DDP细胞的抑制率随着L-BSO在混合溶液中占比的增加而增加,当DSCP和L-BSO混合溶液剂的摩尔比为1∶12时,4T1/DDP细胞的存活率最低,具有较好的协同效果。因此,接下来的研究中,DSCP和L-BSO的摩尔比设为1∶12。
2.2.3 DSCP Lip和DSCP/L-BSO Lip的制备 采用薄膜水化-挤出法制得目标尺寸大小(<200 nm)的脂质体,并用超滤离心法去除游离药物。具体如下:称取蛋黄卵磷脂127.7 mg,胆固醇42.5 mg和DSPE-mPEG2K42.5 mg置于250 mL茄形瓶中,加入20 mL CH2Cl2形成脂质体溶液,旋蒸除去CH2Cl2,制成均一的脂质体膜,25℃真空干燥,加入DSCP和L-BSO混合溶液剂(含4 mg DSCP和20 mg L-BSO的去离子水溶液),磁力搅拌5 min,再加入4 mL去离子水,磁力搅拌2.5 h,即得到粗制的DSCP/L-BSO Lip。将其过0.22 μm滤膜,使用脂质体挤出器(200 nm膜)挤出20次,即得到具有乳光的DSCP/L-BSO Lip。使用超滤离心管,3000 r·min-1离心20 min去除游离药物,制备的DSCP Lip和DSCP/L-BSO Lip外观为乳白色的液体,具有淡蓝色乳光(见图5)。

图5 DSCP Lip和DSCP/L-BSO Lip的外观图Fig 5 Appearance shape of the DSCP Lip and DSCP/L-BSO Lip
DSCP Lip的制备同上述操作,将DSCP和L-BSO的混合溶液替换成DSCP溶液剂。
2.3 DSCP Lip和DSCP/L-BSO Lip的表征
2.3.1 粒径与Zeta电位 将制备的DSCP Lip和DSCP/L-BSO Lip用去离子水稀释10倍,采用Zetasizer 3000 HS激光粒度仪测定粒径分布和Zeta电位,结果见图6。
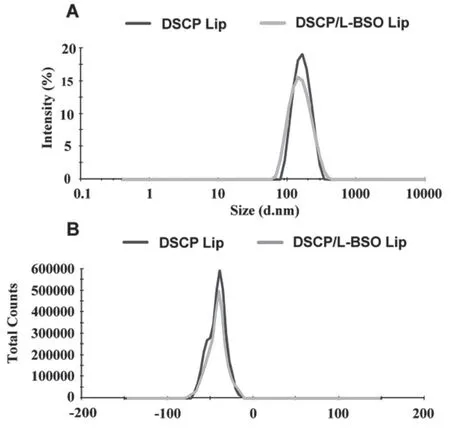
图6 DSCP Lip和DSCP/L-BSO Lip粒径分布图(A)和电位分布图(B)Fig 6 Particle size distribution(A)and Zeta potential(B)of the DSCP Lip and DSCP/L-BSO Lip
DSCP Lip和DSCP/L-BSO Lip的平均粒径分别为(154.88±2.67)nm和(143.66±1.25)nm,Zeta电位分别为(-42.84±0.07)mV和(-42.10±0.12)mV,PDI分别为(0.12±0.01)和(0.13±0.01),说明所制得的DSCP Lip和DSCP/L-BSO Lip粒径较小且分布较窄,有利于肿瘤细胞摄取内吞脂质体,增加L-BSO和DSCP的胞内积累,进而提高其抗肿瘤效果[16-18]。
2.3.2 形态 使用去离子水将脂质体稀释300倍,滴加到碳膜覆盖的铜网(200目)上静置1 min,自然干燥后用2%的磷钨酸溶液负染2 min,在透射电镜(TEM)下观察脂质体的形态(见图7)。

图7 DSCP Lip(A)和DSCP/L-BSO Lip(B)的透射电镜图Fig 7 Transmission electron micrograph of DSCP Lip(A)and DSCP/L-BSO Lip(B)
DSCP Lip和DSCP/L-BSO Lip形态圆整,呈球状,分散均匀,与Zetasizer 3000 HS激光粒度仪测定结果相比,TEM下干燥后的脂质体的粒径要比水合粒径小,笔者推测是由于在TEM条件下,脂质体表面的水化层的丢失造成的[19]。
2.3.3 稳定性 以粒径为考察指标,考察DSCP Lip和DSCP/L-BSO Lip在10%大鼠血浆pH 7.4 PBS缓冲液中的稳定性[20]。将1 mL脂质体与9 mL 10%大鼠血浆pH 7.4 PBS混合均匀后,置于37℃,100 r·min-1摇床中,分别于0.5、2、4、8、12、24、48和72 h测定脂质体的粒径变化(见图8A)。
以粒径为考察指标,使用去离子水将脂质体稀释10倍,考察DSCP Lip和DSCP/L-BSO Lip在4℃条件下放置15 d的长期稳定性(见图8B)。
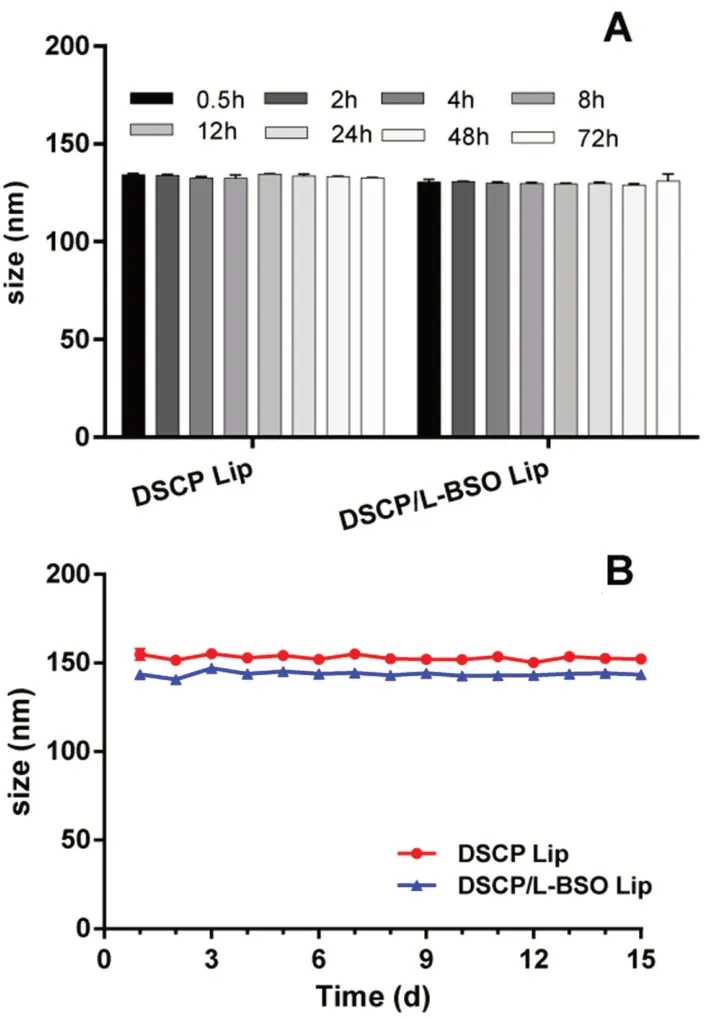
图8 DSCP Lip和DSCP/L-BSO Lip的稳定性(Mean±SD,n=3)Fig 8 Stability of DSCP Lip and DSCP/L-BSO Lip(Mean±SD,n=3)A.72 h血浆稳定性(stored at rat plasma for 72 h);B.4℃长期稳定性(long term stability at 4℃)
从结果可以看出,DSCP Lip和DSCP/L-BSO Lip表现出较好的血浆稳定性和长期稳定性,这可能与脂质体表面存在PEG水化层和-40 mV左右的Zeta电位有关,脂质体粒子之间存在空间排斥作用,稳定性较高[14,21]。
2.3.4 包封率和载药量的测定
① DSCP标准曲线的建立:采用高效液相色谱法(HPLC)测定DSCP的含量,采用YMC-Pack ODS-A色谱柱(250 mm×4.6 mm,5 μm);流动相:甲醇 ∶0.5%磷酸水(45∶55,V/V);柱温:25℃;流速:1.0 mL·min-1;波长:220 nm;进样量:10 μL。
配制质量浓度为1、5、10、25、50和100 μg·mL-1的DSCP溶液剂,进样测定,以峰面积y对质量浓度x进行线性拟合,得回归方程y=0.4603x-0.1574,R2=1.000,表明DSCP在1~100 μg·mL-1内与峰面积线性关系良好。
② L-BSO标准曲线的建立[22]:以邻苯二酚为衍生剂使L-BSO衍生化,利用紫外可见分光光度计(UV-Vis)对L-BSO衍生物进行检测和定量,具体如下:先后向2 mL样品溶液中添加0.5 mL含邻苯二酚的pH 7.4 PBS溶液(2.4 mmol·L-1)和0.5 mL含高碘酸钠的pH 7.4 PBS溶液(4.8 mmol·L-1),60 s后在503 nm固定波长下测定L-BSO衍生物的吸光值。
配制质量浓度为100、200、300、500、800和1000 μg·mL-1的L-BSO水溶液,按上述方法测定,以吸光值y对质量浓度x进行线性拟合,得回归方程y=0.0008x+0.0541,R2=0.9962,表明L-BSO在100~1000 μg·mL-1内与吸光值线性关系良好。
③ 包封率和载药量的测定:使用超滤离心法测定DSCP和L-BSO的包封率和载药量。取3 mL脂质体溶液至超滤离心管中,3000 r·min-1离心20 min,精密吸取滤液并定容,稀释适当倍数后,过0.45 μm滤膜,分别用HPLC和UV-Vis测定DSCP、L-BSO含量,计算DSCP和L-BSO的包封率(EE)和载药量(DL),结果见表1。包封率(EE,%)=脂质体中药物的重量/药物的加入重量×100%;载药量(DL,%)=脂质体中药物的重量/(载体重量+脂质体中药物的重量)×100%。
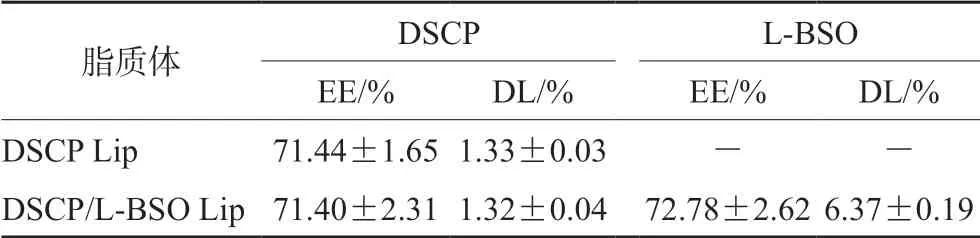
表1 DSCP Lip和DSCP/L-BSO Lip的包封率和载药量(Mean±SD,n=3)Tab 1 Encapsulation efficiency and drug loading of DSCP Lip and DSCP/L-BSO Lip (Mean±SD,n=3)
由表1可看出,DSCP和L-BSO的包封率均在71%~73%,表明DSCP和L-BSO在脂质体内水相中的摩尔比依然保持在1∶12左右。
2.3.5 体外释放考察 采用透析法考察DSCP在pH 7.4 PBS中的释放行为。精密量取一定体积的DSCP Lip和DSCP/L-BSO Lip分别装入预处理好的透析袋中,平行3份,两端系好,放入50 mL PBS中,于120 r·min-1、37℃恒温摇床上震荡,分别在0.5、1、2、4、6、8、10、12和24 h时间点取样1 mL,并每次补加等体积新鲜的释放介质,过0.45 μm滤膜,HPLC测定DSCP的浓度,按照下式计算累积释放百分比Q,结果见图9。
Q=[Ci×V1+(C1+C2+…+Ci-1)×V2]/M×100%
式中C1、C2、Ci-1、Ci分别是第1、2、i-1、i时间点释放介质中DSCP浓度;V1为释放介质总体积,V2为所取样的体积;M为释放前总药量。
由图9可知,DSCP的水溶性较好[23],在pH 7.4 PBS释放介质中,DSCP的释放速度较快,约在4 h释放达到80%。
2.4 体外抗肿瘤评价
2.4.1 考察不同制剂对4T1/DDP和4T1细胞存活率的影响 同“2.2.2”项下操作,采用CCK-8法考察不同浓度的DSCP溶液剂、DSCP和L-BSO混合溶液剂、DSCP Lip、DSCP/L-BSO Lip和空白脂质体对4T1/DDP细胞和4T1细胞存活率的影响,采用Graph Pad计算细胞存活率IC50,具体结果见图10和表2。
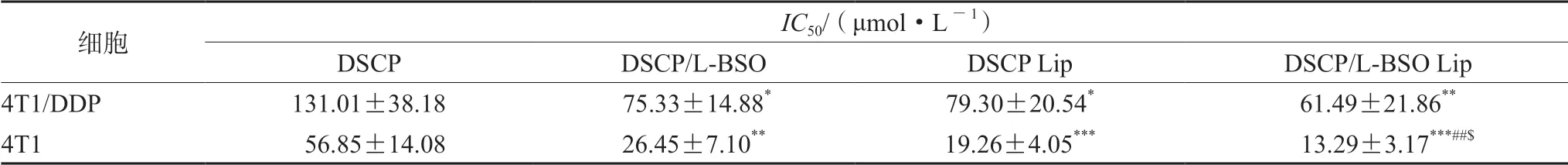
表2 DSCP溶液、DSCP/L-BSO混合溶液、DSCP/Lip和DSCP/L-BSO Lip对4T1/DDP细胞和4T1细胞的IC50值(n=6)Tab 2 IC50 of 4T1 and 4T1/DDP cells incubated with DSCP solution,DSCP and L-BSO mixed solutions,DSCP/Lip,and DSCP/L-BSO Lip (n=6)

图10 不同制剂对4T1/DDP细胞(A)和4T1细胞(B)存活率的影响以及不同浓度的空白脂质体对4T1/DDP细胞和4T1细胞存活率的影响(C)(n=6,*P<0.05,**P<0.01,***P<0.001)Fig 10 Effect of different preparation on the cell viability of 4T1/DDP cells(A)and 4T1 cells(B)and effect of different proportions of blank liposome on the cell viability of 4T1/DDP cells and 4T1 cells(C)(n=6,*P<0.05,**P<0.01,***P<0.001)
由结果可以看出,空白脂质体安全性良好,对细胞的存活率无影响。DSCP溶液剂、DSCP和L-BSO混合溶液剂、DSCP Lip和DSCP/L-BSO Lip对4T1/DDP和4T1细胞均有明显的抑制作用,且抑制作用随药物浓度的增大而增强。相对于DSCP溶液剂,DSCP和L-BSO混合溶液剂具有较高的细胞毒性,说明DSCP和L-BSO具有协同抗肿瘤作用;同样地,与DSCP Lip组相比,DSCP/L-BSO Lip的细胞抑制效果较强,说明其具有较好的抗肿瘤效果。DSCP/L-BSO Lip组对两种细胞的IC50均最小,说明其体外抗肿瘤效果最好。
2.4.2 GSH浓度的测定 取处于对数生长期的4T1和4T1/DDP细胞,以2×105个·mL-1浓度加入到6孔板中,每孔3 mL,12 h后弃去培养液,加入DSCP溶液剂、DSCP和L-BSO混合溶液剂、DSCP Lip、DSCP/L-BSO Lip溶液处理(其中DSCP的浓度为60 μmol·L-1),设3个复孔,24 h后弃去含药培养液,加入预冷的PBS溶液清洗细胞表面2~3次,吸净PBS。放置于冰上,用细胞刮刀将细胞刮下并收集于超声管,加入适量预冷的细胞裂解液,超声裂解细胞。将细胞转移至1.5 mL离心管中,随后在13 000 r·min-1低温离心10 min,小心吸取上清液分管装好暂存于-20℃备用。使用BCA蛋白浓度测定试剂盒和微量还原型谷胱甘肽测定试剂盒测定上清液内细胞蛋白浓度和GSH含量,根据以下公式计算细胞内GSH的浓度。结果见图11。
细胞内GSH浓度(μmol·g-1prot)=[(测定孔OD值-空白孔OD值)/(标准孔OD值-空白孔OD值)]×[20 μmol·L-1(GSH标准品浓度)/细胞蛋白浓度(g prot·L-1)]
从图11可以看出,与4T1细胞相比,顺铂耐药型4T1/DDP细胞具有较高的GSH浓度。无论是4T1和4T1/DDP细胞,与对照组DSCP溶液剂、DSCP和L-BSO混合溶液剂、DSCP Lip相比,DSCP/L-BSO Lip处理后,细胞内的GSH明显得到下调,这个可能是由于脂质体进入细胞后,释放的L-BSO通过抑制GCL活性下调了细胞内GSH,以及Pt(Ⅳ)前药的激活消耗GSH,增加肿瘤细胞对顺铂的敏感性,提高DSCP/L-BSO Lip的抗肿瘤效果。

图11 不同制剂处理24 h后胞内GSH的定量分析(n=3)Fig 11 Quantitative analysis of GSH in cells treated with different preparations for 24 h(n=3)
3 讨论
目前而言,顺铂临床使用过程中的最大难点是肿瘤耐药[24-25]。肿瘤细胞产生顺铂耐药主要是由于细胞对顺铂摄取的降低(例如Ctr1下调[26])、外排增加(如ATP7B上调[27])、胞内顺铂的转化或硫醇物质的解毒(如GSH)、DNA修复(如NER系统[28])和自噬(如ATG14基因上调[29])等因素造成的。在顺铂进入细胞后,胞内的还原物质如GSH、甲硫氨酸、金属硫蛋白、硫氧还蛋白和其他含硫醇的物质会和顺铂发生反应,产生Pt(GS)2偶联物,进而被ATP依赖性的多药耐药相关蛋白排出细胞[24-25,30]。大量研究证明,降低胞内GSH的浓度,可以恢复肿瘤细胞对顺铂的化疗敏感性。近期,Nie课题组构建了包载水溶性的Pt(Ⅳ)前药和萝卜硫素的纳米递送系统(SFN-CDDP-NPs),通过萝卜硫素消耗乳腺癌细胞GSH的机制,降低了Pt(GS)2的生成,肿瘤细胞凋亡大大增加,显著提高了体内肿瘤的治疗效果[31]。
脂质体是由天然的或人工合成的脂质组合形成的封闭囊状结构,具有良好的生物相容性和生物降解性[32-33]。它具有疏水性的脂质双分子层和内水相,既能将亲脂性药物包载于磷脂双分子层,也能将亲水性药物包载在内水相[34]。同时,脂质体磷脂双分子层和DSPE-PEG的疏水段有较好的相似性,易于PEG化修饰,能在脂质体表面形成水化层,大大增加药物的稳定性[35]。具有独特结构的脂质体为水溶性的L-BSO和DSCP的有效共载提供了很好的平台。
本文通过薄膜水化-挤出法制备了DSCP和L-BSO双载药的PEG化脂质体,对制备的DSCP/L-BSO Lip进行了系统的制剂学表征,体外抗肿瘤研究也初步证明了DSCP和L-BSO的协同抗肿瘤作用,DSCP/L-BSO Lip表现出较好的体外抗肿瘤效果,推测其可能机制为:① 相对于DSCP Lip,DSCP/L-BSO Lip摄取入胞后,L-BSO从脂质体中释放出来,通过特异性抑制GCL活性,降低了GSH的合成,一定程度增加了抗肿瘤效果;② 和同等剂量的DSCP和L-BSO混合溶液剂相比,DSCP和L-BSO混合溶液剂进入肿瘤细胞的方式是被动扩散,而对于DSCP/L-BSO Lip制剂而言,其不仅能通过内吞的方式进入肿瘤细胞,同时该脂质体中释放出来的DSCP和L-BSO也可以通过被动扩散方式进入肿瘤细胞,表现出较好的抗肿瘤效果。本研究制备的DSCP/L-BSO Lip具有较好的逆转肿瘤顺铂耐药的治疗效果,为铂类新制剂的研发提供了新的思路。

