高效液相色谱法测定格列齐特平衡溶解度及表观油水分配系数
唐秀秀,褚信信,王莉丽,谢子立*(.安徽中医药大学,合肥 30038;.安徽省食品药品检验研究院,合肥3005)
格列齐特是第二代磺脲类口服降糖药,用于治疗2型糖尿病,它通过刺激胰岛细胞释放胰岛素发挥作用,耐受性好,很少引起低血糖,此外,它还有减缓糖尿病性视网膜病变的潜力,是长期治疗非胰岛素依赖型糖尿病的首选药[1-3],被列入WHO基本药物清单中[4]。药物的理化参数与其在生物体内膜通透性有很大相关性,平衡溶解度及油水分配系数作为药物理化参数两个不可或缺的指标,对于预测药物在体内的吸收、分布、代谢、排泄有很大帮助[5]。格列齐特原料及制剂的现行质量标准分别收载在《中国药典》2015年版二部以及局颁标准,其含量测定分别采用电位滴定法和HPLC法[6],现行标准涉及的HPLC法中流动相基本采用三氟乙酸,流动相的pH值较低约为2,长期使用易造成色谱柱的损坏。本文通过参考相关文献[7-8],建立了色谱条件温和的HPLC法用于格列齐特的含量测定,通过方法学考察均符合要求,结果显示本次建立的HPLC法适用于格列齐特的含量测定。在此基础上,采用摇瓶法[9-11]测定格列齐特在水及不同pH的磷酸盐缓冲溶液与pH 1.2的盐酸溶液中的平衡溶解度和正辛醇-水/不同pH的磷酸盐缓冲溶液中表观油水分配系数,为格列齐特制剂研究、处方设计、仿制药一致性评价提供参考。
1 仪器与试药
LC-20AD系列高效液相色谱仪(日本岛津公司);AG-135电子天平、SevenExcellence S400 pH计(Mettler Toledo公司);HC-3018R 离心机(安徽中科中佳科学仪器有限公司);SHY-2A 水浴恒温振荡器(江苏金坛市金城国胜实验仪器厂)。
格列齐特对照品(中国食品药品检定研究院,批号:100269-201906,纯度:99.9%);格列齐特原料(批号:P011-2001015,山东科源制药有限公司,纯度大于99%)。乙腈(色谱纯,美国Fisher公司);无水甲酸(色谱纯,天津市光复精细化工研究所);醋酸铵、正辛醇、氢氧化钠、磷酸二氢钾、盐酸均为分析纯;水为超纯水。
2 方法与结果
2.1 色谱条件与系统适用性
采用Unitary C8色谱柱(250 mm×4.6 mm,5 μm),以乙腈-0.02 mol·L-1醋酸铵溶液(甲酸调pH至3.5)(45∶55)为流动相,柱温35℃,检测波长235 nm,流速1.0 mL·min-1,进样量20 μL。在此色谱条件下进行分析,并记录色谱图。色谱图见图1,格列齐特保留时间为14 min,峰形良好,空白溶剂对测定无干扰。

图1 格列齐特高效液相色谱图Fig 1 HPLC chromatogram of gliclazide
2.2 溶液的制备
2.2.1 对照品溶液的制备 精密称取格列齐特对照品15.65 mg,置50 mL量瓶,加乙腈22.5 mL超声溶解,用水稀释至刻度,作为对照品储备液。精密量取上述储备液5 mL置25 mL量瓶中,用乙腈-水(45∶55)稀释至刻度,摇匀,即得对照品溶液。
2.2.2 不同pH溶液的制备 按《中国药典》2015年版四部缓冲液的配制方法[12],分别配制pH为4.5,6.8,7.4的磷酸盐缓冲溶液。另称取氢氧化钠2 g,加磷酸二氢钾6.8 g置于1000 mL量瓶中,加水稀释至刻度,配成pH为8.6的磷酸盐缓冲溶液;称取氯化钠2.0 g,置于1000 mL量瓶中,加入浓盐酸7 mL,加水溶解并稀释至刻度,配成pH为1.2的盐酸溶液。
2.3 方法学考察
2.3.1 线性关系考察 精密量取“2.2.1”项下的对照品储备液2、3、4、5 mL分别置25 mL量瓶中,分别用乙腈-水(45∶55)稀释至刻度,摇匀,作为线性溶液①②③④。精密量取“2.2.1”项下的对照品储备液4、6 mL分别置10 mL量瓶中,分别用乙腈-水(45∶55)稀释至刻度,摇匀,作为线性溶液⑤⑥。精密量取上述①~⑥溶液各20 μL,注入液相色谱仪中,按“2.1”项下色谱条件测定,以对照品的质量浓度(C)为横坐标,以格列齐特峰面积(A)为纵坐标,进行线性回归,得格列齐特的回归方程为A=4.06×107C-1.29×105(r=0.9996),结果表明格列齐特在0.025 01~0.187 61 mg·mL-1与峰面积呈良好的线性关系。
2.3.2 检测限与定量限 精密量取“2.2.1”项下的对照品储备液,用乙腈-水(45∶55)逐级稀释,按“2.1”项下色谱条件进行测定,以S/N=3确定检测限,以S/N=10确定定量限。结果显示格列齐特的检测限和定量限分别为0.18 μg·mL-1和0.61 μg·mL-1。
2.3.3 精密度试验 精密量取格列齐特对照品溶液 20 μL,按“2.1”项下色谱条件连续进样测定 6次,记录色谱峰面积,计算峰面积RSD为0.18%(n=6),结果表明仪器精密度良好。
2.3.4 重复性试验 平行称取格列齐特原料药6份,精密称定,按“2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,格列齐特含量RSD为0.96%,结果表明本法重复性良好。
2.3.5 稳定性试验 平行称取格列齐特原料药6份,精密称定,分别加入水、“2.2.2”项下pH值分别为4.5、6.8、7.4、8.6的磷酸盐缓冲溶液、pH 1.2的盐酸溶液和乙腈-水(45∶55)溶液,配制质量浓度为0.06 mg·mL-1的供试品溶液。分别精密吸取上述溶液及“2.2.1”项下的对照品溶液20 μL,按“2.1”项下色谱条件,于0、2、4、6、8、10、12、24、48、72 h进样测定,记录峰面积,以峰面积计算得到RSD分别为1.7%、1.3%、0.55%、0.95%、0.38%、15.4%及0.35%。结果表明格列齐特在水、4种磷酸盐缓冲溶液介质及乙腈-水(45∶55)溶液中72 h内较稳定;在pH为1.2的盐酸溶液中72 h不稳定,在4 h内稳定,RSD小于2.0%。
2.3.6 加样回收试验 取已知含量的格列齐特原料药7.5 mg,精密称定,置于50 mL量瓶中,共9份,平均分为3组,分别加入格列齐特对照品6.0、7.5、9.0 mg,精密称定,按照“2.2.1”项下方法制备供试品溶液,按“2.1”项下色谱条件测定,记录峰面积,格列齐特低、中、高水平回收率分别为99.9%、98.5%、98.2%,RSD分别为0.84%、1.0%、0.17%,结果表明该方法准确度良好。
2.4 格列齐特平衡溶解度的测定
2.4.1 转速与振摇时间考察 将恒温水浴的转速分别设置为50、100和200 r·min-1,选择pH为4.5和8.6两种磷酸盐缓冲溶液在(37±0.5)℃条件下振摇72 h,0.45 μm滤膜滤过,吸取续滤液(或稀释后),按“2.1”项下色谱条件测定,结果见表1。由表1可知,在pH为4.5的磷酸盐缓冲溶液中,转速的改变对格列齐特的溶解度没有明显的影响;在pH为8.6的磷酸盐缓冲溶液中,恒温水浴转速为50和100 r·min-1时,格列齐特溶解度24 h才达平衡,恒温水浴转速为200 r·min-1时,格列齐特溶解度在2 h达到平衡。因此,为了使样品能够充分溶解确保测得的平衡溶解度准确、有效,本研究最终确定格列齐特的平衡溶解度测定转速及振摇时间分别为200 r·min-1、24 h。
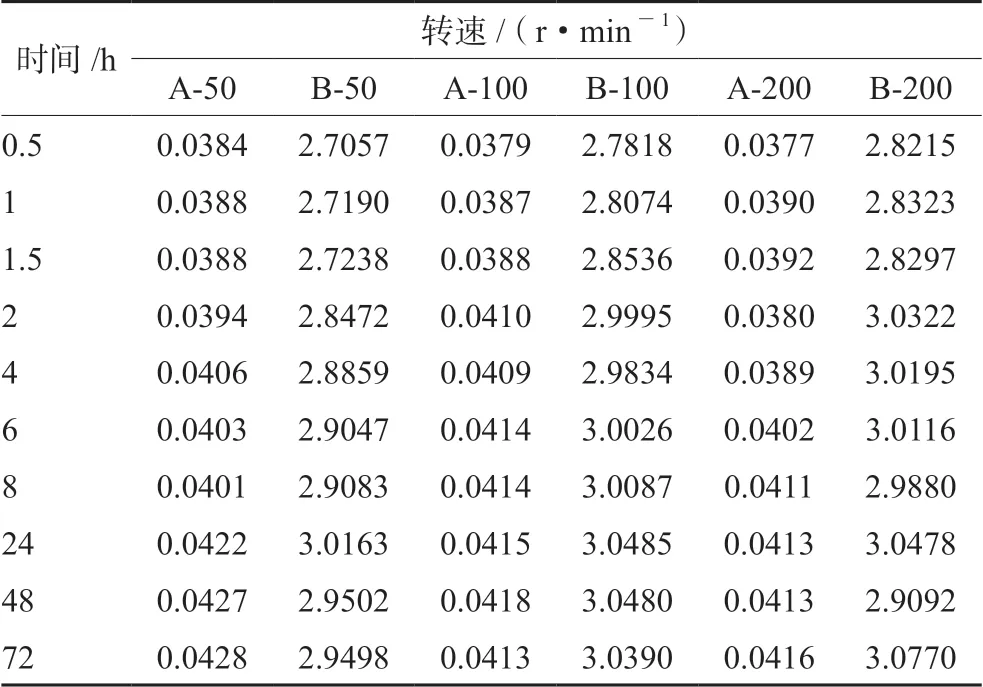
表1 平衡溶解度转速和振摇时间的考察(n=3,mg·mL-1)Tab 1 Equilibrium solubility speed and shaking time(n=3,mg·mL-1)
2.4.2 平衡溶解度的测定 量取水及“2.2.2”项下配制的不同pH缓冲溶液各50 mL,分别置于100 mL碘量瓶中,加入过量的格列齐特原料药粉末至溶液中出现大量不溶性沉淀,在(37±0.5)℃,200 r·min-1条件下振摇 24 h,0.45 μm滤膜滤过。吸取续滤液(或稀释后),按“2.1”项下色谱条件测定,记录峰面积,计算格列齐特在水及不同介质中的平衡溶解度,结果见表2。

表2 格列齐特的平衡溶解度计算结果(n=3)Tab 2 Equilibrium solubility of gliclazide (n=3)
2.5 格列齐特表观油水分配系数的测定
吸取正辛醇溶液适量,分别与同体积水及pH为4.5、6.8、7.4、8.6的磷酸盐缓冲溶液混合,在(37±0.5)℃,200 r·min-1条件下振摇24 h,分取上层和下层,即得水及不同pH磷酸盐缓冲溶液饱和的正辛醇、正辛醇饱和的水及不同pH的磷酸盐缓冲溶液。
分别吸取水及不同pH磷酸盐缓冲溶液饱和的正辛醇20 mL,置50 mL的离心管中,加入过量的格列齐特原料药粉末至溶液中出现大量不溶性白色沉淀,置恒温水浴振荡器中,在(37±0.5)℃,200 r·min-1条件下振摇 24 h,经0.45 μm 滤膜滤过,取续滤液作为相应的储备溶液;分别精密量取上述溶液适量,用甲醇准确稀释50 倍,按“2.1”项下色谱条件进样测定,记录峰面积,以外标法计算格列齐特初始浓度C0。
分别精密量取上述储备溶液各10 mL,置50 mL的离心管中,分别加入10 mL正辛醇饱和的水及pH为4.5、6.8、7.4、8.6的磷酸盐缓冲溶液,将离心管置于水浴恒温振荡器中,在(37±0.5)℃,200 r·min-1条件下振摇 24 h,离心(12 000 r·min-1,10 min),用注射器吸取水层,经0.45 μm 滤膜滤过,吸取续滤液(或稀释后),按“2.1”项下色谱条件进行测定,记录峰面积,以外标法计算格列齐特质量浓度CW。根据公式P=(C0-CW)/CW计算表观油水分配系数,结果见表3。
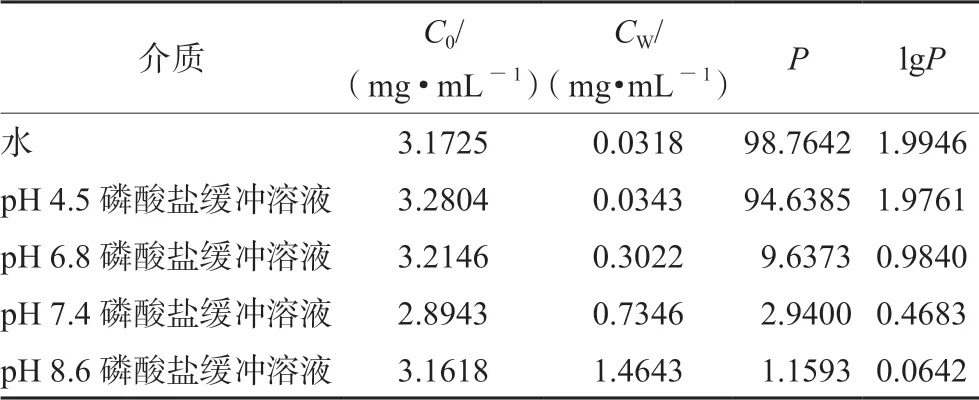
表3 格列齐特表观油水分配系数计算结果(n=3)Tab 3 Apparent oil-water partition coefficient of gliclazide (n=3)
3 讨论
3.1 流动相的选择
《中国药典》2015年版二部收载的格列齐特、格列齐特片(Ⅱ)含量测定方法分别为电位滴定法和HPLC法,后者流动相中的三氟乙酸对色谱柱损伤较大,耐用性较差且不适用于后期质谱方法研究。本研究考察了0.01、0.02、0.05 mol·L-1醋酸铵溶液对格列齐特峰形的影响,醋酸铵溶液浓度在0.01 mol·L-1时,格列齐特峰对称性及拖尾因子均达不到要求,0.02、0.05 mol·L-1醋酸铵溶液虽都能达到要求,但0.05 mol·L-1醋酸铵溶液调至pH 3.5所需酸量较多,因此最终将醋酸铵溶液浓度定为0.02 mol·L-1。考察流动相的配比对出峰时间、分离度的影响,乙腈量减少,保留时间延长,45%的乙腈配比时分离度能达到要求且格列齐特峰保留时间较为合适。另考察冰醋酸和甲酸调节醋酸铵溶液以及不同pH值对出峰的影响,由于在调节pH时冰醋酸用量较大,采用甲酸调节较为合适且在pH 3.5时格列齐特峰的分离度、理论塔板数、对称性均能达到要求。比较了《中国药典》与本研究建立的HPLC法的灵敏度,发现本次研究所建立的色谱方法灵敏度约为《中国药典》色谱方法的5.5倍,所建立的色谱方法既能满足测定要求,又有其独特的优势,为今后该类色谱条件的选择、优化提供了思路。
3.2 平衡溶解度
溶解度是影响生物利用度最重要的性质之一,也是确立生物药剂学分类系统的两个重要参数之一[13]。药物的平衡溶解度是指在一定温度(气体在一定压力)下,在一定量溶剂中达饱和时溶解的最大药量,是反映药物溶解性的重要指标[14]。本研究采用经典的摇瓶法对格列齐特在水及不同pH的磷酸盐缓冲溶液中的平衡溶解度进行测定,结果表明格列齐特在水及不同pH缓冲溶液中溶解度按照《中国药典》表示方法分别为不溶、极微溶解和微溶且平衡溶解度随着介质pH值的增大而增加。由稳定性试验可知,格列齐特在pH 1.2盐酸溶液中不稳定,因此在制剂开发过程应避免酸性辅料或因相互作用产生酸性物质的辅料的加入。
3.3 表观油水分配系数
体外测定油水分配系数是为了模拟生物体内药物在水相和生物相之间的分配情况,从而预测其在肠道中的吸收情况[15]。生物膜整体的溶解度参数&=(21.07±0.82)(J·cm-3)1/2,与正辛醇的溶解度参数接近,因此通过测定正辛醇与水的分配系数来预测药物的吸收[16]。lgP对于药物在胃肠道吸收速度和程度有很大影响,P值过低(lgP<-2),化合物不能穿过脂质膜;P值过高(lgP>3),化合物因脂溶性强而难以进入血管或淋巴管。药物的最佳 lgP值为:-1.0<lgP<2.0,在该lgP值范围内的化合物脂溶性和水溶性适中,具有较好生物膜渗透性,易透过细胞膜吸收和转运[17]。由本试验所测得数据可知不同pH介质对格列齐特表观油水分配系数有一定的影响,格列齐特在水及不同pH值磷酸盐缓冲溶液的lgP值均在0.06~2.00,多个pH介质测定结果表明格列齐特具有好的渗透性,提示其在胃肠道具有很好的分布与吸收。通过对格列齐特表观油水分配系数的研究为其制备工艺和处方设计提供理论依据。

