高铝粉煤灰碱石灰低钙烧结熟料的浸出
郑 欢,冯晓兰,赵 博,杨 岗,杨鹏程,刘宇春,张锦飞
(1.陕西煤业化工技术研究院有限责任公司,陕西 西安 710055;2.西安高新区环境保护局,陕西 西安 710055;3.西安建筑科技大学,陕西 西安 710055)
0 引 言
我国煤炭资源丰富,是煤炭及发电行业大国,粉煤灰产量庞大,2017年产生量为6.86亿t,综合利用率为75.35%。依照灰色模型估计,2024年将达到9.25亿t[1]。我国粉煤灰不仅产量大,且利用不均衡,东南部等发达地区利用率高,但中西部地区产量大利用率却很低,不超过15%。粉煤灰已成为中国排放量最大的工业固体废物,对大气、河流、土壤等均造成威胁。同时,随着我国氧化铝工业的发展,铝土矿资源缺口极大[2-3]。而山西北部和内蒙古中西部地区的煤炭资源中因富含大量勃姆石、高岭石等铝硅矿物,故此类原煤燃烧后的粉煤灰中氧化铝含量与氧化铝在大多中低品位铝土矿中的含量相当,高达40%以上[4-5]。因此,高铝粉煤灰提取氧化铝研究对增加有效供给、保障氧化铝工业可持续发展具有深远意义。
当前,国内外以粉煤灰为原料提取氧化铝的工艺方法主要包括碱法、酸法及酸碱联合法[6]。碱法粉煤灰提取氧化铝工艺方法简单、技术成熟,杂质干扰小,氧化铝纯度好、溶出率高,但缺点是受限于铝硅比(≥3),且能耗大,产生大量的尾渣[7]。酸法粉煤灰提取氧化铝工艺流程短、能耗低,主要成分SiO2不进入酸液,酸可以循环使用,还可以提取镓、锂、硅等有价元素,但粉煤灰中的氧化钙和氧化铁协同溶出影响产品纯度,且盐酸、硫酸有较强的腐蚀性,对设备要求高等原因限制持续工业化生产[8]。酸碱联合法工艺通常能制得纯度较高的氧化铝,浸出率高,且可以联产硅、铝2种产品,即SiO2利用率高,同时工艺流程能耗低,在指标上具有一定优势;但酸碱混合法生产过程中面临强酸、纯碱/苛性碱消耗量过大,且AlCl3溶液中Fe、Ti等杂质难以去除等问题[9-10]。翟玉春等[11]以粉煤灰为原料制备高纯氧化铝,将获得的硫酸铝铵经3次重结晶后,制得的氧化铝纯度大于99.9%;蒋周青等[12]采用预脱硅-低钙碱石灰烧结法提取氧化铝,在1 050 ℃下煅烧120 min,氧化铝的浸出率为93.4%;李会泉等[13]提出了预脱硅-两步碱水热法提取氧化铝工艺,将两步反应耦合,氧化铝的总提取率达94.9%,提取液中氧化铝的浓度为78.8 g/L,苛性比从一步碱水热法的11.5降低到7.2。陈延信等[14]自主研发出高铝粉煤灰碱石灰低钙烧结提取氧化铝,在烧结温度1 150 ℃左右、烧结时间60 min下,粉煤灰熟料中氧化铝的浸出率达到96%。相对于饱和配方,低钙配方增加了碱消耗量、减少了石灰石消耗量,但碱又可通过后续脱碱工序回收,总体上可降低资源消耗。然而,氧化铝熟料是研究铝酸钠浸出的原料,是高铝粉煤灰烧结法生产氧化铝的中间产物,熟料铝酸钠的浸出研究是高铝粉煤灰提取氧化铝工艺流程中的重要环节,但目前大多使用铝土矿的标准浸出工艺。铝土矿和氧化铝熟料在矿物组成等方面有很大差异,沿用传统铝土矿的浸出工艺条件易导致氧化铝熟料浸出率低,消耗大量的浸取剂,操作过程复杂。基于上述问题,为进一步探索熟料浸出工艺,本文在标准浸出条件基础上,以粉煤灰碱石灰悬浮态预热预分解-低钙干法烧结的熟料开展浸出工艺的研究,考察浸出温度、浸出时间、液固比和碱液浓度对NaAlO2浸出率的影响,得到熟料浸出的最佳工艺条件,通过XRD、SEM对浸出前后的氧化铝熟料进行物相表征。此外,采用液固相反应缩核模型分析浸出动力学规律,为粉煤灰碱石灰悬浮态预热预分解-低钙干法烧结工业实践提供基本参数。
1 试 验
1.1 氧化铝熟料
试验原料为粉煤灰碱石灰悬浮态预热预分解-低钙干法烧结半工业化试验的氧化铝熟料[15],其中烧结试验的原料配方为:钙比CaO/(SiO2+TiO2)=1、碱比(Na2O+K2O)/(Al2O3+Fe2O3+SiO2)=1,烧结温度1 150 ℃。采用德国布鲁克公司的S4-Pioneer型X-ray荧光光谱仪(XRF)分析氧化铝熟料中主要元素和含量,结果见表1。采用日本理学(RIGAKU)的X-ray衍射仪(D/MAX220)分析氧化铝熟料的XRD图谱,如图1所示。
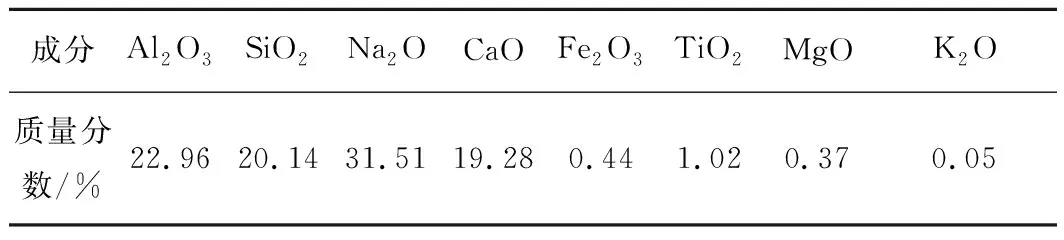
表1 原料的化学成分
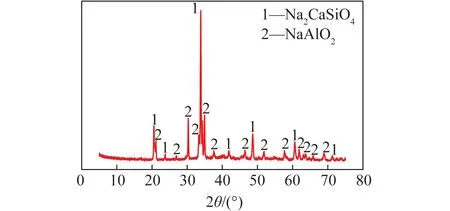
图1 原料XRD分析图谱Fig.1 XRD analysis image ofraw samples
由图1可以看出,该熟料的主要化学成分是Al2O3、SiO2、Na2O和CaO,主要矿物相为偏铝酸钠NaAlO2和钠钙硅NaCaSiO4。偏铝酸钠是生产氧化铝的前驱体,对熟料进行水溶或碱浸,使偏铝酸钠溶解形成偏铝酸钠溶液,而钠钙硅不溶于水或碱液,以固体形态残存,通过过滤即可实现铝硅矿物相的分离。
1.2 试验方法
配制不同浓度的浸出碱液,按试验设定的液固比,将盛有熟料与浸出碱液的容器置于一定温度的水浴锅中反应一定时间,反应结束后将滤渣过滤洗涤。滤渣充分洗涤放入(105±5)℃烘箱中干燥2 h,获得浸出后的产物样品钠钙硅(浸出渣),分析其化学组成。铝酸钠浸出率ηNAO计算公式为
(1)
式中,(A/C)clinker为熟料中Al2O3及CaO质量比;(A/C)slag为钠钙硅渣中Al2O3及CaO质量比。
氧化铝含量采用EDTA法测定,氧化钠含量采用火焰光度法测定。
2 结果与讨论
2.1 熟料铝酸钠浸出率的影响因素
固定条件:浸出温度约85 ℃,浸出时间15 min,液固比15 mL/g,混碱溶液浓度为15 g/L(Na2Ok=15 g/L、Na2OC=5 g/L),改变单一因素,考察其对钠钙硅渣中Al2O3含量以及NaAlO2浸出率的影响。
2.1.1浸出温度对铝酸钠浸出率的影响
温度升高可以加快化学反应速率,更有利于达到化学反应的平衡点。但从工业生产角度考虑,温度高意味着能耗高,增加了企业运营成本。因此流程中要在满足浸出工艺要求的基础上,尽量降低浸出温度。
浸出温度对NaAlO2浸出率的影响如图2所示。可知浸出温度<65 ℃时,随浸出温度升高,钠钙硅渣中Al2O3含量逐渐降低,NaAlO2浸出率增加;浸出温度达到65 ℃时,钠钙硅渣中Al2O3含量为1.96%,NaAlO2浸出率为94.73%;但温度持续升高,钠钙硅渣中Al2O3含量和NaAlO2的浸出率基本趋于稳定。分析原因认为:氧化铝熟料中可溶性NaAlO2的溶解主要受扩散控制[16],溶解度随温度升高而增大;其次,随浸出温度升高,溶液黏度减小,熟料中可溶性NaAlO2向溶液扩散的阻力不断降低,有利于提高溶解速度;浸出温度继续增加,NaAlO2浸出率基本不变。试验中较适宜的浸出温度为65 ℃。
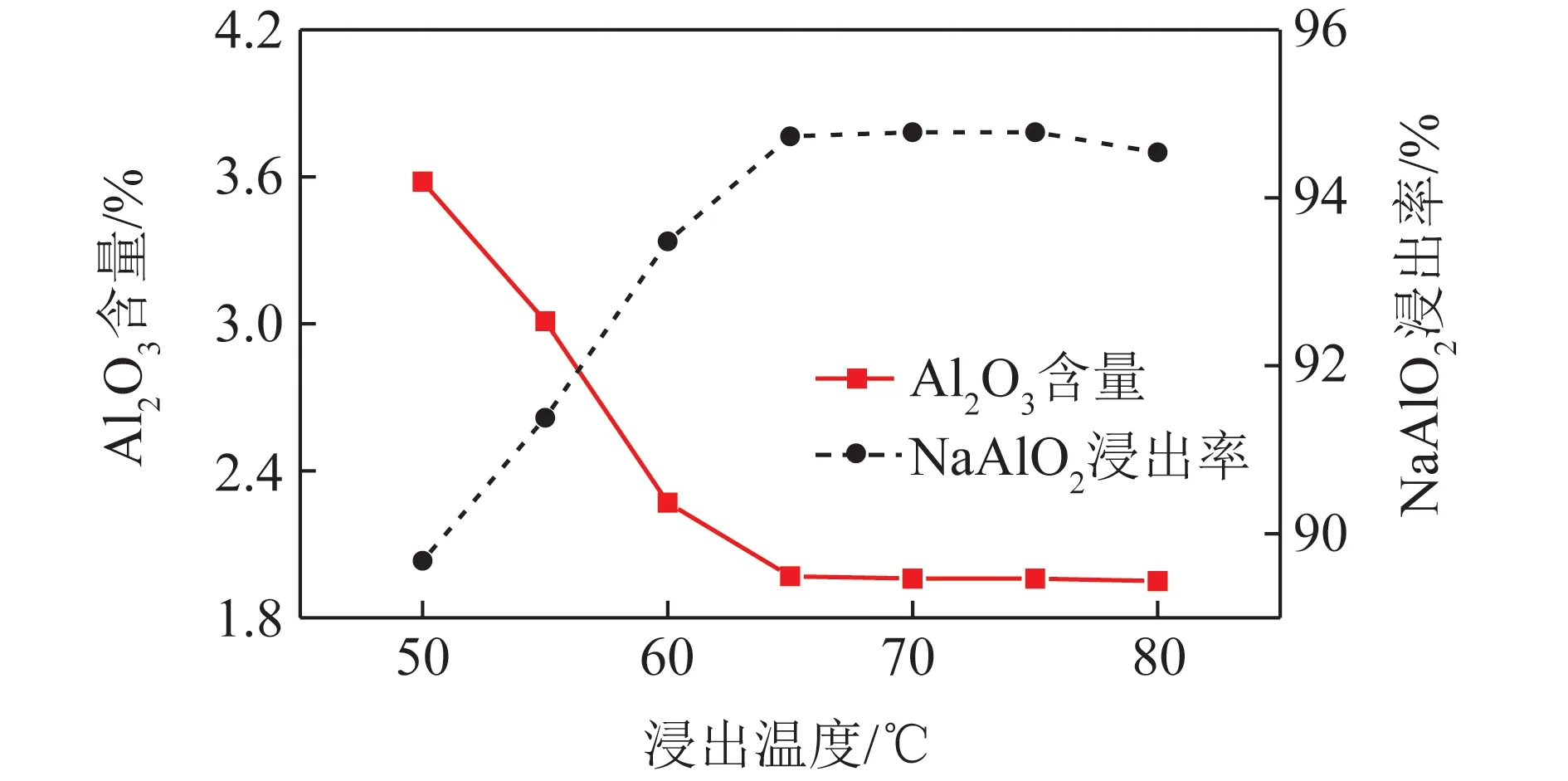
图2 钠钙硅渣中Al2O3含量及NaAlO2浸出率随浸出温度变化Fig.2 Change of leaching rate of NaAlO2 and Al2O3 contentin sodium-calcium-silicon slag with leaching temperature
2.1.2浸出时间对NaAlO2浸出率的影响
延长反应时间通常可以使化学反应更彻底、更充分,但延长反应时间则会导致设备产能下降,影响工业化生产效率。
浸出时间对NaAlO2浸出率的影响如图3所示。可知氧化铝熟料中NaAlO2浸出率随浸出时间的延长而增加。浸出时间为1~7 min时,NaAlO2浸出率由91.71%增加为94.49%,继续延长浸出时间,浸出率基本保持不变。说明在一定浸出温度下,随着时间延长,浸出率逐步升高,但反应进行到一定时间后,熟料中可溶性NaAlO2已浸出完全。试验较适宜的浸出时间为7 min。
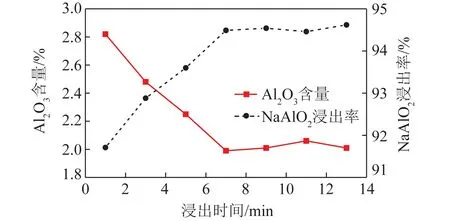
图3 钠钙硅渣中Al2O3含量及NaAlO2浸出率随浸出时间变化Fig.3 Change of leaching rate of NaAlO2 and Al2O3 contentin sodium-calcium-silicon slag with leaching time
2.1.3液固比对NaAlO2浸出率的影响
液固比是浸出体系中液体体积与固体质量之间的比值,表征单位体积液体量处理固体的质量,液固比大小与物料流量相关,对工业生产有一定指导意义。
液固比对NaAlO2浸出率的影响如图4所示。可知氧化铝熟料中NaAlO2浸出率随液固比的增大而增大。液固比为3~5时,NaAlO2浸出率由92.89% 增加为93.78%,继续增大液固比,浸出率基本不再变化,达到反应平衡。分析原因认为:碱液体积一定时,液固比过小,体系中氧化铝熟料浓度大,体系黏度变大,液固界面间的传质速率会大大降低,不利于浸出反应;液固比过大,反应物料浓度过低,使浸出液中NaAlO2浓度降低,不利于后续结晶分离[17-18]。在氧化铝工业生产中,希望在保证NaAlO2较高浸出率的前提下,提高浸出液中NaAlO2浓度,以减少物料流量。试验较适宜的液固比为5。
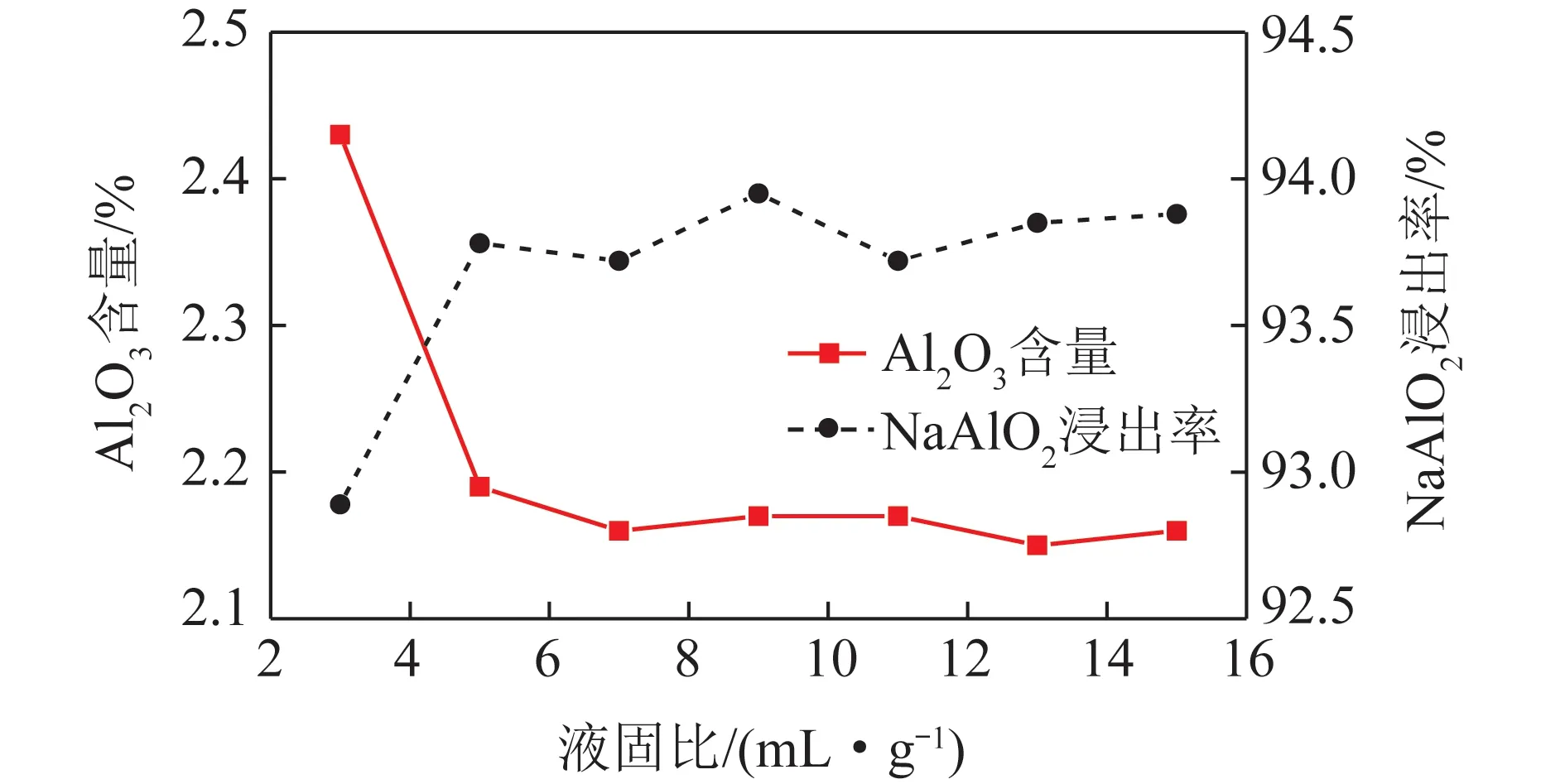
图4 钠钙硅渣中Al2O3含量及NaAlO2浸出率随液固比变化Fig.4 Change of leaching rate of NaAlO2 and Al2O3 contentin sodium-calcium-silicon slag with liquid-solid ratio
2.1.4碱液浓度对NaAlO2浸出率的影响
采用拜耳工艺生产Al2O3铝土矿需在高温高压条件下,Al2O3·nH2O和碱反应得到NaAlO2溶液,硅和铁杂质进入固体残渣形成赤泥。碱液浓度决定了铝土矿中Al2O3浸出速率,也影响反应进程。因此需要进一步探索减浓度对浸出工艺的影响。
碱液浓度对NaAlO2浸出率的影响如图5所示。可知氧化铝熟料中NaAlO2浸出率随碱液浓度的增大没有明显变化。碱液浓度为0时,即直接用去离子水溶解氧化铝熟料,NaAlO2浸出率为94.82%;之后随碱液浓度增加,钠钙硅渣中Al2O3含量及NaAlO2浸出率基本趋于稳定。说明原料碱含量较高(31.51%),自身具有浸出NaAlO2的能力,所以碱浓度高低不影响氧化铝熟料中Al2O3浸出的速率及最终进程,试验较适宜的碱液浓度为0。
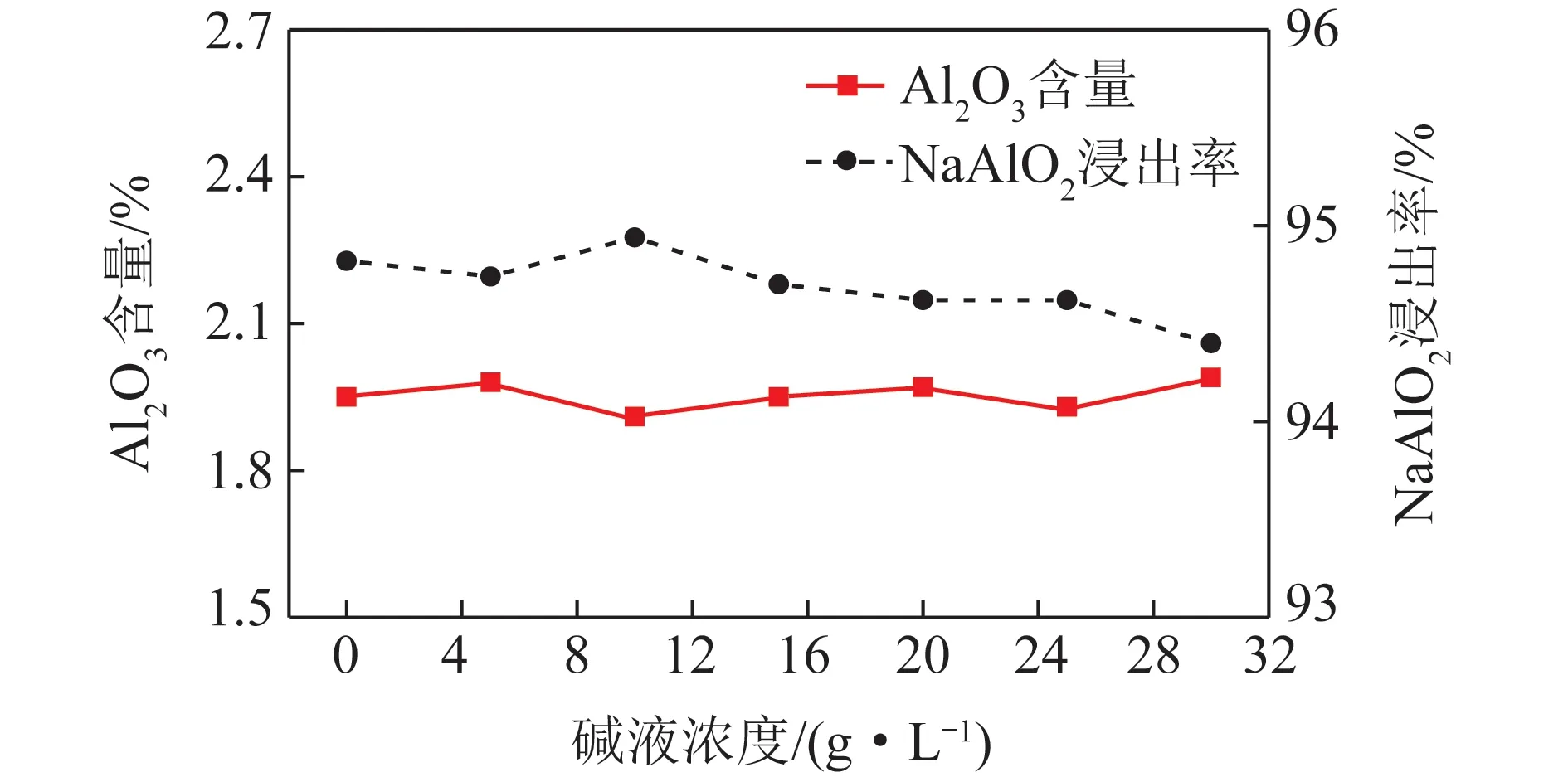
图5 钠钙硅渣中Al2O3的含量以及NaAlO2浸出率随碱液浓度变化Fig.5 Change of leaching rate of NaAlO2 and Al2O3 contentin sodium-calcium-silicon slag with alkali concentration
2.2 浸出动力学
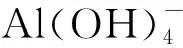
1-(1-X)2/3=kt,
(2)
lnk=lnA-Ea/(RT),
(3)
式中,k为速率常数;t为时间,min;A为指前因子;R为气体常数,8.314 J/(mol·K);Ea为活化能,kJ/mol。

图6 不同浸出温度条件下缩核模型动力学拟合曲线Fig.6 Fitting curves of shrinking core model kineticswith the different leaching time
由图6可知,模型的线性相关系数R2都大于0.927,拟合结果与缩核模型吻合较好,表明在此条件下氧化铝熟料中NaAlO2浸出反应符合缩核模型。由图6可得不同温度下的表观速率常数k代入式(3)进行一次回归,结果如图7所示。可知二者呈较好的线性关系,Ea=26.585 kJ/mol,表明该氧化铝熟料的浸出反应为混合控制,一般在低温属于化学反应控制,随温度升高转变为扩散控制。
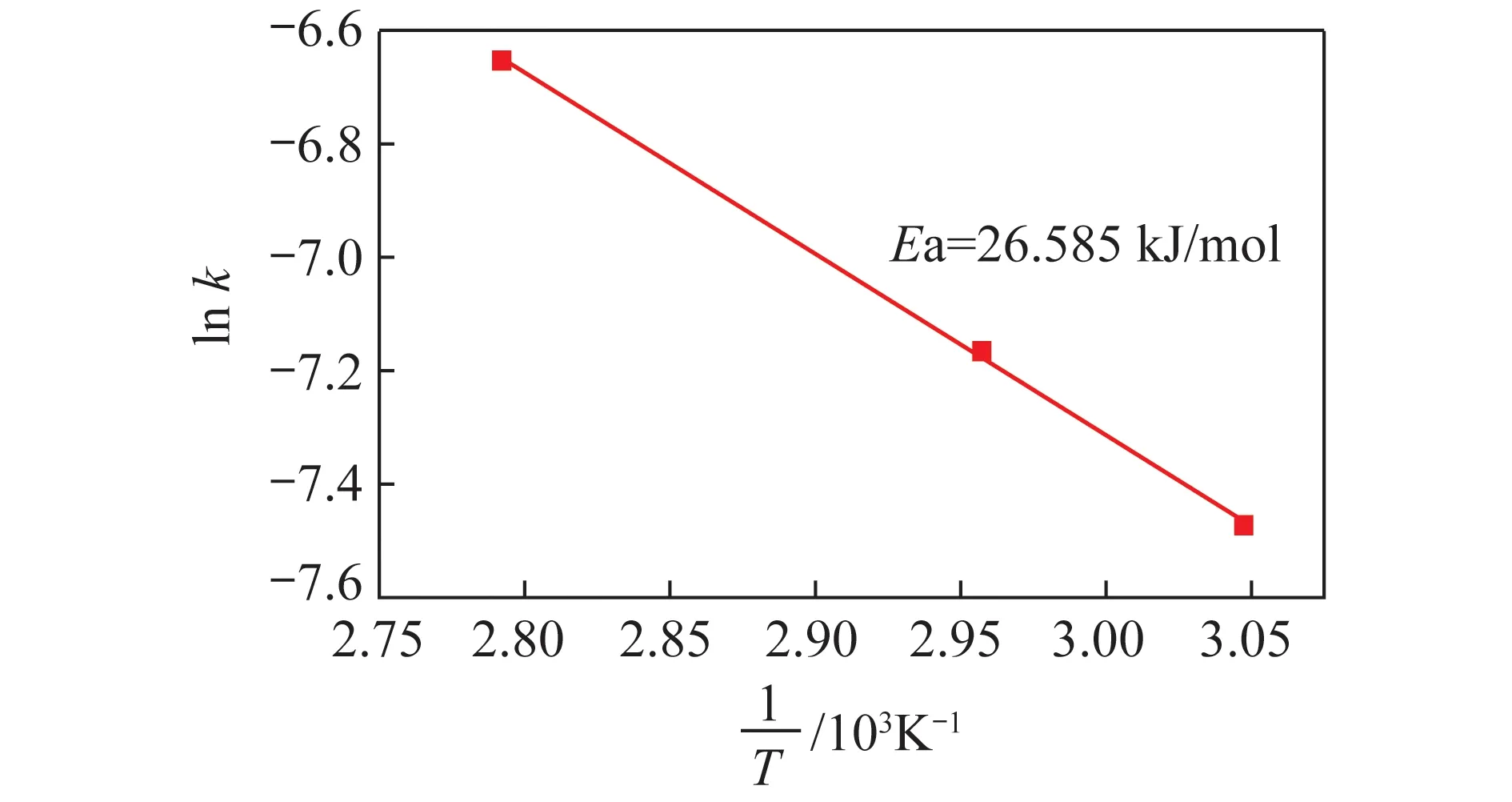
图7 氧化铝熟料中NaAlO2浸出的ln k与1 000/T的关系Fig.7 Relationship between 1 000/T and ln k of NaAlO2leaching from alumina clinker
2.3 物料表征
在浸出温度65 ℃、浸出时间7 min、液固比5 mL/g的条件下,利用去离子水将氧化铝熟料内的NaAlO2浸出后可得到钠钙硅渣。
将钠钙硅渣放入烘箱中干燥2 h,冷却后用研钵研磨至<80 μm,并进行X-ray荧光分析和SEM显微形貌分析。最佳条件下浸出产物钠钙硅渣的XRD图谱如图8所示。可知主要存在Na2CaSiO4衍射峰,与原料比较,Na2CaSiO4的衍射峰相对强度明显增强,几乎观察不到NaAlO2的衍射峰,熟料中NaAlO2溶解进入溶液与钠钙硅渣分离,达到了铝硅分离的目的。进一步说明氧化铝熟料在优化条件下反应活化能低,有利于NaAlO2浸出反应进行。
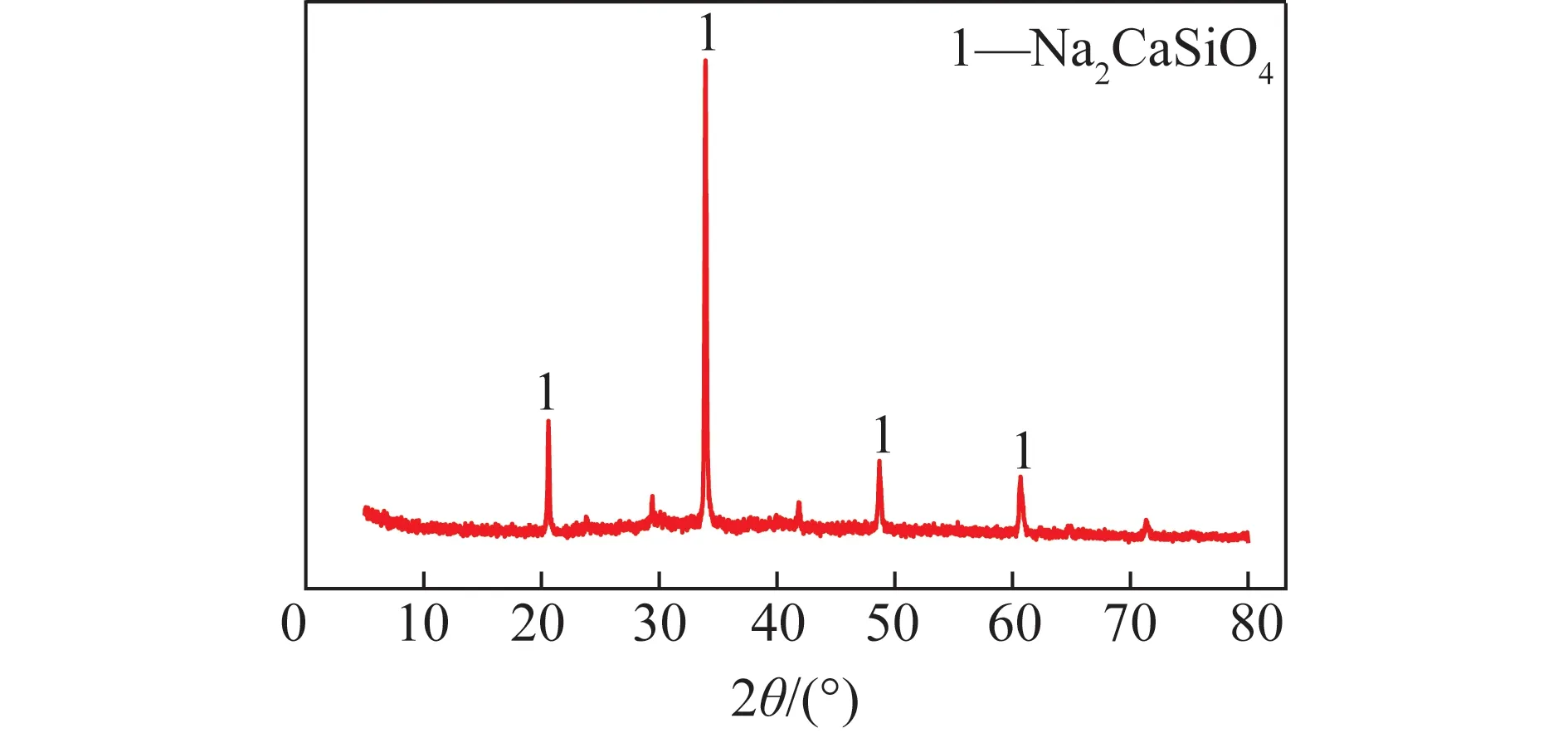
图8 钠钙硅渣的XRD图Fig.8 XRD analysis image of sodium-calcium-silicon slag
原料和浸出产物钠钙硅渣样品的SEM-EDS分析如图9所示。由图9(a)可知,原料中包括2种不同类型的颗粒,20~30 μm块状颗粒和2~5 μm细小颗粒散乱分布在块状颗粒周围;块状颗粒为Na2CaSiO4,细小颗粒主要成分为NaAlO2。由图9(b)可知,氧化铝熟料在铝酸钠浸出后,钠钙硅渣的微观形貌呈蜂窝状,这是由于NaAlO2浸出所致;钠钙硅中Al元素质量分数大幅下降至0.56%。钠钙硅渣在一定温度下极易水解,经过回收碱工艺可以分解得到NaOH及水化硅酸钙。回收的碱可回用于高铝粉煤灰碱石灰低钙烧结,水化硅酸钙可以作为优质的轻质墙体材料和吸附材料,具有良好的环境保护价值[20]。

图9 原料和钠钙硅渣的SEM-EDS图Fig.9 SEM-EDS analysis image of alumina clinker and sodium-calcium-silicon slag
3 结 论
1)通过对氧化铝熟料的微观表征分析发现氧化钙熟料中的矿物相主要为铝酸钠和钠钙硅,表征结果与低钙碱石灰烧结法的理论产物基本一致。其中钠钙硅的大颗粒群黏连在一起,而小颗粒则散乱分布于钠钙硅周边或黏附在表面。
2)通过研究碱石灰低钙烧结熟料浸出铝酸钠,得出最佳浸出条件为:在浸出温度65 ℃,浸出时间7 min,液固比5,碱液浓度0,此时NaAlO2浸出率可以达到94%以上,相较于传统的铝土矿标准浸出工艺中规定的(85±1)℃条件下浸出15 min的工况,氧化铝熟料中铝酸钠的浸出时间短、碱耗低、氧化铝浸出率高、浸出工艺简单。
3)利用缩核模型对氧化铝熟料铝酸钠(NaAlO2)的浸出过程进行动力学分析。结果表明,反应符合混合控制,浸出反应活化能较低。
4)对比研究氧化铝熟料浸出前后矿物相和形貌结构变化,发现氧化铝熟料中铝酸钠浸出后,铝酸钠溶解形成孔洞,呈蜂窝状。

