加氢对乙醇燃料层流燃烧特性的影响
吴巨龙, 陈家兴, 严 俊
(江苏科技大学 机械工程学院, 江苏 镇江 212000)
能源是人类在地球上得以延续和发展进步的物质基础之一,常规能源以矿物能源为主,截至2020年,全球使用能源的82%主要来自矿物燃料,包括煤炭、石油和天然气[1-3].随着全球经济的增长,汽车行业飞速发展,但传统内燃机对于石油的依赖性很强,这就使人们对石油的需求量持续升高,而大的需求量导致石油燃烧产生大量污染物,这些污染物会对全球环境和人类健康造成严重的危害[4-8].
近年来,为了应对化石燃料短缺和内燃机广泛应用带来的污染问题,替代燃料备受关注.目前可以用于替代内燃机燃料的有天然气、合成气和其他生物燃料,其中可再生生物燃料,如生物柴油和生物乙醇,是目前研究的热点.生物乙醇,原料来自木质纤维素、玉米、木材等,被认为是最有前途的一种火花点火发动机的替代燃料,具有热效率高、排放低等优点[9-12].另一个备受关注的清洁能源是氢气.氢气与碳氢燃料混合可以提高燃料的火焰速度,从而提高内燃机的热效率,而氢气在燃烧后不会产生污染,是一种非常洁净的能源,而且氢气本身还可以作为助燃剂提高内燃机的打火效率[13-15].因此,对富氢乙醇发动机的研究很有价值,但是目前的研究大部分围绕它的性能和排放方面展开,对一些基础的燃烧性质关注较少.
国内外许多学者对乙醇或者氢气的层流燃烧特性进行了研究,但是对于含氢乙醇的层流燃烧特性研究较少.Xu等[16]研究了包含乙醇、乙酸乙酯、乙醚、丙酮和2-丁酮混合燃料的层流燃烧特性,实验结果表明:当量比为1.1的时候,混合燃料的燃烧速度最快;在相同当量比下,层流燃烧速度随初始温度的升高而增加,随初始压力的增加而降低;马克斯坦长度随当量比的增大而减小,当量比为1.4时,马克斯坦长度小于零,说明火焰不稳定性随着当量比的增大而增大.Li等[17]研究了加氢对甲烷、乙烷和丙烷的层流火焰速度的影响,结果表明:随着氢气质量分数的增加,甲烷层流燃烧速度的增加幅度明显大于其他2种燃料.Li等[10]研究了在383 K、0.1 MPa下不同当量比的乙醇氢气混合物的层流燃烧特性,结果显示:当量比低于1.4时,马克斯坦长度随氢气质量分数的增加而减小,表明火焰不稳定性随氢气质量分数的增加而增加,而当量比大于1.4时则有相反的结论.
实验采用定容燃烧弹法,配合纹影系统,通过向外传播的球形火焰来观察层流火焰的燃烧特性.采用数值模拟仿真计算的方法,从化学反应动力学的角度分析了乙醇-氢气混合燃料的层流燃烧特性.
1 实验装置与方法
1.1 实验装置
实验是在定容燃烧弹内完成的,采用了Z型的高速纹影系统以及图像采集系统来拍摄火焰传播时的纹影图像,实验装置如图1所示,主要包括定容燃烧弹系统,纹影成像系统,点火系统和数据采集系统.

图1 实验装置Fig.1 Experimentalsetup
实验采用的定容燃烧弹是一个外形轮廓为0.2 m×0.2 m×0.2 m的正方体,内部容积为2.067 L.定容燃烧弹的6个外表面均预留了直径为122 mm的安装孔,2个相对的侧面安装了直径为90 mm的透明玻璃,这给Z型纹影成像系统提供了光学通道.剩余的几个面安装了加热功率为60 W的加热电阻以及温度和压力传感器,通过加热定容燃烧弹间接将其内部的乙醇-氢气-空气混合气加热到指定温度.每次实验前使用真空泵将定容燃烧弹内压力抽至0.01 MPa以下,低压的环境可以使得乙醇快速汽化.定容燃烧弹内有2个直径0.4 mm的铂金电极丝,点火系统控制其产生大约0.015 J的能量进行电火花点火.实验时,高速摄像机、点火系统、示波器通过同步触发器同时启动,保证点火后实时记录图像和信号信息.实验结束后冲洗定容燃烧弹内废气5次以保证下次实验的正确性.
实验设置初始温度为400 K,初始压力为0.1 MPa,当量比为0.7~1.6,每次实验重复3次以保证结果的准确性.
1.2 定压法计算层流燃烧速度
定压法通常又被称为图像法,定压法计算层流燃烧速度即根据火焰的纹影图像来计算层流燃烧速度.在实验过程中,定容燃烧弹内部的球形火焰通常都会受到点火能量和容弹弹体的影响,因此火焰在传播时分为3个阶段,分别为点火影响阶段、准稳态阶段以及容壁限制阶段.在火焰发展前期和火焰后期均不符合准稳态燃烧条件,因此本实验数据拟合的时候采用准稳态燃烧阶段.
初始温度为400 K,初始压力为0.1 MPa下,某一时刻火焰前锋半径为图2所示的内圆半径.

图2 火焰前锋半径Fig.2 Flame front radius
根据式(1)可以计算出实际火焰半径,
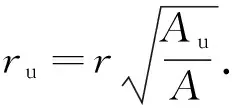
(1)
式中:ru为实际火焰半径,mm;Au为纹影火焰面积,mm2;A为纹影视窗面积,mm2;r为实际视窗半径,mm.
在获得了实际火焰半径后,拉伸火焰传播速度可以由式(2)得到,

(2)
式中,Sb为拉伸火焰传播速度,mm·s-1;t为点火后经过的时间,s.拉伸火焰传播速度是火焰半径ru对时间t的变化率.火焰在传播期间会受到拉伸作用的影响,火焰拉伸率代表球状火焰面上一个无限小单元面积的对数对时间的变化率,而对于球形膨胀火焰,对火焰拉伸率的推导过程如下:

(3)
式中,α为火焰拉伸率,s-1.
为了得到无拉伸层流火焰速度,必须消除火焰拉伸率对拉伸火焰传播速度的影响,一般用外推法来消除影响[16,18],包括线性外推法和非线性外推法.非线性外推法可以用式(4)来表示,

(4)

层流燃烧速度可以反映预混燃料的燃烧特性,也对燃烧模型的建立和化学反应动力学的验证有着重要作用.虽然燃料燃烧过程受膨胀的影响,但可以认为准稳态燃烧期间的压力是常数,根据质量守恒原理,初始状态下层流燃烧速度可以表示为
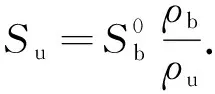
(5)
式中:ρb和ρu是已燃气与未燃气的密度, kg·m-3,可以通过Chemkin热平衡反应模型得到;Su是混合气在初始温度和初始压力下的层流燃烧速度,mm·s-1.
由于火焰面前后的已燃气和未燃气密度的不连续性,流体动力学不稳定性总会出现在球形膨胀火焰中.火焰厚度是反应层流预混火焰不稳定性的一个重要参数,本文采用黏性火焰厚度来计算,见式(6).
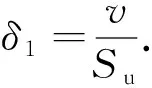
(6)
式中:δ1为黏性火焰厚度,mm;v是未燃气的动力黏度,mm2·s-1.
2 结果与讨论
2.1 拉伸火焰传播速度
乙醇和含体积分数为50%的氢气的乙醇混合气燃烧拉伸火焰传播速度随火焰拉伸率的变化如图3所示.从图中可以看到,拉伸率对拉伸火焰传播速度有显著的影响,随拉伸率的增加拉伸火焰传播速度减小,特别是在低当量比时尤为明显,同时当量比φ范围为0.7~1.4时,含有50%氢气的乙醇燃料在低当量比时也可以被点燃,而乙醇却不可以,这代表添加氢气可以降低乙醇的可燃极限.由于乙醇和氢气扩散特性不同,氢气的扩散系数明显高于乙醇,因此氢气的加入促进了乙醇的扩散,从而增加了乙醇空气的不稳定性,使乙醇的可燃烧范围得到了提升.将拉伸火焰传播速度随火焰拉伸率的变化关系采用非线性外推的方法外推至拉伸率α=0时,即可得到该当量比下的无拉伸火焰传播速度.图3(a)显示乙醇燃料在当量比为1.2时获得了最大无拉伸火焰传播速度,为3.95 m·s-1.,而在图3(b)中含有50%氢气的乙醇燃料在当量比为1.3时获得了最大无拉伸火焰传播速度,为5.58 m·s-1,结果表明含有50%氢气的乙醇燃料比纯乙醇的最大无拉伸火焰传播速度快,增值为1.63 m·s-1..

(a) 乙醇(b) 含50%氢气的乙醇
2.2 层流燃烧速度
乙醇和含有50%氢气的乙醇层流燃烧速度随当量比的变化如图4所示.含有50%氢气的乙醇层流燃烧速度明显大于纯乙醇的层流燃烧速度,同一当量比下层流燃烧速度差值最大达到394 mm·s-1.这是由于乙醇-氢气混合气的层流燃烧速度受到了氢气的影响,氢气的化学反应速率要比乙醇大得多,在纯乙醇燃料中加入氢气使得混合燃料的总体化学反应速率得到提升,混合燃料的层流燃烧速度变快.同时从图中还可以看出在富燃一侧含有50%氢气的乙醇混合气的层流燃烧速度比纯乙醇快得多,而在贫燃一侧这个差值没那么大.横向来看,纯乙醇层流燃烧速度在当量比为1.2时达到最大值,含有50%氢气的乙醇层流燃烧速度在当量比为1.3时达到最大值,表明燃料的层流燃烧速度随当量比的增大先变大再减小,而且随着大量氢气的加入,乙醇层流燃烧速度的最大值往右偏移.

图4 乙醇和含有50%氢气的乙醇层流燃 烧速度随当量比的变化Fig.4 The laminar burning rate of ethanol and ethanol containing 50% hydrogen varies with the equivalent ratio
2.3 火焰厚度
乙醇和含有50%氢气的乙醇燃烧火焰厚度随当量比的变化如图5所示.燃料在燃烧过程中存在流体动力学不稳定性,火焰厚度越大,其流体动力学稳定性越好.对应不同当量比,纯乙醇的火焰厚度总是大于含有50%氢气的乙醇混合燃料的火焰厚度.这表明在乙醇中添加氢气使混合燃料的火焰厚度减小,流体动力学不稳定性增大.横向来看,随着当量比的增加,纯乙醇和含50%氢气的乙醇燃烧火焰厚度均先减小后增大,且在当量比为1.2时取得最小值,分别为30.368 μm和26.588 μm.

图5 乙醇和含50%氢气的乙醇燃烧火焰 厚度随当量比的变化Fig.5 Flame thickness changes of ethanol and ethanol containing 50% hydrogen with equivalent ratio
2.4 马克斯坦长度
乙醇和含50%氢气的乙醇燃烧火焰的马克斯坦长度随当量比的变化如图6所示.马克斯坦长度的绝对值反应了拉伸火焰传播速度对于拉伸率的敏感程度,当马克斯坦长度为正值时,说明拉伸火焰传播速度随拉伸率的增大而减小,火焰前锋面结构趋于稳定,负值时则相反.从图中可以看出,乙醇和含50%氢气的乙醇燃烧火焰的马克斯坦长度都随当量比的增大而减小.乙醇在当量比为0.9~1.4情况下,火焰的马克斯坦长度为正值,火焰前锋面结构趋于稳定,而在当量比为1.5~1.6时变成了负值,说明在高当量比情况下火焰前锋面结构变得不稳定.含50%氢气的乙醇在当量比为0.7~1.6区间内,其马克斯坦长度皆为正值,火焰前锋面结构趋于稳定.

图6 乙醇和含50%氢气的乙醇燃烧火焰的 马克斯坦长度随当量比变化Fig.6 The Markstein length of ethanol and ethanol containing 50% hydrogen varies with the equivalent ratio
2.5 数值仿真结果
使用Chemkin软件对乙醇和含有50%氢气的乙醇层流燃烧进行了数值仿真模拟,仿真所用到的乙醇氧化机理由Marinov[19]提出,氢气氧化机理由Frenklach等[20]提出,通过优化整合乙醇和氢气的氧化机理,模拟出了乙醇-氢气混合气的燃烧过程.乙醇和含50%氢气的乙醇层流燃烧速度实验值与数值仿真结果的比较如图7所示,从图中可以看到,仿真结果很好地预测了层流燃烧速度的整体趋势,乙醇仿真结果相较于实验结果的平均相对偏差为5.8%.含有50%氢气的乙醇混合气的仿真结果相较于实验结果的平均相对偏差为8.6%.
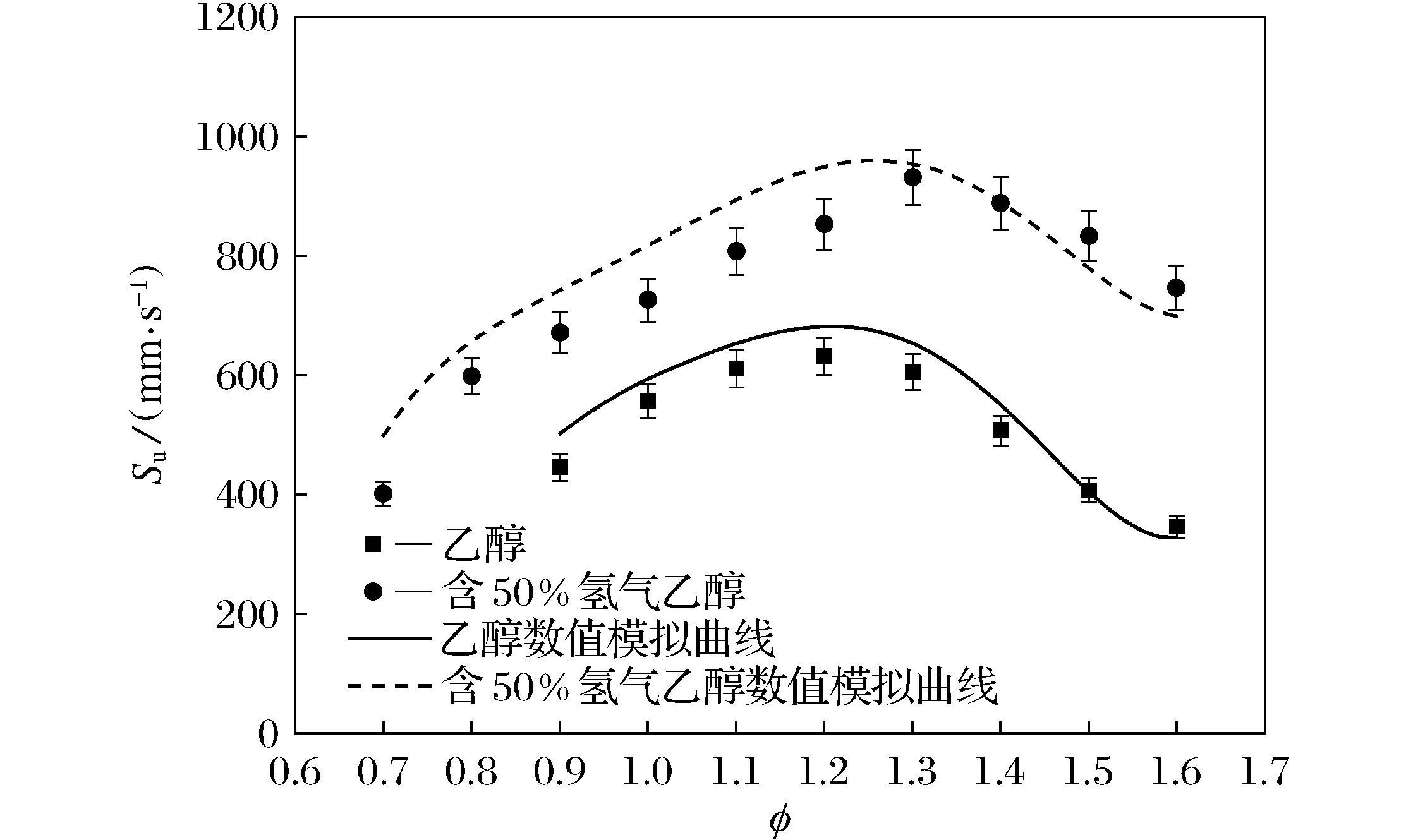
图7 乙醇和含50%氢气的乙醇层流燃烧速度 实验值与数值仿真结果的比较Fig.7 Comparison of experimental values and numerical simulation results of the laminar combustion rate of ethanol and ethanol containing 50% hydrogen
当量比φ=1.2时乙醇和含有50%氢气的乙醇燃烧中自由基H·、O·和OH·的摩尔分数分布如图8所示.随火焰距离的延长,乙醇和含50%氢气的乙醇的燃烧过程中自由基H·、O·和OH·的摩尔分数都呈现先增大再减小的趋势.由于H·、O·和OH·具有很强的扩散性,所以H·、O·和OH·摩尔分数的大小会直接影响燃料整体的化学反应速率.从图中可以看出,含50%氢气的乙醇燃烧在每一个火焰距离下,H·、O·和OH·的摩尔分数总是比乙醇大,说明含50%氢气的乙醇混合燃料的整体化学反应速率快,这同时也验证了图4中含50%氢气的乙醇混合燃料的层流燃烧速度总是比乙醇快.因此,在乙醇燃料中加入氢气后,燃料燃烧过程中整体的H·、O·和OH·的摩尔分数上升,燃料的层流燃烧速度变大.
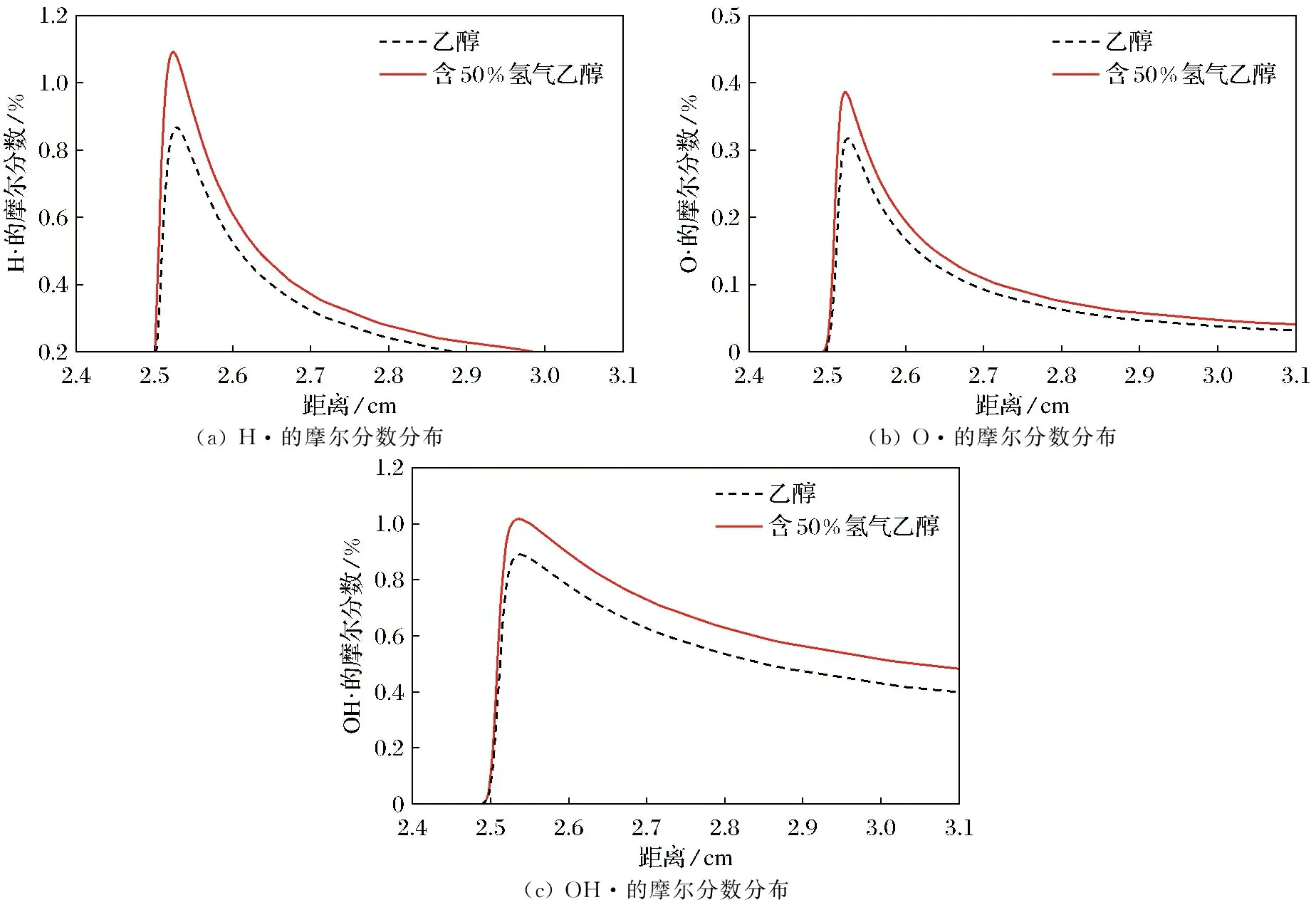
(a) H·的摩尔分数分布(b) O·的摩尔分数分布(c) OH·的摩尔分数分布
乙醇和含有50%氢气的乙醇混合燃料在当量比为0.9、1.2、1.4时燃烧敏感性分析如图9所示.图中列出了对燃料燃烧过程中敏感性最大的10个基元反应,分别是图中正值表示该基元反应对燃烧有促进作用,可以加快反应进程,提高层流燃烧速度,负值表示结果与正值相反. 最终的层流燃烧速度快慢取决于各基元反应共同作用的结果.乙醇和含有50%氢气的乙醇混合气对反应H·+O2=O·+OH·(R1)最敏感,该基元反应通过消耗一个自由基H·产生2个自由基O·和OH·,对燃料燃烧有促进作用,并且随当量比的增加,R1的敏感性系数变大,这表明在富燃条件下基元反应R1对燃料燃烧促进作用更明显.而同样具有促进作用的基元反应CO+OH·=CO2+H·(R24),随当量比的增加,R24的敏感性系数下降,在当量比为0.9时对燃烧的促进作用最大,所以当量比为0.9时,基元反应R24是第二敏感反应.当量比升高至1.4时,基元反应HCO·+M=H·+CO+M(R26)为第二敏感反应,由此推断高当量比有利于燃烧中间物的产生.

(a) 乙醇燃烧敏感性(b) 含50%氢气的乙醇燃烧敏感性
3 结 论
在初始温度为400 K,初始压力为0.1 MPa的定容燃烧弹中,探讨了乙醇和含有体积分数为50%氢气的乙醇在当量比为0.7~1.6内的层流燃烧特性,得出以下结论.
1) 氢气的加入可以有效降低乙醇的可燃极限,提高乙醇的层流燃烧速度.在相同的初始条件下,改变燃料当量比,含有50%氢气的乙醇的层流燃烧速度总体趋势与乙醇相似;在燃料富燃一侧,含有50%氢气的乙醇的层流燃烧速度比乙醇快,在贫燃一侧两者差距不是很大;同时氢气的加入使含有50%氢气的乙醇混合燃料的层流燃烧速度峰值位置发生改变,向右产生偏移.
2) 在乙醇中加入氢气会使含有50%氢气的乙醇混合燃料燃烧火焰厚度减小,对流体动力学不稳定性造成一定影响.
3) 乙醇和含有50%氢气的乙醇燃烧火焰的马克斯坦长度均随当量比的增加而减小;乙醇燃烧火焰的马克斯坦长度在当量比为1.5~1.6时出现负值,其火焰前锋面结构变得不稳定;含50%氢气的乙醇燃烧火焰的马克斯坦长度均为正值,其火焰前锋面结构趋于稳定.
4) 在不同的工况条件下,通过数值模拟预测了层流燃烧速度的变化趋势,在乙醇中加入氢气后,燃料燃烧过程中整体的H·、O·和OH·的浓度上升,燃料整体化学反应速率增大,从而提高了混合燃料的层流燃烧速度.

