抗PD-1单抗对中晚期肝癌患者近期疗效、外周血T淋巴细胞亚群指标的影响
殷云飞 鲁邱阳

【摘要】 目的:探討给予中晚期肝癌患者程序性死亡受体(PD-1)单抗治疗的近期效果以及对其外周血T淋巴细胞亚群相关指标的影响。方法:选取2018年7月-2019年8月本院收治的50例中晚期肝癌患者,随机数字表法将其分为研究组和对照组,各25例,对照组给予甲苯磺酸索拉非尼片以及奥沙利铂,研究组给予抗PD-1单抗治疗。比较两组近期疗效、外周血T淋巴细胞亚群指标水平、血清细胞因子水平及不良反应发生情况。结果:治疗3个月后,研究组总有效率为76.00%,高于对照组的48.00%,差异有统计学意义(P<0.05)。研究组死亡率为4.00%,与对照组的12.00%比较,差异无统计学意义(P>0.05)。治疗前,两组外周血CD3+、CD4+、CD8+、CD4+/CD8+水平及aFGF、bFGF、VEGF水平比较,差异均无统计学意义(P>0.05);治疗后,研究组T淋巴细胞亚群各指标水平均高于对照组,各血清细胞因子水平均低于对照组,差异均有统计学意义(P<0.05)。研究组不良反应发生率为16.00%,低于对照组的44.00%,差异有统计学意义(P<0.05)。结论:给予中晚期肝癌患者抗PD-1单抗治疗近期效果明显,可有效改善患者外周血T淋巴细胞亚群指标水平及血清细胞因子水平,控制病情发展。
【关键词】 肝癌 PD-1 淋巴细胞亚群
Effect of Anti PD-1 Monoclonal Antibody on Short-term Efficacy and Peripheral Blood T Lymphocyte Subsets in Patients with Advanced Liver Cancer/YIN Yunfei, LU Qiuyang. //Medical Innovation of China, 2021, 18(13): 0-022
[Abstract] Objective: To investigate the short-term effect of programmed death receptor (PD-1) monoclonal antibody therapy in patients with advanced liver cancer and its effect on peripheral blood T lymphocyte subsets related indexes. Method: A total of 50 patients with advanced liver cancer admitted to our hospital from July 2018 to August 2019 were selected. They were divided into study group and control group by random number table, 25 cases in each group. The control group was treated with Sorafenib Toluenesulfonate Tablets and Oxaliplatin, and the study group was treated with anti PD-1 monoclonal antibody. The short-term efficacy, peripheral blood T lymphocyte subsets, serum cytokine levels and the incidence of ADR were compared between the two groups. Result: After 3 months of treatment, the total effective rate of the study group was 76.00%, which was higher than 48.00% of the control group, the difference was statistically significant (P<0.05). The mortality rate in the study group was 4.00%, compared with 12.00% in the control group, the difference was not statistically significant (P>0.05). Before treatment, there were no significant differences in the levels of CD3+, CD4+, CD8+, CD4+/CD8+ and the levels of aFGF, bFGF and VEGF in peripheral blood between two groups (P>0.05). After treatment, the levels of T lymphocyte subsets in the study group were higher than those in the control group, and the levels of serum cytokines were lower than those in the control group, the differences were statistically significant (P<0.05). The incidence of adverse reactions in the study group was 16.00%, lower than 44.00% in the control group, the difference was statistically significant (P<0.05). Conclusion: Anti PD-1 monoclonal antibody can achieve obvious short-term effect in the treatment of patients with advanced liver cancer, which can effectively improve the levels of peripheral blood T lymphocyte subsets and serum cytokines, and control disease progression.
[Key words] Liver cancer PD-1 Lymphocyte subsets
First-authors address: The Third Affiliated Hospital of Chongqing Medical University, Chongqing 401120, China
doi:10.3969/j.issn.1674-4985.2021.13.005
肝癌是临床常见的恶性肿瘤,相关研究显示我国肝癌发病率以及死亡率均为全球首位[1-2],严重影响人们的身心健康。肝癌早期诊断困难且病情进展迅速,约80%的患者确诊时已经是中晚期,该类患者往往预后不佳[3-4]。临床上对于早期患者以手术治疗为主,中晚期患者治疗的方法仍然以放射介入、化疗、靶向治疗等手段为主,但治疗结果往往不尽人意[5]。近年来,随着研究进展,免疫治疗逐渐成为肝癌研究的热点,目前研究认为,采取程序性死亡受体PD-1单抗治疗对肿瘤细胞有一定抑制作用,PD-1属于免疫抑制分子,通过调节免疫作用可杀死癌细胞、对抗肿瘤[6-7]。本文主要探讨了给予中晚期肝癌患者抗PD-1单抗治疗的近期效果以及对其外周血T淋巴细胞亚群相关指标的影响作用,以期为临床提供参考,现报道如下。
1 资料与方法
1.1 一般资料 选取2018年7月-2019年8月本院收治的50例肝癌患者为研究对象。纳入标准:(1)经临床相关检查确诊为中晚期肝癌;(2)临床资料完整;(3)预计生存时间超过12周。排除标准:(1)心、肾、肺等重要器官代谢功能障碍者;(2)可正常交流者;(3)有免疫系统、内分泌系统、感染性疾病及恶性肿瘤者;(4)无法耐受抗PD-1单抗治疗者;(5)近期准备接受肝移植或已接受肝移植者;(6)近一个月接受过其他肝脏病灶局部治疗;(7)有明显临床症状的中枢神经系统转移者;(8)妊娠期或哺乳期者。随机数字表法将患者分为研究组和对照组,各25例。患者签署研究知情同意书,研究经本院伦理委员会批准。
1.2 方法 对照组给予口服甲苯磺酸索拉非尼片(生产厂家:Bayer Schering Pharma AG,批准文号:H20130137,规格:0.2 g),0.4 g/次,2次/d,以及奥沙利铂(生产厂家:江苏奥赛康药业有限公司,批准文号:国药准字H20064297,规格:0.1 g)100 mg/m2,静脉滴注,1次/2周。研究组给予抗PD-1单抗治疗,选择纳武利尤单抗注射液(生产厂家:Bristol-Myers Squibb Holdings Pharma, Ltd.Liability Company,批准文号:注册证号S20180015,规格:100 mg︰
10 mL)3 mg/kg,静脉注射(2周为1个周期)。两组干预时间均为3个月。
1.3 观察指标及判定标准 (1)疗效评价标准:完全缓解,所有病理性淋巴结短轴值<10 mm;部分缓解,目标病灶最大径之和减少≥30%;疾病进展,目标病灶最大径之和增加≥20%或有新病灶出现;疾病稳定,目标病灶未发生变化;死亡。总有效=完全缓解+部分缓解[8]。(2)外周血T淋巴细胞亚群:通过流式细胞仪对CD3+、CD4+、CD8+、CD4+/CD8+水平进行检测。采集患者EDTA抗凝血2 mL,向样品测定管中加50 μL抗凝血后再加入10 μL对应抗体,利用振荡器混匀,室温避光孵育20 min后再加入溶血素1 mL继续混匀,室温避光静置10 min,以1 200 r/min转速进行离心操作5 min,加入1 mL PBS缓冲液,继续以1 200 r/min转速进行离心操作5 min,加入400 μL PBS缓冲液,混匀后放入流式细胞仪进行检测。(3)血清细胞因子:通过酶联免疫吸附法对成纤维细胞生长因子(aFGF、bFGF)以及血管内皮生长因子(VEGF)进行检测。(4)不良反应:统计疲乏、恶心呕吐、发热、头晕等不良反应发生情况。
1.4 统计学处理 采用SPSS 20.0软件对所得数据进行统计分析,计量资料用(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 研究组男14例,女11例;年龄35~65岁,平均(50.69±8.05)岁。对照组男15例,女10例;年龄36~77岁,平均(51.14±8.27)岁。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组疗效比较 治疗3个月后,研究组总有效率为76.00%,高于对照组的48.00%,差異有统计学意义(字2=4.160,P=0.041)。研究组死亡率为4.00%(1/25),与对照组的12.00%(3/25)比较,差异无统计学意义(字2=1.087,P=0.297)。见表1。
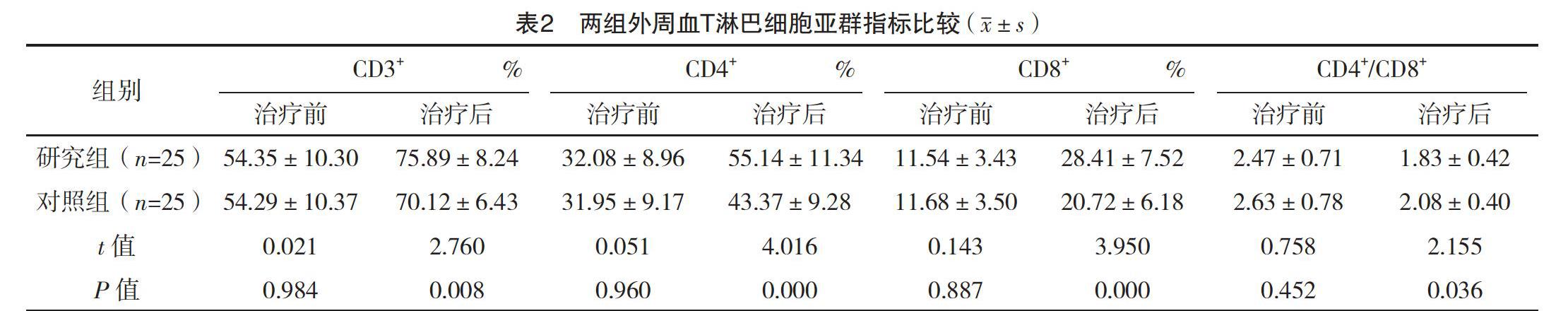
2.3 两组外周血T淋巴细胞亚群指标比较 治疗前,两组外周血CD3+、CD4+、CD8+、CD4+/CD8+比较,差异均无统计学意义(P>0.05);治疗后,研究组T淋巴细胞亚群各指标水平均高于对照组,差异均有统计学意义(P<0.05)。见表2。
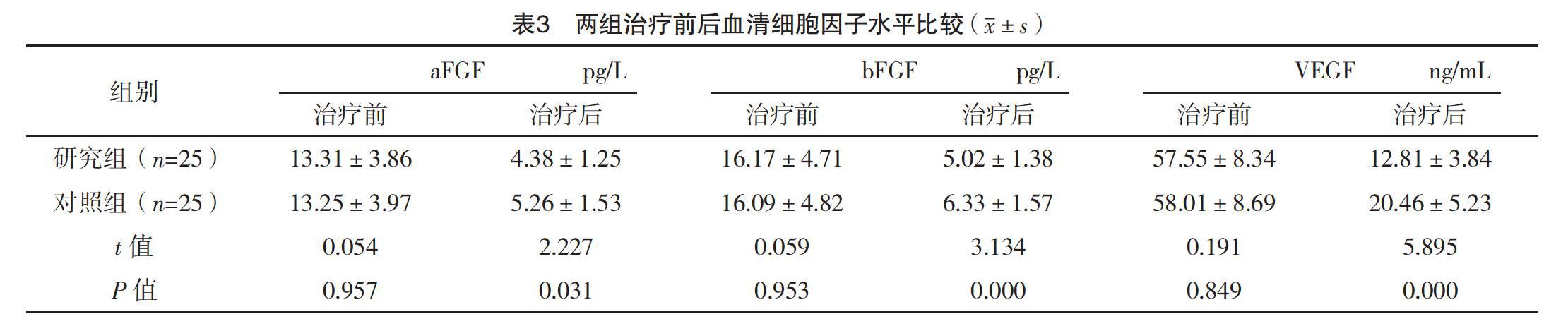
2.4 两组治疗前后血清细胞因子水平比较 治疗前,两组aFGF、bFGF、VEGF水平比较,差异均无统计学意义(P>0.05);治疗后,研究组各血清细胞因子水平均低于对照组,差异均有统计学意义(P<0.05)。见表3。
2.5 两组不良反应发生情况比较 研究组不良反应发生率为16.00%,低于对照组的44.00%,差异有统计学意义(字2=4.667,P=0.031),见表4。
3 讨论
在我國肝癌发生的主要原因是由慢性乙肝病毒感染引起的,同时还可能与黄曲霉毒素、遗传因素、肥胖及糖尿病、饮水污染等因素有关[9],临床表现为肝区疼痛,腹胀、恶心呕吐、食欲减退等消化道症状,可伴有发热、乏力、皮肤巩膜黄染、脾大、腹水等全身症状,临床影像学检查可见肝脏占位性病变[10-11]。当出现相关症状时应及早就医确诊,排除恶性肿瘤病变的可能性,给予针对性治疗[12]。对于肝癌患者手术是根治的最好方法,但对于无法耐受手术者,药物治疗、放射治疗、靶向治疗、免疫治疗等更适合[13]。随着临床医疗技术的发展,抗PD-1抗体治疗开始应用于抗癌治疗,其机制为抗PD-1抗体通过阻断PD-1以及程序性死亡分子配体1(PD-L1)途径来阻断T细胞抑制信号从而促进肿瘤免疫微环境的改善,并提升对肿瘤细胞的清除及监视能力[14-15]。目前临床对于抗肿瘤药物的研制与试验正处于快速进展期,采取多中心协作研究推动新药物临床试验为临床治疗提供更多可能。
靶向药物虽可杀死一定肿瘤细胞,但患者长期接受靶向药物治疗可能产生耐药性,此时靶向药物治疗抗肿瘤作用减弱。PD-1为重要免疫抑制分子,属于CD28超家族成员,可参与免疫活动,主要以下调免疫系统对人体细胞的反应以及对T细胞炎症活动进行抑制而促进调节自身免疫系统达到预防免疫性疾病的目的[16-17]。本研究结果显示治疗3个月后,研究组总有效率为76.00%,高于对照组的48.00%,差异有统计学意义(P<0.05)。治疗后,研究组T淋巴细胞亚群各指标水平及各血清细胞因子水平均优于对照组,差异均有统计学意义(P<0.05),提示抗PD-1单抗治疗中晚期肝癌患者临床效果好,可有效改善患者外周血T淋巴细胞亚群及血清细胞因子水平。分析其原因可能是PD-1主要存在于活化T淋巴细胞、巨噬细胞以及B淋巴细胞,另外多数肿瘤细胞表面还可表达PD-L1,并与存在于浸润淋巴细胞的PD-1分子发生结合,对CD3+、CD4+及CD8+T淋巴细胞功能分子释放具有抑制作用,最终致使淋巴细胞凋亡,加强免疫作用,促进杀伤肿瘤细胞[18]。CD8+T细胞在肿瘤中对肿瘤细胞具有监控和杀伤作用,而肝癌患者肿瘤微环境发生改变可对CD8+T细胞增殖、分化功能进行抑制,其水平降低,经过治疗后逐渐升高。成纤维细胞生长因子对平滑肌细胞具有增殖作用,并可促进提高内皮细胞游走能力,最终使新血管形成,同时血管内皮生长因子也可诱导新血管形成,进而促进生成肿瘤血管,故认为血清细胞因子可促进病灶形成。另外本研究还显示研究组不良反应发生率为16.00%,低于对照组的44.00%,差异有统计学意义(P<0.05),提示抗PD-1单抗治疗较靶向药物治疗其副作用更轻,患者出现的疲乏、恶心呕吐、发热、头晕等不良反应可能是由于患者自身免疫系统受损以及治疗药物常见不良反应,经过对症处理后患者不良反应减轻或消失。有报道指出抗PD-1抗体不仅在肝癌治疗中效果明显,在非小细胞肺癌、胃癌、结直肠癌、霍奇金淋巴瘤、黑色素瘤等中也有明显效果[19-20],但由于临床费用较高,多数患者无法承担,只能选择其他治疗方式。
综上所述,对中晚期肝癌患者给予抗PD-1单抗治疗近期效果显著,对患者外周血T淋巴细胞亚群相关指标有一定影响作用,但本研究样本量较少,其临床具体价值及安全性有待进一步扩大样本量、展开长期随访进行深入分析。
参考文献
[1]詹磊,程良斌,蔡岳.塞来昔布抑制COX-2和PD-1发挥抗肝癌作用[J].中国免疫学杂志,2018,34(4):595-599.
[2] Burkhart R A,Ronnekleiv-Kelly S M,Pawlik T M.Personalized therapy in hepatocellular carcinoma:Molecular markers of prognosis and therapeutic response[J].Surg Oncol,2017,26(2):138-145.
[3]刘瑾.抗PD-1单抗治疗晚期恶性肿瘤的疗效及安全性分析[D].杭州:浙江大学,2019.
[4]孙涛,任衍乔,操焱焱,等.免疫检查点抑制剂联合治疗肝癌的进展[J].临床肝胆病杂志,2020,36(6):1386-1388.
[5]杜飞,高春芳.基于抗PD-1/PD-L1单抗免疫阻断治疗以及疗效相关标志物的研究进展[J].现代免疫学,2019,39(4):322-326.
[6]王锋,秦叔逵,方维佳,等.抗PD-1单抗SHR-1210治疗原发性肝癌引发皮肤毛细血管增生症的临床病理报告[J].临床肿瘤学杂志,2017,22(12):1066-1072.
[7]白日兰,崔久嵬.实体肿瘤免疫相关疗效评价标准的研究进展[J].中国肿瘤生物治疗杂志,2018,25(7):663-668.
[8] Remy-Ziller C,Thioudellet C,Hortelano J,et al.Sequential administration of MVA-based vaccines and PD-1/PD-L1-blocking antibodies confers measurable benefits on tumor growth and survival: Preclinical studies with MVA-βGal and MVA-MUC1 (TG4010) in a murine tumor model[J].Hum Vaccin Immunother,2018,14(1):140-145.
[9] Shi S,Rao Q,Zhang C,et al.Dendritic Cells Pulsed with Exosomes in Combination with PD-1 Antibody Increase the Efficacy of Sorafenib in Hepatocellular Carcinoma Model[J].Transl Onco,2018,11(2):250-258.
[10]马银娟,潘耀柱.PD-1/PD-L1通路在血液系统疾病中的研究进展[J].现代肿瘤医学,2020,28(16):2905-2909.
[11]王毅欣,胡宗涛,张永康,等.PD-1治疗晚期原发性肝癌患者的安全性及临床疗效观察[J].肿瘤防治研究,2020,47(4):298-302.
[12] Natarajan A,Patel C B,Habte F,et al.Dosimetry Prediction for Clinical Translation of 64Cu-Pembrolizumab ImmunoPET Targeting Human PD-1 Expression[J].Sci Rep,2018,8(1):633.
[13] Mamdani H,Wu H,ONeil B H,et al.Excellent Response to Anti-PD-1 Therapy in a Patient With Hepatocellular Carcinoma: Case Report and Review of Literature[J].Discov Med,2017,23(128):331-336.
[14]崔春晓,杨柳晓,王颖,等.肝癌患者肝移植术前使用PD-1抑制剂对移植后排斥反应的影响[J].中国临床医学,2020,27(3):444-447.
[15]李小松,姜濤.PD-1/PD-L1在肝细胞癌预后判断作用中的研究进展[J].山东医药,2020,60(10):102-105.
[16]王心然,贾迎,刘月平,等.PD-1/PD-L1检测点抑制剂抵抗机制的研究进展[J].中华病理学杂志,2018,47(12):975-978.
[17] Gordon S R,Aute R L,Dulken B W,et al.PD-1 expression by tumour-associated macrophages inhibits phagocytosis and tumour immunity[J].Nature,2017,545(7655):495-499.
[18]侯思楠,王卫东,钟泽龙,等.不可逆电穿孔消融术联合PD-1抑制剂治疗小鼠肝癌效果初步研究[J].介入放射学杂志,2019,28(5):454-458.
[19]周晓思,秦蓉,赵红川,等.PD-1/PD-L1在原发性肝癌中的表达及临床意义[J].肝胆外科杂志,2019,27(1):66-69.
[20]程小珍,李晓东,王顺兰,等.肝癌患者TACE治疗前后外周血PD-1、PD-L1的表达及临床意义[J].中国现代医学杂志,2019,29(3):33-37.
(收稿日期:2020-08-18) (本文编辑:姬思雨)

