化脓性链球菌磷酸酶转移系统研究进展
宋英莉, 陈竑量, 王胜钰, 蔡明辉, 朱 辉
(哈尔滨医科大学 生理学教研室,黑龙江 哈尔滨 150081)
磷酸烯醇丙酮酸依赖性磷酸转移酶系统(Phosphoenol pyruvate-dependent phosphotransferase pathway,PTS),又称磷酸酶转移系统,是存在于大多数细菌中的碳水化合物转运系统,是细菌以磷酸烯醇式丙酮酸(Phosphoenolpyruvate,PEP)为原料,通过碳水化合物的运输和磷酸化,进行糖摄取的一种方法。PTS系统是一个自启动的运输系统,也是细菌参与糖代谢的关键信号转导通路之一,PTS系统蛋白可使细胞中的其他蛋白磷酸化,发挥趋化和代谢调节的作用[1-3]。化脓性链球菌(Streptococcuspyogenes),也称A组链球菌(group AStreptococcus, GAS),是一种引起多种人类疾病的革兰阳性病原体,可定殖于宿主中的多种组织[4],引发常见的感染性疾病,如咽炎、脓疱病,也可以引起严重的侵袭性感染,如坏死性筋膜炎、菌血症和肾小球肾炎等[5-6]。化脓性链球菌可以优先通过调节PTS系统基因表达来调节碳水化合物的利用(如葡萄糖的摄取)、适应环境变化和改变自身毒力因子表达[7-8]。本文将对化脓性链球菌PTS系统的组分、调节以及对糖摄取和毒力表达的影响进行简要综述。
1 磷酸酶转移系统介绍
1.1 磷酸酶转移系统组分概述
目前的研究表明,化脓性链球菌多种亚型具有14种PTS,用于转运葡萄糖和非葡萄糖碳水化合物。该系统主要由三类蛋白质构成,分别为糖特异性PTS系统通透酶(EII)、通用PTS系统蛋白酶I(EI)和含组氨酸蛋白(HPr)[2]。图1为PTS系统的组成。
1.1.1 EI的编码和功能 由ptsI基因编码。EI的氨基端结构域可以与P-HPr发生可逆的磷酸化反应,在组氨酸残基15处磷酸化HPr形成P~His-HPr,这一过程依赖于pH和温度,再通过EII将糖摄取并发生磷酸化(如6-磷酸-葡萄糖),最后将磷酸化的糖引入糖酵解途径。EI的羧基端结构域主要发挥调节EI活性的作用,参与糖类(如葡萄糖)摄取过程的PEP自磷酸化反应。PEP自磷酸化需要一种具有相同亚基的活性二聚体蛋白,并在Mn2+或Mg2+和PEP的影响下发生作用[2,9-10]。
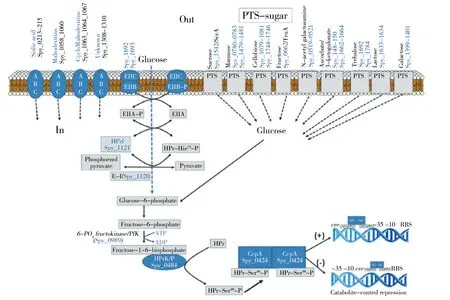
图1 PTS系统的种类与组成[2]Fig.1 The species and composition of PTS system
1.1.2 HPr的编码和功能 由ptsH基因编码,分子量在9 000~10 000 Da之间,是细胞代谢状态的传感器。HPr存在两种磷酸化激活方式,并在磷酸化状态的变化中发挥糖类摄取、调节毒力等多种功能,其磷酸化可以发生在HPr中His-15残基处的PEP依赖性磷酸化,主要用于PTS系统葡萄糖转运功能;也可以发生在葡萄糖生长期间的Ser-46处,这一过程依赖ATP,主要用于PTS系统的自身调节。在化脓性链球菌中存在四种不同形式的HPr:去磷酸化HPr,HPr在His-15(P~His-HPr)或Ser-46(P~Ser-HPr)磷酸化,以及双磷酸化HPr。细胞可通过在保守的组氨酸和丝氨酸残基上分别进行不同的磷酸化方式来确定自身能量水平[2-3,8-9,11]。
1.1.3 EII的编码和功能 EII由两种亲水的细胞质结构域(IIA和IIB)和两种疏水的跨膜结构域(IIC和IID)组成[1]。出现形式可为复合物中的蛋白质亚基(如IIAGlc-IICBGlc)或单链多肽结构域(例如IICBAGlcNAc)。EII负责碳水化合物的跨膜运输和利用[12],IIA和IIB通过将HPr上的磷酰基转移至被转运的糖上,并使其与IIC上的糖结合位点结合,实现PTS系统对糖类的有序转运和利用[9,13]。
1.2 磷酸酶转移系统的调节机制概述
在化脓性链球菌中,PTS系统的HPr蛋白是一种硬脂酰磷酸化细菌蛋白,是革兰阳性细菌中碳代谢的主要调节因子。HPr由于各种输入信号发生的磷酸化会反过来产生输出信号,对其他蛋白质发挥调节作用。
HPr存在两种磷酸化途径:第一种发生在His-15处的PEP磷酸化,最终使EII磷酸化;第二种发生在Ser-46处,需要ATP或焦磷酸盐作为磷酰基载体,由HPr激酶/P~Ser-HPr磷酸化酶(HPrK/P)催化的磷酸化反应。HPrK/P的激酶活性主要由1,6-二磷酸果糖(FBP)激活。
P~Ser-HPr通过反馈机制调节PTS传输活动。在以葡萄糖为碳源生长的细胞中,HPr与EIIAs具有较高的亲和力,HPr主要以P~Ser-HPr形式存在,此外还有少量的HPr以双重磷酸化HPr形式存在,即存在高浓度的P~Ser-HPr形式与低浓度的P~His-HPr。虽然P~His-HPr浓度低,但足以完全催化PTS系统介导的葡萄糖摄取,并控制PTS系统糖的摄取率。当两种或多种PTS糖同时转运或当不同形式的HPr的自然平衡受到干扰时(如额外部分的HPr被转化为P~Ser-HPr),P~His-HPr就会施加通量控制。
分解代谢物抑制(Catabolite repression,CCR)是当葡萄糖充足时,负责将复合碳水化合物分解成葡萄糖的基因被抑制的现象,它允许化脓性链球菌快速适应优选的或可快速代谢的碳和能源[14]。培养基中的碳源可以抑制某些基因和操纵子的表达,其基因产物通常与替代碳的利用有关。最近研究表明,几乎所有低GC革兰阳性生物,包括化脓性链球菌,PTS系统中HPr通过与碳分解代谢物蛋白A(CcpA)相互作用,能对CCR发挥调节作用[15]。CcpA是LacI/GalR转录调节因子家族的成员,是CCR的主要介质,对革兰阳性细菌代谢重要的各种基因的表达有控制作用[11]。
以葡萄糖为碳源生长的细胞中,PTS通过丧失HprK介导的ATP依赖性Hpr磷酸化(P~Ser-HPr)阻遏CCR,以防止劣质糖的代谢[16]。细胞中FBP作为活性CcpA辅助因子含量增加,促进了HprK/P催化的P~Ser-HPr形成。P~Ser-HPr与CcpA形成复合物并允许LacI/GalR型阻遏物与启动子区域中的分解代谢物反应元件(Catabolite reaction element,cre)位点结合,通过抑制或激活靶标的转录来介导CCR[2]。
此外,P~His-HPr中His-15通过与CcpA的相互作用为CCR和PEP依赖性PTS蛋白磷酸化之间的关系提供了联系,并由此通过弱化P~Ser-HPr与CcpA之间的相互作用影响革兰阳性细菌中的CCR[9,12]。
在没有可快速代谢的糖的情况下,P~His-HPr开始积累,P~His-HPr和P-EIIB也能够在转录反终止物(例如LicT)和激活物(例如Mt1R、LevR)的PTS调节结构域(PTS regulatory domain,PRD)内磷酸化保守组氨酸,从而调节表达的能力[9,12,17-18]。
2 磷酸酶转移系统的功能介绍
2.1 PTS系统对葡萄糖的摄取概述
PTS系统磷酸转移级联反应从EI和PEP开始。EI在保守的组氨酰残基的N-ε3位置发生PEP自磷酸化,磷酸化EI将磷酰基从PEP转移至磷酰基HPr中His-15的N-δ1位置 ,然后组氨酰磷酸化的HPr(P~His-HPr)将磷酰基转移到不同的转运复合物中。随后P~His-HPr通过EIIA和EIIB进入EIIC/D结构域。EIIA在His处被磷酸化,EIIB结构域在Cys或His处被磷酸化。PTS的所有细胞质复合物的磷酰基转移能够以最大的能量效率进行,而不会引起任何伴侣蛋白质所需的构象发生重大变化而招致能量损失[1-2,9-10,19]。图2为PTS系统的碳水化合物转运和磷酸化及其与糖酵解的偶联。过程反应式如下:
P-enolpyruvate+enzyme I(EI)P-EI+pyruvate
(1)
(2)
P-HPr+EIIA (domain or protein)P-EIIA+HPr
(3)
P-EIIA+EIIB (domain or protein)P-EIIB+EIIA
(4)
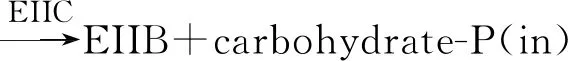
(5)
2.2 PTS系统对果糖等其他糖类摄取概述
fru操纵子fruRBA基因的表达在果糖存在下被高度诱导为操纵子,并且FruR充当操纵子的阻遏物,可与CcpA结合。研究表明FruA是化脓性链球菌中果糖生长和代谢主要的EII转运蛋白,FruR作为fru操纵子启动子的阻遏物,可能与CcpA一起,影响果糖摄取系统。其中,FruR去阻遏的生理诱导剂是果糖-1-磷酸(F1P),fruB将F1P转化为果糖-1,6-二磷酸(FBP),二者均以果糖为碳源,是化脓性链球菌生长必需的[20]。
以变性链球菌为例,果糖转运由至少两种不同的PTS系统介导。一种系统是组成型的,由EII、EI和热稳定蛋白组成。另一种系统是可诱导的,除EI和热稳定蛋白外,还需要一种可溶性底物特异性蛋白质IIIfru用于催化活性。另外发现IIIfru可以改变果糖磷酸转移酶的活性[21-22]。
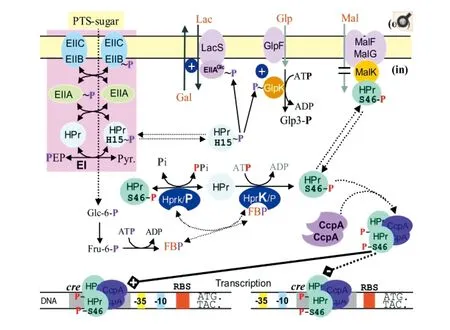
图2 PTS系统的碳水化合物转运和磷酸化[9]Fig.2 Carbohydrate transport and phosphorylation of PTS system[9]
3 磷酸酶转移系统对细菌毒力的影响机制
3.1 Hpr对细菌毒力的影响机制
PTS通用蛋白HPr与CcpA有紧密的关系。CcpA不仅能通过PTS系统在CCR中发挥作用,也是一个重要的毒力调节因子。Traci L. Kinkel和Kevin S. McIver等人的实验研究数据显示,在小鼠全身感染模型中,WT野生菌株在72 h时死亡率为50%,而ΔCcpA突变体在17 h即出现90%小鼠死亡,并有超过50%的小鼠表现出如直肠和口腔等身体部位的严重出血。这一结果表明,与WT野生菌株相比,ΔCcpA突变体的死亡速度更快、死亡率更高。在小鼠皮肤感染模型中,WT野生菌株病变区域的平均面积(12 mm2)明显小于ΔCcpA突变体病变区域的平均面积(18 mm2),具有统计学意义,但二者死亡率相同。这表明了CcpA可以抑制化脓性链球菌中的毒力因子表达,ΔCcpA突变体可导致全身和局部感染小鼠模型中的发病风险和病变严重程度增加[11]。有研究表明ΔCcpA突变体对巨噬细胞有更高的毒性[23],说明CcpA对细菌毒力有明显的影响。
3.2 EI对细菌毒力的影响机制
3.2.1 EI对毒力因子链球菌溶血素S(SLS)的影响 EI在控制局部皮肤感染部位的毒力方面很重要,Gera等[8]最近研究发现,功能性PTS不是引发皮下软组织感染所必需的,但是可以通过调节链球菌溶血素S(SLS)表达水平来影响小鼠皮下感染部位的病变严重性。SLS表达需要9个基因的sag操纵子,在指数生长期间,与野生菌株相比,EI突变体(ΔptsI)的sag转录水平显著提高近2倍,这表明在化脓性链球菌中EI能有效限制SLS的表达,从而限制体内病变的总体严重程度。在小鼠皮下感染模型中,经3×108cfu/mL接种并监测7 d后结果显示,与野生菌株相比,ΔptsI的感染病变区域更大、感染情况更严重,小鼠出现死亡更快。野生菌株病变区域面积在240 mm2左右,40 h时出现小鼠死亡,而ΔptsI病变区域面积达到600 mm2左右,并在24 h时即出现死亡现象。但二者死亡率并无差别,这说明EI在控制局部皮肤感染部位的毒力方面很重要,并且可能在限制传播到身体的其他部位中起CovS依赖性作用。此外,半胱氨酸蛋白酶(SpeB)是一种分泌性的毒力因子,被证明是化脓性链球菌皮肤感染模型的关键因素,包括溃疡性病变形成。EI可能以CovS依赖性方式减少SpeB分泌从而限制局部感染的病变大小和严重程度[8]。
3.2.2 HPr、EI对毒力因子Mga的影响 通用PTS蛋白EI和HPr能介导发生于Mga中心部分的特定组氨酸的Mga磷酸化,从而对Mga毒力调节因子的表达发挥影响,如PEP依赖性Mga的磷酸化强烈抑制emm(Mga调节的毒力基因之一)的体外表达。研究表明,Mga中心区域存在两个潜在PTS系统调节结构域(PRD)[24]。在指数生长期间,与野生菌株相比,EI突变体(ΔptsI)中转录水平降低2~3个对数级,表明功能性PTS在化脓性链球菌的对数期生长期间影响Mga依赖性毒力基因表达。体外实验表明,EI和HPr可以直接磷酸化和灭活含有Mga的PRD结构域[15,17]。体内实验表明,Mga PRD1的PTS磷酸化强烈导致Mga无活性,在化脓性链球菌的毒力基因调控和发病机制中起关键作用。当葡萄糖充足时,丝氨酸Hpr磷酸化(P~His-HPr)被限制,丝氨酸HPr磷酸化(P~His-HPr)的积累可与CcpA协同作用以增加Mga表达。但当缺乏优选的PTS糖时,P~His-HPr能够积累并促进由EI/Hpr介导的Mga的PRD1磷酸化,从而排除活性Mga多聚体的形成,导致Mga寡聚化并关闭Mga调节子的表达,抑制其活性。因此,PTS系统通用蛋白HPr/EI与Mga调节子的关联性密切,在疾病过程中起着重要作用[16-17,24]。
3.3 EII对细菌毒力的影响
Ganesh S. Sundar,Emrul Islam和Kanika Gera等人的研究表明,由manLMN编码的甘露糖特异性EII,如ManL(EIIAB)、ManM(EIIC)和ManN(EIID),不仅能影响PTS糖代谢(包括甘露糖),重要的是也在发病机制中起重要作用,有助于细菌在动物体内停留[25],起到防止SLS介导的溶血早期发作的作用。
实验结果表明,多个EIIC蛋白有助于对数生长期间sagA和溶血活性的表达。在小鼠皮下感染模型中,ManMN(EIICD)的丧失导致软组织感染期间局部病变严重程度增加、坏死增强,但不增加死亡率反而增加存活率:在注射细菌2 d时,注射野生菌株的小鼠病变面积约2 cm2,注射甘露糖EIIC缺失菌株的小鼠病变面积约3 cm2;注射细菌7 d,注射野生菌株的小鼠生存率约10%,注射甘露糖EIIC缺失菌株的小鼠生存率约25%[12]。
4 展 望
化脓性链球菌多种亚型具有多种磷酸酶转移系统,用于转运葡萄糖和非葡萄糖碳水化合物,研究表明PTS组分与糖摄取和SLS、Mga、sagA等毒力因子表达相关,在其他细菌中PTS组分还参与氮、铁、钾的代谢和营养缺失与理化因素刺激下的应激反应,具有十分重要的生物学功能与意义。近年来磷酸酶转移系统在化脓性链球菌中的组分与功能始终是一个热点问题,许多由PTS 介导的控制机制已经被证实,但化脓性链球菌与PTS 相关的控制机制和调节功能仍需要继续探索,并且对于GAS如何平衡糖代谢和铁代谢机制研究也有限,表明糖和铁吸收系统之间存在关联的证据不多,因此对化脓性链球菌PTS系统深入地研究与探索,可以为细菌毒力表达和临床防治细菌感染的研究方向提供坚实的科学理论指导和新思路。
目前临床治疗感染性疾病的主要手段仍然是使用抗生素,但是近些年抗生素滥用导致耐药性菌株大量出现。基础性研究需要深入研究细菌耐药机制,找出关键靶点,采取新策略,提高药物杀菌活性从而有效遏制耐药性产生。目前我们的研究发现,化脓性链球菌的铁摄取与PTS系统密切相关,并能引起细菌毒力的变化,因此细菌侵袭能力减弱可能是整体性营养物质吸收代谢的协同变化引起的。研究清楚调节糖代谢等复杂调节功能的PTS系统与铁摄取系统之间的关系,对于深入探究细菌的抗生素耐受机制有重要意义。
因此,对化脓性链球菌PTS系统所影响的调控网络和代谢通路进行深入研究,可能会在细菌的多种物质协同吸收和毒力表达改变方面有新的发现,PTS系统也有可能作为细菌特异性药物靶标用于新药物的研发,为降低临床耐药性和新药研发提供参考。