肠道菌群对蛋氨酸脑啡肽治疗肿瘤疗效的影响
呼芳竹, 陈 灏, 邓煜瑶, 王晓楠, 李胜军, 单风平
(中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122)
肠道菌群平衡在维持机体生理功能与健康中起着至关重要的作用,可影响多种生理和病理过程[1]。肠道菌群失调可能会触发炎症信号通路,其影响范围不仅仅是在肠道水平,而是涵盖整个免疫功能[2],因此可能导致癌症的发生和发展[3];微生物通过代谢药物和外源性物质、调节宿主炎症和免疫反应也会影响抗癌药物的治疗效果。近年来,肠道菌群与抗癌药物之间的相互作用引起了越来越多的关注,研究发现多种抗癌药物对无菌小鼠、广谱抗生素处理小鼠的治疗效果都有所降低[4-6],说明肠道菌群平衡对抗癌药物发挥良好活性有重要作用。蛋氨酸脑啡肽(Methionine enkephalin,MENK)是由肾上腺产生的前脑啡肽衍生出来的五肽,其不仅可调节神经内分泌活性,也可与多种细胞表面阿片受体结合产生不同的免疫效应[7],在细胞更新、伤口愈合、血管生成、肿瘤发生和发展中发挥作用[8]。MENK可直接参与肿瘤细胞生长过程并进行调控从而发挥抗肿瘤作用,如胃癌、黑色素瘤、卵巢癌、非小细胞肺癌等[9-10];此外,NK细胞、T细胞、树突细胞、巨噬细胞等多种免疫细胞广泛存在阿片受体的结合位点,MENK可与之结合产生免疫调节,从而间接发挥抗肿瘤作用[7];还有研究发现,MENK可通过抑制炎症和重组糖脂代谢相关的肝脏功能在结直肠癌治疗方面发挥作用[11]。然而肠道菌群是否会对MENK抗肿瘤疗效产生影响,目前尚不清楚。本研究利用小鼠肠道菌群紊乱模型及荷瘤小鼠模型,通过16S rRNA测序、观察模型、流式细胞术等方法探讨肠道菌群紊乱对蛋氨酸脑啡肽治疗肿瘤疗效的影响。
1 材料与方法
1.1 材料
1.1.1 小鼠 SPF级C57BL/6(6~8周龄,雌性,体重18~20 g),购自北京维通利华有限公司,饲养于中国医科大学SPF级动物实验室。
1.1.2 细胞 小鼠肉瘤细胞株Sarcoma180(S180)细胞由实验室传代保存,用含有10%胎牛血清和1%的青霉素、链霉素双抗的RPMI-1640培养基,置于37 ℃、5% CO2孵箱中传代培养。
1.1.3 试剂 蛋氨酸脑啡肽(MENK,纯度>98%)购自杭州中肽生化有限公司;庆大霉素、万古霉素、甲硝唑、新霉素、氨苄西林均购自上海阿拉丁有限公司;E.Z.N.ATM Mag-Bind Soil DNA Kit购自OMEGA公司;流式抗体购自Biolegend公司。
1.1.4 仪器与设备 CO2恒温培养箱(316108-5121,Thermo);台式高速冷冻离心机(H2050R,湘仪离心机有限公司);Illumina MiSeq高通量测序仪(美国Illumina公司);PCR仪(Bio-Rad 580BR10905);流式细胞仪(FACSCelesta,BD)。
1.2 方法
1.2.1 小鼠肠道菌群紊乱模型 荷瘤前10 d,预先使用混合抗生素(Antibiotic Mix,ABX)处理。方式为实验组每只小鼠每天灌胃ABX 0.2 mL(包括1.5 mg/mL庆大霉素、1.5 mg/mL甲硝唑、1.5 mg/mL新霉素、1.5 mg/mL氨苄西林、0.75 mg/mL万古霉素),对照组给予等量生理盐水(Normal saline,NS)。处理10 d后分别取NS对照组和ABX实验组小鼠盲肠观察,并取盲肠内容物,液氮速冻后于-80 ℃保存,进行16S rRNA测序。
1.2.2 小鼠皮下荷瘤模型 将体外培养至对数生长期的S180细胞以2×106个/只接种于小鼠腹腔内,7~8 d产生腹水后无菌抽取小鼠腹腔积液,用无血清RPMI-1640离心洗涤并配制瘤细胞悬液,每只小鼠腋窝皮下注入2×106个瘤细胞。
1.2.3 实验小鼠分组及处理 将小鼠随机分为4组(n=6),分别为C组(对照组)、M组(MENK治疗组)、AN组(菌群紊乱对照组)、AM组(菌群紊乱MENK治疗组)。第1天起, AN组与AM组灌胃ABX,剂量见1.2.1,C组与M组给予等量NS,直至实验结束。第10天,所有小鼠进行皮下荷瘤,方法见1.2.2。荷瘤后24 h,M组与AM组每天腹腔注射20 mg/kg MENK 0.1 mL,C组与AN组给予等量NS,持续14 d。
1.2.4 小鼠体重及肿瘤体积测量 实验开始后,隔天记录小鼠体重,绘制体重变化曲线,直至实验结束。待肿瘤体积可测量后,隔天用游标卡尺测量肿瘤长径a、短径b,并根据公式(肿瘤体积=1/2×a×b2)计算肿瘤体积,绘制肿瘤生长曲线。实验结束后对小鼠实施安乐死,取实体瘤称重、留取肿瘤组织做后续实验。
1.2.5 16S rRNA鉴定粪便菌群 参照E.Z.N.ATM Mag-Bind Soil DNA Kit试剂盒使用说明书提取粪便中的DNA,使用V3~V4通用引物进行PCR扩增,扩增产物经纯化回收后等量混样上机测序。Illumina MiseqTM得到的原始图像经预处理得到有效数据,根据样本序列之间的相似性将其分成不同的操作分类单元 (Operational Taxonomic Units,OTU),在97%的OTU相似水平下进行生物信息统计分析。根据不同样本中OTU的丰度分布,对每个样本的多样性进行评估。
1.2.6 肿瘤单细胞悬液制备 将皮下瘤组织切割为<2 mm的碎块,加入1.6 mg/mL Ⅳ型胶原酶(RIPA-1640培养基配制),37 ℃恒温水浴震荡1 h,加入EDTA使其工作浓度为10 mmol/L,4 ℃孵育10 min,使用70 μm尼龙网过滤获得单细胞悬液。磷酸盐缓冲液(PBS)洗涤,加入红细胞裂解液4 ℃孵育5 min,PBS洗涤后重悬细胞待用。
1.2.7 流式细胞术检测肿瘤浸润 CD4+T细胞、CD8+T细胞、Treg细胞 获得肿瘤单细胞悬液后,每个流式管取细胞数量为1×106个。设置对照管,相应的同型对照管和单标管,同型对照管加等量相对应同型对照抗体,单标管加单一的荧光抗体。为检测CD4+T细胞、CD8+T细胞分别加入抗体(APC anti-mouse CD3、FITC anti-mouse CD4、Percp-cy5.5 anti-mouse CD8)进行细胞表面染色,4 ℃避光孵育30 min,洗涤后用缓冲液重悬待上机检测。为检测Treg细胞,分别加入抗体(Percp-cy5.5 anti-mouse CD4、PE anti-mouse CD25)进行细胞表面染色,4 ℃避光孵育30 min;洗涤后加入Foxp3透膜固定剂,4 ℃避光孵育40 min;透膜洗液洗涤后加入抗体APC anti-mouse Foxp3进行核内染色,4 ℃避光孵育40 min;洗涤后用缓冲液重悬待上机检测。流式细胞仪(FACSCelesta,BD)检测CD4+T细胞、CD8+T细胞、Treg细胞百分比,用FlowJo10软件进行分析。
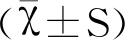
2 结果与分析
2.1 肠道菌群紊乱小鼠模型的建立
为验证肠道菌群紊乱小鼠模型是否建立成功,按1.2.3方法处理10 d后,分别取NS组和ABX组小鼠盲肠,如图1A所示,可肉眼观察到ABX组小鼠盲肠相比NS组肿大,存留更多的粪便;16S rRNA测序分析结果如图1B和图1C所示,ABX组小鼠肠道菌群Chao指数以及Shannon指数明显下降(***P<0.001,****P<0.000 1),表明ABX组小鼠肠道菌群物种总数以及物种多样性相比NS组显著下降,证实模型建立成功。
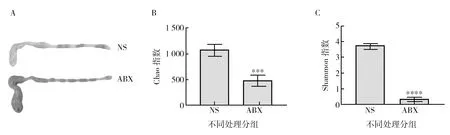
图1 ABX处理后小鼠盲肠外观及肠道菌群物种总数和多样性的比较Fig.1 Comparison of cecal appearance,total number and diversity of intestinal flora in mice treated with ABXA:NS组与ABX组小鼠盲肠外观;B:NS组与ABX组小鼠肠道菌群Chao指数图;C:NS组与ABX组小鼠肠道菌群Shannon指数图;ABX组与NS组相比,*** P<0.001,**** P<0.000 1 A:Appearance of cecum of mice in NS group and ABX group;B:Chao index graph of intestinal flora of NS group and ABX group;C:Shannon index graph of intestinal flora in NS group and ABX group;The ABX group was compared to the NS group,*** Significant difference(P<0.001),**** Significant difference(P<0.000 1)
2.2 小鼠体重及肿瘤生长曲线
对荷瘤小鼠皮下瘤进行测量并计算体积,绘制出肿瘤生长曲线。如图2A所示,M组荷瘤小鼠经MENK治疗皮下瘤生长缓慢,治疗期间瘤体积明显小于C组(***P<0.001);单纯ABX处理对于肿瘤生长并没有产生太大影响,其肿瘤体积与C组相比没有显著性差异;AM组皮下瘤生长较M组快,且瘤体积明显大于M组(###P<0.001)。另外,可监测到各组小鼠体重平稳上升,如图2B所示,AN组与AM组小鼠体重始终略低于C组与M组,但无显著差异,表明实验的处理对小鼠的精神及身体方面没有产生影响。剖出小鼠皮下瘤进行称重拍照,如图2C所示,可肉眼清楚看出M组小鼠皮下瘤明显减小,而AM组瘤体积无显著改变;如图2D所示,经统计学分析,M组小鼠瘤重明显小于C组(****P<0.000 1),AN组与C组相比无统计学差异,AM组瘤重显著大于M组(####P<0.000 1),该结果与肿瘤生长曲线检测一致,提示肠道菌群紊乱可能会使MENK治疗肿瘤效果下降。
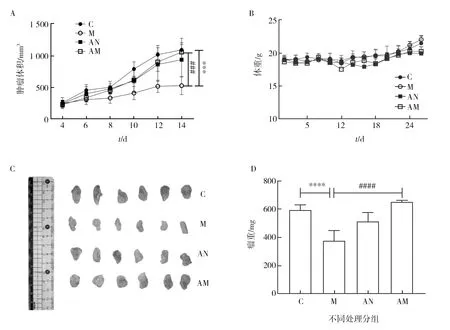
图2 C组、M组、AN组、AM组小鼠体重及肿瘤生长情况Fig.2 Body weight and tumor growth of mice in group C, M,AN and AMA:小鼠肿瘤生长曲线;B:小鼠体重比较;C:小鼠肿瘤标本;D:小鼠瘤重比较;M组与C组相比, *** P<0.001,**** P<0.000 1;AM组与M组相比,###P<0.001,####P<0.000 1A:Tumor growth curve of mice;B:Weight comparison of mice;C:Mouse tumor specimen;D:Comparison of tumor weight in mice;When group M is compared to group C,*** Significant difference(P<0.001),**** Significant difference(P<0.000 1);When group AM is compared to group M, ### Significant difference(P<0.001),#### Significant difference(P<0.000 1)
2.3 流式细胞术检测小鼠肿瘤浸润CD4+T细胞、CD8+T细胞、Treg细胞百分比
取出的皮下瘤经处理获得单细胞悬液,细胞表面及核内染色后,通过流式细胞术检测肿瘤浸润CD4+T细胞、CD8+T细胞、Treg细胞百分比,分析结果如图3所示,M组小鼠经MENK治疗后。肿瘤浸润CD4+T细胞、CD8+T细胞百分比较对照组显著增加(**P<0.01,**P<0.01),而Treg细胞百分比明显减少(****P<0.000 1);单纯ABX处理组肿瘤浸润淋巴细胞百分比与C组相比无显著差异;AM组与M组相比,肿瘤浸润CD4+T细胞及CD8+T细胞百分比显著下降(####P<0.000 1,###P<0.001),而Treg细胞百分比上升(###P<0.001),提示肠道菌群紊乱使得MENK治疗导致的CD4+T细胞及CD8+T细胞浸润显著减少,Treg细胞浸润增多,表明菌群紊乱可能会减弱MENK治疗肿瘤的效果。
3 讨 论
ABX可在短期内清除小鼠肠道中的大部分菌群且不会被肠道吸收,所以研究肠道菌群在肿瘤发生发展以及治疗中的作用时常被用来建立小鼠肠道菌群紊乱模型[12]。本研究16S rRNA测序结果显示ABX处理小鼠肠道菌群总数及多样性均下降,表明已成功建立了小鼠肠道菌群紊乱模型。有研究表明,ABX处理可显著抑制多种荷瘤模型小鼠肿瘤生长[13];而Routy等[14]报道ABX处理对不同荷瘤模型小鼠肿瘤生长有一定的影响,但均无显著差异。由此可知,肠道菌群紊乱对不同荷瘤模型小鼠的影响也不同。本研究发现,ABX导致的菌群紊乱使S180荷瘤小鼠肿瘤体积略有减小但无显著影响。
MENK作为内源性阿片肽能够有效沟通神经内分泌与免疫系统,表现出对多种免疫细胞的调节作用[15]。本课题组前期研究证明,MENK可作用于人外周血淋巴细胞,在刺激CD4+T细胞、CD8+T细胞增殖方面比IL-2或IFN-γ更有活性[16];MENK在体内或体外均可上调CD8+T细胞百分比,显著提高荷瘤小鼠的存活率[17];MENK可以通过下调荷瘤小鼠Treg细胞体内比例延缓肿瘤的发展[18]。本研究通过流式细胞术证明MENK治疗可以提高肿瘤浸润CD4+T细胞、CD8+T细胞百分比,降低Treg细胞百分比,表明MENK治疗后,肿瘤组织内局部的免疫微环境得到了显著改善。
肠道菌群可以通过参与肿瘤的发生,调节抗肿瘤治疗的活性、疗效和毒性[19],也可以通过调节化疗药物的代谢影响肿瘤对化疗的反应[20]。有研究表明,对ABX处理的荷瘤小鼠使用5-氟尿嘧啶[5]、顺铂[21]或PD-1[14]等治疗,其抗肿瘤疗效均有所降低。本研究发现,MENK治疗的肠道菌群紊乱荷瘤小鼠与肠道菌群正常荷瘤小鼠相比,前者肿瘤更大,肿瘤浸润CD4+T细胞、CD8+T细胞百分比下降,Treg细胞百分比上升,表明MENK抑制肿瘤生长的作用减弱。与Dong等[22]结果不同之处在于,其使用的抗肿瘤药物对肠道菌群有调节作用,使得ABX处理对其药物抑瘤疗效损害较小。肠道菌群紊乱严重减弱MENK抗肿瘤疗效的机制还有待进一步研究。
越来越多的研究结果证明,某些肠道细菌的定殖可增强宿主的抗肿瘤免疫反应,从而在远离肠道部位的抗肿瘤治疗中也可以发挥积极作用[23]。 Sivan等[24]给无菌荷瘤小鼠灌胃双歧杆菌,可有效抑制黑色素瘤的生长,与PD-1抑制剂联合治疗几乎完全抑制了肿瘤的生长;Tanoue等[25]从健康的人类供体粪便中分离出11个细菌菌株,在将其移植到无菌荷瘤小鼠后,可以抑制肿瘤生长,联合免疫抑制剂效果更佳。益生菌或粪菌移植是否会增强MENK对肿瘤的治疗效果还需要进一步深入的研究。
综上所述,肠道菌群紊乱可以减弱蛋氨酸脑啡肽对于小鼠肿瘤的治疗效果,这是首次从肠道微生态角度研究肠道菌群紊乱对蛋氨酸脑啡肽抗肿瘤免疫疗效的影响,以上结果可以为蛋氨酸脑啡肽抗肿瘤治疗的进一步研究提供参考。