大豆转录因子GmVOZ1的生物信息学及干旱胁迫表达分析
李铭杨,何佳琦,邱爽,于海伟,邬长乐,张军,翟莹
大豆转录因子的生物信息学及干旱胁迫表达分析
李铭杨1,何佳琦1,邱爽1,于海伟1,邬长乐1,张军2,翟莹1
(1.齐齐哈尔大学 生命科学与农林学院,黑龙江 齐齐哈尔 161006;2.黑龙江省农业科学院畜牧兽医分院,黑龙江 齐齐哈尔 161005)
利用生物信息学的方法对大豆转录因子进行了分析,同时利用实时荧光定量PCR对在干旱胁迫下的表达量进行检测。位于大豆基因组7号染色体上,mRNA编码序列全长1434bp,编码含有477个氨基酸的蛋白质,分子量53.12kDa,等电点5.87,其蛋白序列中含有一个VOZ-domain。预测结果显示,GmVOZ1蛋白是亲水性蛋白,无信号肽,定位在细胞核内。蛋白系统发育分析结果显示,GmVOZ1与苜蓿MtVOZ和拟南芥AtVOZ1亲缘关系较近。启动子序列中含有多个光响应元件、激素响应相关元件和逆境响应相关元件。干旱胁迫处理后,的表达量升高,最高值约为对照组的15倍。上述结果为在大豆抗旱领域的研究提供理论依据。
大豆;转录因子;VOZ;干旱胁迫;表达分析
转录因子又名反式作用因子,存在于所有真核生物中。作为一种DNA结合蛋白,转录因子能够与增强子、启动子等顺式作用元件相互作用,实现激活和抑制目标基因转录的功能[1]。调控转录因子的表达是提高农作物抗性的一种有效方式。维管植物锌指蛋白(Vascular plant one-zinc finger protein, VOZ)是NAC家族中NAM亚族成员。VOZ转录因子家族为高等植物特有,最早被克隆的是拟南芥中的两个成员和。在韧皮部特异性表达,在根部的表达相对较强,它们都与花粉发育相关[2]。后续研究表明,VOZ转录因子在调控植物生物及非生胁迫应答过程中发挥作用。的过量表达提高了拟南芥植株对真菌胁迫的抗性,但降低了拟南芥植株对冰冻和干旱胁迫的抗性[3]。而拟南芥双突变体的抗寒性则得到增强[4]。菠萝VOZ转录因子家族同样以负调控的方式参与菠萝对高盐、干旱和低温胁迫的应答[5]。
大豆是全世界广泛种植的高蛋白作物之一,中国目前正处于大豆供求失衡的困境之中[6]。干旱作为影响大豆产量的主要非生物胁迫因素之一,不仅限制了大豆的种植范围,更严重地影响到了大豆的产量和品质。目前已有大量转录因子作为抗旱候选基因的报道。但大豆VOZ转录因子家族基因在干旱胁迫方面的研究尚未见报道。本研究通过生物信息学的方法对大豆进行预测和分析,同时利用实时荧光定量PCR对其在干旱胁迫下的表达量进行检测,为今后在大豆抗旱领域的研究奠定基础。
1 实验部分
1.1 材料
大豆“北豆9号”种子来源于齐齐哈尔大学植物分子育种研究室。
1.2 生物信息学分析
登陆PlantTFDB(http://planttfdb.gao-lab.org/index.php)植物转录因子数据库,在数据库中搜索并下载大豆转录因子的基因序列和蛋白序列。在线网站ExPASy(https://web.expasy.org/compute_pi/)预测GmVOZ1蛋白的相对分子量和等电点;在线网站ExPASy(https://web.expasy.org/cgi-bin/protscale/)分析GmVOZ1蛋白的疏水性;在线网站SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/)预测GmVOZ1蛋白是否存在信号肽;在线网站WoLF PSORT(https://wolfpsort.hgc.jp/)预测GmVOZ1蛋白的亚细胞定位;在线网站NCBI(https://www.ncbi.nlm.nih.gov/)中搜索并下载植物VOZ蛋白序列;MEGA5软件构建系统进化树;在线网站PlantGDB(http://www.plantgdb.org/GmGDB/)中搜索并下载启动子序列;在线网站PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测启动子中顺式作用元件。
1.3 大豆幼苗干旱胁迫处理
选择饱满的大豆种子种植在草炭土∶沙土=1∶1的混合物中,待种子萌发后用Hoagland营养液进行水培。至幼苗的第一片三出复叶叶片全部展开,将其换至含有20% PEG8000的营养液中进行干旱处理。在处理的第0, 1, 2, 5, 10, 24h各取0.1g上述植株的第一片三出复叶,迅速置于呈有液氮的容器内并转移至-80℃超低温冰箱中储存备用。
1.4 RNA的提取及反转录
使用RNAiso Plus(Takara公司)提取样本总RNA,总RNA经cDNA反转录试剂盒(Novoprotein公司)合成第一链cDNA。
1.5 实时荧光定量PCR
用Primer 5软件进行实时荧光定量PCR的引物设计,其中,上游引物5′-TGTGCCTTGTACCGATTGGAACTG-3′,下游引物5′-GTGGAAACTCAGCAGAGAGCCTTC-3′。内参选择大豆的基因(GenBank登录号:GMU12286),上游引物5′-GGAAGGCT TTCTTGCATTGGTA-3′;下游引物5′-AGTGGCATCCTGGTACTGC-3′。使用SYBR qPCR SuperMix Plus试剂盒(近岸蛋白质科技公司)进行实时荧光定量PCR,参数设置和体系参照张军等[7]。
1.6 数据处理
数据的差异显著性分析采用Student's检验。
2 结果与讨论
2.1 GmVOZ1基因及蛋白序列分析
基因(GenBank登录号:XM003529308)位于大豆基因组7号染色体上,含有3个内含子。序列分析显示如图1所示,mRNA编码序列全长1434 bp,编码含有477个氨基酸的蛋白质,预测分子量为53.12 kDa,预测等电点为5.87。GmVOZ1蛋白序列中含有一个VOZ-domain(201-417),此结构域既是VOZ转录因子的DNA结合结构域,同时也具有蛋白二聚化体的功能,由此证明基因为VOZ家族成员[2]。对GmVOZ1蛋白进行亲/疏水性分析,结果如图2所示,在该蛋白中,亲水性氨基酸所占比例为64.3%,疏水性氨基酸所占比例为35.7%,故该蛋白属于亲水性蛋白。信号肽预测结果显示,GmVOZ1蛋白不含有信号肽。亚细胞定位预测结果显示,GmVOZ1蛋白定位在细胞核内的概率为70.6%,与转录因子在细胞核内发挥转录调控功能相符[8]。研究发现拟南芥AtVOZ2是受到光的调控由细胞质转移到细胞核中从而发挥调控基因表达的功能[9-10]。

图1 GmVOZ1的核苷酸及氨基酸序列阴影部分代表VOZ-domain;*代表终止密码子
2.2 VOZ蛋白系统发育分析
将GmVOZ1蛋白与11个植物VOZ蛋白构建系统进化树,进行系统发育分析。结果如图3所示,大豆GmVOZ1与苜蓿MtVOZ和拟南芥AtVOZ1的亲缘关系最近,与油菜BnVOZ、萝卜RsVOZ和拟南芥AtVOZ2亲缘关系较远。由此推测大豆可能与苜蓿和拟南芥的功能存在相似性,而之前的研究已表明与拟南芥的非生物胁迫抗性相关[4]。
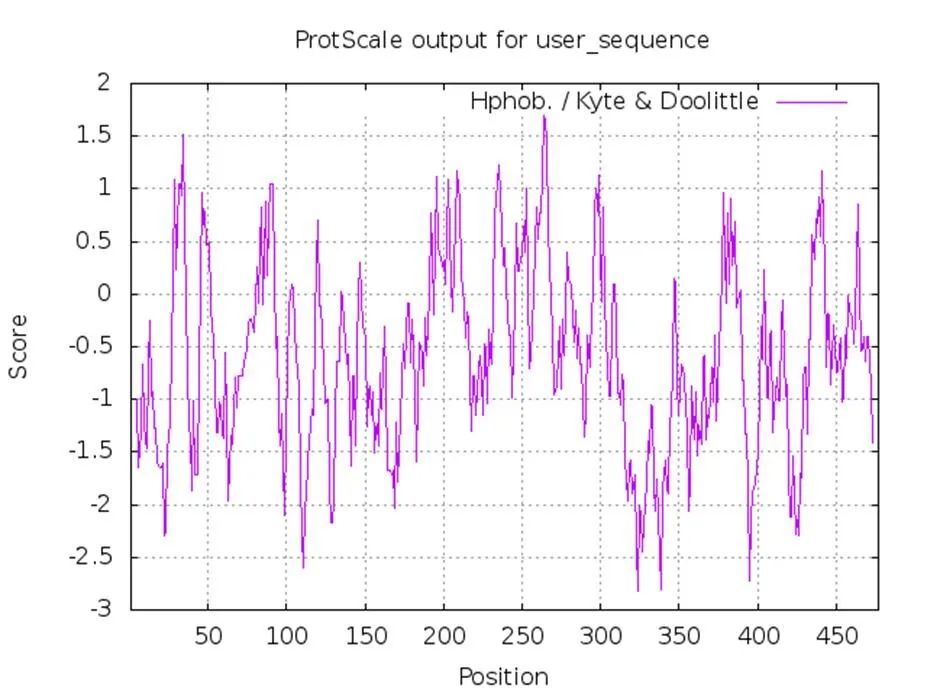
图2 GmVOZ1蛋白亲/疏水性分析
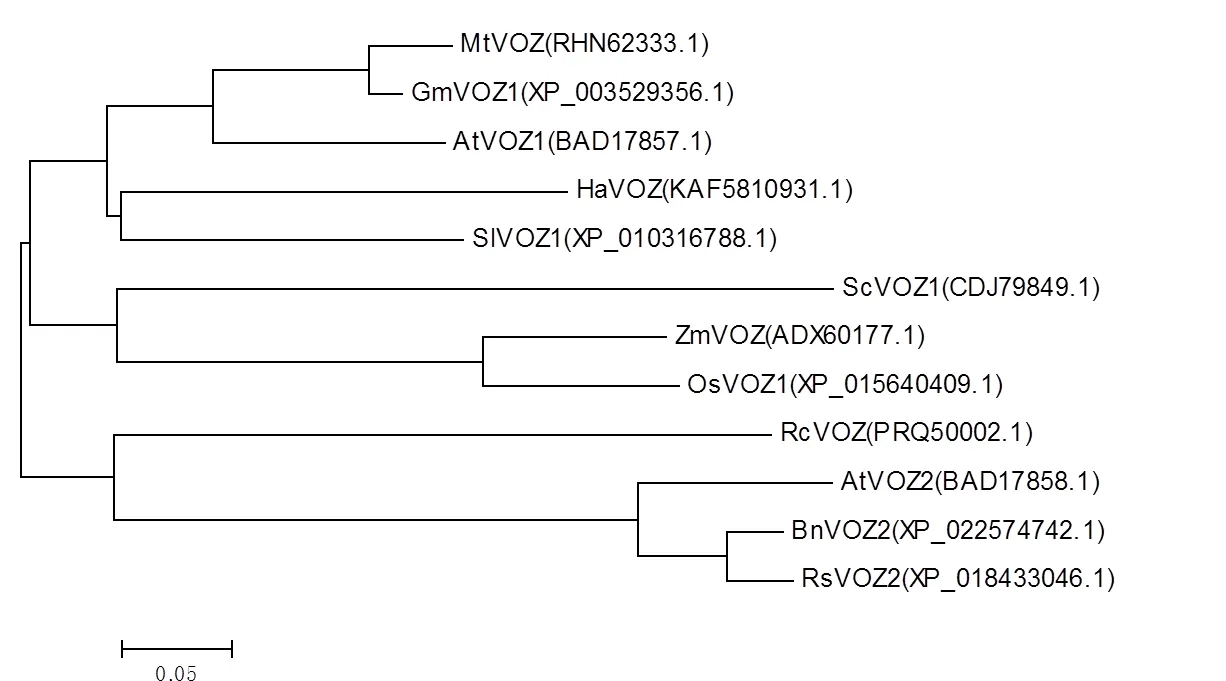
图3 VOZ蛋白系统进化树
2.3 GmVOZ1启动子序列分析
对基因启动子区域的顺式作用元件进行预测分析,分析结果见表1。启动子序列中存在3种光响应元件(Box 4、G-Box和GT1-motif)、6种激素响应相关元件(ABRE、CGTCA-motif、P-Box、TATC-box、TGACG-motif和TCA-element)和2种逆境响应相关元件(ARE和LTR)。激素响应相关元件和逆境响应相关元件的存在意味着可能作为转录因子在大豆逆境应答中发挥转录调控作用。此外,通过启动子中光响应元件的存在推测在大豆光调控应答过程中也可能发挥作用。

表1 GmVOZ1启动子序列顺式作用元件预测
2.4 GmVOZ1在干旱胁迫下的表达
以PEG模拟干旱处理0h的大豆幼苗作为对照,利用实时荧光定量PCR对基因干旱胁迫下的表达动态进行检测。结果如图4所示,干旱胁迫处理后,基因的表达量与对照组(0h)相比显著升高。在处理2h时的表达量达到最高值,约为对照组的15倍。之后表达量呈现出下降、升高再下降的趋势,且表达量均高于对照组。此结果与经干旱处理的水稻叶片中基因的表达模式相近[11],但与菠萝和在干旱胁迫下表达量下降的结果不同[5],表明不同的VOZ基因应对干旱胁迫的机制存在不同。

图4 GmVOZ1在干旱胁迫下的表达
**代表差异达到极显著水平(p小于0.01)
3 结论
基因编码含有477个氨基酸的蛋白质,预测分子量53.12kDa,等电点5.87。GmVOZ1蛋白属于亲水性蛋白,不含信号肽,定位于细胞核内。GmVOZ1与苜蓿MtVOZ蛋白和拟南芥AtVOZ1亲缘关系较近。启动子中含有多个光响应元件、激素响应相关元件和逆境响应相关元件。干旱胁迫处理后,的表达量升高,能够响应干旱胁迫。
[1]张计育,渠慎春,郭忠仁,等. 植物bZIP转录因子的生物学功能[J]. 西北植物学报,2011, 31(5): 1066-1075.
[2]Mitsuda N, Hisabori T, Takeyasu K, et al. VOZ; isolation and characterization of novel vascular plant transcription factors with a one-zinc finger from[J]. Plant and cell Physiology, 2004, 45(7): 845-854.
[3]Nakai Y, Fujiwara S, Kubo Y, et al. Overexpression ofconfers biotic stress tolerance but decreases abiotic stress resistance in[J]. Plant Signaling & Behavior, 2013, 8(3): e23358.
[4]Nakai Y, Nakahira Y, Sumida H, et al. Vascular plant one-zinc-finger protein 1/2 transcription factors regulate abiotic and biotic stress responses in[J]. The Plant Journal, 2013, 73(5): 761-775.
[5]夏杨,苏初连,晁骏,等. 菠萝VOZ转录因子序列特征及其对非生物胁迫的响应[J]. 西北植物学报,2018, 38(7): 1228-1234.
[6]杨文钰,雍太文,任万军,等. 发展套作大豆,振兴大豆产业[J]. 大豆科学,2008, 27(1): 1-7.
[7]张军,邱爽,何佳琦,等. 大豆基因植物表达载体构建及烟草遗传转化[J]. 齐齐哈尔大学学报:自然科学版,2020, 36(6): 22-25.
[8]高贝,李小双,张道远. 基于HMM的齿肋赤藓VOZ转录因子的预测与分析[J]. 生物信息学,2014, 12(2): 77-83.
[9]Yasui Y, Mukougawa K, Uemoto M, et al. The phytochrome-interacting vascular plant one-zinc finger1 and VOZ2 redundantly regulate flowering in[J]. Plant Cell, 2012, 24(8): 3248-3263.
[10]Celesnik H, Ali G S, Robison F M, et al.VOZ (Vascular plant One-Zinc finger) transcription factors are required for proper regulation of flowering time[J]. Biology Open, 2013, 2(4): 424-432.
[11]谈存梅. 水稻基因的克隆与功能分析[D]. 成都:四川农业大学,2014.
Bioinformatics and drought stress expression analysis of the soybean transcription factor
LI Ming-yang1,HE Jia-qi1,QIU Shuang1,YU Hai-wei1,WU Chang-le1,ZHANG Jun2,ZHAI Ying1
(1.College of Life Science and Agroforestry, Qiqihar University, Heilongjiang Qiqihar 161006, China; 2.Branch of Animal Husbandry and Veterinary of Heilongjiang Academy of Agricultural Sciences, Heilongjiang Qiqihar 161005, China)
In this study, the soybean transcription factorwas analyzed by bioinformatics, and the expression under drought stress was detected by real-time fluorescence quantitative PCR.was located on chromosome 7 of soybean genome. The length of mRNA encoding sequence was 1434bp, encoding a protein containing 477 amino acids, with molecular weight of 53.12kDa and isoelectric point of 5.87. The GmVOZ1 protein sequence contained a VOZ-domain. The results of prediction showed that GmVOZ1 was a hydrophilic protein with no signal peptide and localized in the nucleus. Protein phylogenetic analysis showed that GmVOZ1 was closely related to MtVOZ and AtVOZ1. The promoter sequence ofcontained several light-responsive elements, hormone-responsive elements and stress-responsive elements. The expression ofincreased under drought stress, and the highest value was about 15 times that of the control. These results provided a theoretical basis for the study ofin the field of soybean drought resistance.
soybean;transcription factor;VOZ;drought stress;expression analysis
2021-03-25
黑龙江省省属高等学校基本科研业务费科研项目“植物性食品加工技术特色学科专项”(YSTSXK201878);齐齐哈尔大学研究生创新科研项目(YJSCX2020041);齐齐哈尔市科技计划创新激励项目(CNYGG-2020009)
李铭杨(1998-),女,黑龙江绥化人,本科,主要从事植物分子遗传育种研究,879463529@qq.com。
翟莹(1982-),女,吉林吉林人,教授,博士,主要从事植物分子遗传育种研究,fairy39809079@126.com。
S565.1
A
1007-984X(2021)05-0072-05

