组蛋白去乙酰化酶抑制剂联合溴结构域蛋白4抑制剂治疗脑胶质瘤的疗效研究
万家颖,王银
脑胶质瘤是中枢神经系统恶性肿瘤,目前临床主要以手术治疗为主,但预后差,5年生存率不足5%[1,2]。胶质瘤多呈浸润性生长,单靠手术难以根治,联合放、化疗治疗效果也不佳[3]。探索新的治疗策略是脑胶质瘤研究的重、难点。
组蛋白去乙酰化酶(histone deacetylase,HDAC)在脑胶质瘤的发生、发展中有重要作用[4],HDAC抑制剂能显著抑制脑胶质瘤细胞增殖,并诱导其凋亡[5]。HDAC被认为是治疗脑胶质瘤的有效靶点之一。但单一药物治疗胶质瘤的效果并不理想[6],联合用药更具有优势。比如,研究报道白藜芦醇与替莫唑胺联用比单一用药对脑胶质瘤的疗效更好[7]。溴结构域是一种保守的蛋白结构域,能与组蛋白中的乙酰化赖氨酸相结合。溴结构域蛋白4(BRD4)有致癌功能,其小分子抑制剂JQ1则对脑胶质瘤有良好治疗效果[8]。研究拟通过动物模型研究,观察HDAC抑制剂伏立诺他(SAHA)和JQ1联合用药对脑胶质瘤的疗效。
1 材料与方法
1.1 主要试剂与材料
1.1.1 实验动物 SPF级BALB/c裸鼠16只,4~5周龄,雌雄各半,体质量16~24 g,平均(21.2±3.8)g;购自成都达硕实验动物有限公司,动物许可证号SCXK(川)2015-030。
1.1.2 主要试剂和仪器 SAHA(纯度>99%,货号:A68075)和JQ1(纯度>98%,货号:BD229144)购于北京伊诺凯科技有限公司;DMEM培养基(货号:PM150210)购自武汉普诺赛生命科技有限公司;胎牛血清(货号:C0232)购自美国Gibco公司。U87和U373MG胶质瘤细胞购自国家生物医学实验室细胞资源库;U251和C6胶质瘤细胞购自中国科学院典型培养物保藏委员会细胞库,由本实验室冻存使用。
1.2 方法
1.2.1 细胞培养 U87、U251、U373MG和C6细胞用含有10%胎牛血清的DMEM培养基进行培养,于37℃,5%CO2培养箱中培养,每2天全量换液1次。
1.2.2 体外抗增殖活性试验 取对数生长期的细胞用胰酶消化后接种到96孔板中,1×104个/孔,于37℃,5%CO2培养箱中孵育12 h;弃去培养基,每孔加入200µL不同浓度(100,50,25,10,5,1,0.5,0.1μmol/L)的SAHA、JQ1及SAHA和JQ1混合物(按1∶1摩尔比混合),空白组加入等体积的培养基,继续孵育3 d;弃去培养液,每孔加入20μL 5 mg/mL的MTT溶液和100μL培养基,继续孵育4 h;弃去培养液,每孔加入150μL的DMSO,在摇床上震荡15 min,使结晶物成分溶解。最后,在波长为490 nm处用酶标仪测定每孔吸光度(OD)值,计算半数抑制浓度(IC50)值。
1.2.3 构建肿瘤模型 根据体外抗增殖活性试验,选取对药物最敏感的胶质瘤细胞进行后续试验。取对数生长期的胶质瘤细胞用胰酶消化后与Matrigel基质胶混匀为5×107个/mL浓度,接种到裸鼠左侧肩部皮下(100µL/只,5×106细胞)。约3周后肿瘤体积长至90 mm3可以开展后续试验。
1.2.4 动物分组及给药方式 采用随机数字表法将荷瘤小鼠分为空白对照组、SAHA组、JQ1组和联合用药组,每组4只。将SAHA、JQ1及SAHA和JQ1混合物溶于聚乙烯蓖麻油∶DMSO∶PBS(1∶1∶8)溶剂。分别给各组小鼠进行灌胃给药18 d,给药剂量均为20 mg/kg/d,空白对照组则给予等体积的溶剂。每隔2天,采用游标卡尺测量肿瘤的长、宽,计算肿瘤体积(mm3):V=a×b2/2(a为肿瘤的最长径,b为肿瘤最短径);采用分析天平称量小鼠的体质量,计算小鼠体质量变化率(%)=M0/Mn×100%(M0为给药治疗前小鼠的体质量,Mn为给药n天后小鼠的体质量)。治疗18 d后,处死小鼠,取下肿瘤称重,计算抑瘤率(%)=(W空白对照组-W实验组)/W空白对照组×100%(W为肿瘤重量)。
1.3 统计学处理
采用SPSS 21.0统计软件进行数据分析,符合正态分布以及方差齐性的计量资料以(±s)表示,多组间比较采用单因素方差分析和重复测量设计的方差分析,组间多重比较行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组用药的抗肿瘤细胞增殖活性比较
通过MTT法筛选SAHA、JQ1及联合用药对U87、U251、U373MG和C6这4种胶质瘤细胞的抗增殖活性,结果显示,3组用药对肿瘤细胞均有显著的抑制活性,其IC50值均<10μmol/L。联合用药组抑制U87、U251、C6更有效,尤其对U87的抑制活性最强,见表1。
2.2 各组用药抑制肿瘤体积的增长比较
根据表1结果,选择U87细胞建模。给药前,4组小鼠肿瘤体积差异无统计学意义(P>0.05);给药后,4组小鼠的肿瘤体积均随着治疗时间的延长而逐渐增加(均P<0.05),但联合用药组肿瘤体积的增长幅度最小;用药6、12和18 d时,联合用药组的肿瘤体积均小于JQ1组(均P<0.05),用药12和18 d时,联合用药组的肿瘤体积均小于SAHA组(均P<0.05),见表2。
表1 各组用药的抗增殖活性(μmol/L,±s)
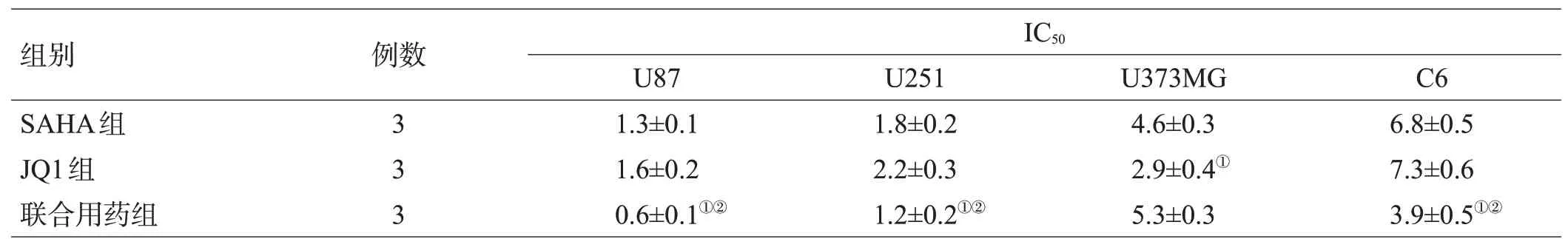
表1 各组用药的抗增殖活性(μmol/L,±s)
注:与SAHA组比较,①P<0.05;与JQ1组比较,②P<0.05
?
表2 各组小鼠的肿瘤体积随时间的变化(mm3,±s)

表2 各组小鼠的肿瘤体积随时间的变化(mm3,±s)
注:与0 d比较,①P<0.05;与6 d比较,②P<0.05,与12 d比较,③P<0.05;与空白对照组比较,④P<0.05;与SAHA组比较,⑤P<0.05;与JQ1组比较,⑥P<0.05
?
2.3 各组用药抑制肿瘤生长的效率比较
治疗18 d后,空白对照组、SAHA组、JQ1组和联合用药组的肿瘤质量分别为(1561.8±78.4)mg、(617.3±37.2)mg、(629.4±45.8)mg和(296.8±20.7)mg,联合用药组显著低于其他3组(均P<0.05);3组的抑瘤率分别为(60.9±4.3)%,(59.5±5.1)%和(80.6±2.8)%,联合用药组的抑瘤率高于其他2组(均P<0.05)。
2.4 各组用药对实验小鼠体质量的影响比较
各组小鼠的体质随着时间延长均出现出增加的趋势,到12 d时空白对照组的体质量变化率开始高于给药0 d时(均P<0.05),而SAHA组和JQ1组在给药18 d时的体质量变化率才开始高于给药0 d时(均P<0.05);3组间小鼠体质量变化率差异均无统计学意义(P>0.05)。联合用药组小鼠所有时间点的体质量变化率与给药0 d时差异均无统计学意义(P>0.05),在给药18 d时联合用药组小鼠体质量变化率低于空白对照组(P<0.05),见表3。
表3 各组小鼠给药前后的体质量变化率比较(%,±s)
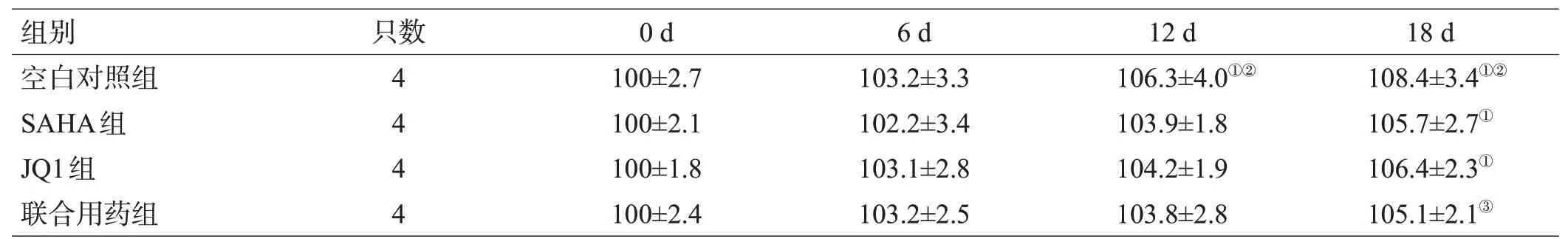
表3 各组小鼠给药前后的体质量变化率比较(%,±s)
注:与0 d比较,①P<0.05;与6 d比较,②P<0.05,与空白对照组比较,③P<0.05
?
3 讨论
HDAC是表观遗传家族中一类重要的蛋白酶家族,其介导核小体结构的改变、调控基因表达、影响蛋白质的稳定和结合作用[9]。参与调控细胞分化、增殖等[10]。研究表明[11,12],HDAC与肿瘤的发生、发展密切相关,多种肿瘤组织中均发现HDAC的过度表达,是肿瘤治疗的有效靶点之一。HDAC抑制剂能通过多条途径(如抑制肿瘤血管形成、诱导肿瘤细胞凋亡、自噬等)有效抑制肿瘤的生长[13]。现已有SAHA、罗米地辛(Romidepsin,FK 228)、贝利司他(Belinostat,PDX-101)、帕比司他(Panobinistat,LBH-589)及西本达胺被美国或中国食品药品监督管理局批准用于治疗各种肿瘤[14]。有报道HDAC抑制剂MS-275可通过阻滞肿瘤细胞周期来抑制胶质瘤干细胞的增殖[15]。因癌症是多基因、多信号通路的疾病,研究人员常将HDAC抑制剂与其他靶向药物联合用药,从多条途径来治疗癌症。2019年Meng等[16]将HDAC抑制剂帕比司他与PI3K/mTOR抑制剂BEZ235联合用药对胶质瘤的治疗效果要强于单独使用帕比司他和BEZ235。
BRD4也是表观遗家族蛋白酶成员中的一员,其通过募集染色质修饰蛋白或者转录调节因子来调控基因表达和转录,具有促进癌基因表达的功能[17]。在组蛋白的乙酰化过程中,首先需要“乙酰化阅读蛋白”识别,然后才能进行后续基因转录、蛋白表达等过程,而BRD4正是介导组蛋白乙酰化过程所需的“乙酰化阅读蛋白”[18],是表观遗传基因读取和调控的关键靶点。HDAC与BRD4对肿瘤的发生、发展也起着协同作用。将HDAC抑制剂与BRD4抑制剂联用能够发挥协同抗癌作用,其抗癌效果也要强于单一HDAC抑制剂或BRD4抑制剂[19,20]。
本研究将这HDAC抑制剂与BRD4抑制剂联合用药,观察其对胶质瘤靶向治疗的效果。结果显示,HDAC抑制剂SAHA与BRD4抑制剂JQ1联合用药对U87、U251、U373MG和C6均有较强的抑制活性,尤其对U87展现出了最强的抑制活性;体内抗肿瘤研究表明,SAHA与JQ1联合用药能够显著地抑制U87肿瘤体积及重量的增长,强于单一使用SAHA和JQ1药物。其中联合用药组的抑制肿瘤的效率显著高于单用SAHA和JQ1。
综上所述,SAHA与JQ1联合用药是一种胶质瘤治疗的有效方法,其效果优于单独使用其中一种。后续本课题组将对其机制进行深入探索。
