体外膈肌起搏器治疗结合吞咽功能训练对原发性帕金森病吞咽功能的疗效
甘莉,王磊,龚玉来,魏鹏绪,王红艳,胥国文
帕金森病(Parkinson's disease,PD)是常见的神经系统退行性病变[1]。药物治疗可在一定程度上延缓控制病情,但对其进行性加重的吞咽问题及呼吸障碍的疗效并不明显[2]。吞咽障碍在PD患者中的发病率高达32%~70%[3],由此伴发的误吸性肺炎等并发症是其常见的死亡原因[4]。体外膈肌起搏器(external diaphragm pacemaker,EDP)治疗是通过功能性电刺激膈神经引起被动呼吸肌训练,通过调控呼吸通路,实现增强膈肌功能、改善呼吸-吞咽协调性等[6],常用于改善患者肺通气功能。本研究旨在观察EDP治疗结合吞咽常规训练对PD患者吞咽功能的改善作用,现报道如下。
1 资料与方法
1.1 一般资料
选择2017年5月至2019年10月我院收住的PD患者42例。纳入标准:符合2016年中华医学会神经病学分会帕金森病及运动障碍学组制定的原发性PD诊断标准[2],经CT或MRI排除继发性帕金森综合征;病情稳定,血压平稳;经吞咽造影检查(video fluoroscopic swallowing study,VFSS)确定存在口咽期吞咽障碍[7,8];神志清醒,简易智力状态检查量表(mini-mental state examination,MMSE)评分≥23分。排除标准:严重精神疾患、认知障碍、癫痫病史;严重心、肺、肾器质性病变;体内有金属内固定、支架、心脏起搏器、植入金属电极;头颈部肿瘤放化疗术后;严重的头颈部皮肤破溃等外源性伤口。
采用随机数字表法将患者分为对照组和观察组,各21例。对照组21例,其中男16例,女5例;平均年龄(54.29±2.43)岁,平均病程(6.33±3.55)年。观察组21例,其中男15例,女6例;平均年龄(58.48±2.33)岁,平均病程(6.62±3.97)年。2组的性别、年龄、病程等差异无统计学意义(均P>0.05),具有可比性。
本研究经我院伦理委员会审批通过(审批号:CKLL-2017009),所有患者均签署书面知情同意书。
1.2 方法
1.2.1 治疗方式 2组均接受一般药物治疗、运动治疗和吞咽功能训练[9]。对照组吞咽治疗30 min/次,1次/d,5次/周,连续治疗4周[10]。观察组在此基础上给予EDP配合治疗(EDP-II型,广州雪利昂生物科技有限公司)。刺激脉冲频率为40 Hz,强度以患者可耐受为宜,刺激部位在患者膈神经的体表投射点[5,6](主电极放置在胸锁乳突肌下端外缘1/3处,辅助电极位于锁骨中线第2肋间);20 min/次,2次/d,10次/周,连续治疗4周。
1.2.2 疗效评价 治疗前、治疗4周后,由同一位经过吞咽障碍规范化培训的康复治疗师在不清楚分组情况下对2组患者进行吞咽及呼吸功能方面评定。具体评估方法如下:①洼田饮水试验:先单次喝下2~3茶匙水,若连续2次均出现呛咳,记为V级;若无或仅1次呛咳,再一次性喝下30 mL温开水。分级标准:I级为1次喝完,无呛咳;V级为出现频频呛咳,难以喝完。诊断标准:I级5 s以内喝完为正常,记为1分;V级记为5分。分数越高,呛咳程度越重[1]。②VFSS:在X线透视下,观察记录患者进食浓度为60%w/v硫酸钡调配的稀流质、浓流质、糊状、固体4种不同性状食物时的吞咽全过程[11,12]。③Rosenbek渗透-误吸等级量表(penetration aspiration scale,PAS):通过VFSS下观察患者进食稀流质食物进入喉、气道的不同深度及咳嗽情况后评分。1级表示未进入气道,8级表示食物到达气道并通过声带以下且无力清除[12],提示严重的隐性误吸。④改良钡剂吞咽检查(modified barium swallowing study,MBSS):涵盖了口咽期吞咽中所涉及的各种解剖结构运动及功能,共计55分,其中口腔期18分、咽期37分;本观察组仅选取咽期评分,评分越高表示吞咽障碍程度越严重[12,13]。⑤柠檬酸诱导咳嗽反射测验(cough reflex test,CRT):检测并量化反射性咳嗽的评估方法[14,15]。平静放松卧位,面罩紧贴患者口鼻先吸入生理盐水5 mL,再过渡到吸入0.4 mol/L的柠檬酸15 s,15 s内出现咳嗽2次及以上,为“通过”,反之为“不通过”[14-16]。⑥Borg呼吸困难指数评分:分值反映患者的最大程度呼吸困难。零级为无呼吸困难,10级为极其强烈的劳累[17]。⑦RPE运动自觉用力程度量表:患者根据自身疲劳程度来评估用力等级及相应分值。6分为丝毫不感到疲倦,20分为体会到极度的筋疲力尽[17]。
1.3 统计学处理
采用SPSS 22.0软件处理数据。符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用独立样本均数t检验;计数资料以率表示,组间比较采用χ2检验;P<0.05为差异有统计学意义。
2 结果
治疗前,2组的饮水试验、PAS、MBSS、Borg、RPE评分及CRT通过率差异无统计学意义(P>0.05)。治疗4周后,2组的饮水试验、PAS、MBSS、Borg、RPE评分均较同组治疗前降低(均P<0.05),且观察组低于对照组(均P<0.05);2组的CRT通过率较同组治疗前升高(P<0.05),且观察组高于对照组(P<0.05),见表1,表2。
表1 2组治疗前、后饮水试验、PAS、咽期MBSS评分比较(分,±s)

表1 2组治疗前、后饮水试验、PAS、咽期MBSS评分比较(分,±s)
注:与治疗前比较,①P<0.05;与对照组比较,②P<0.05
?
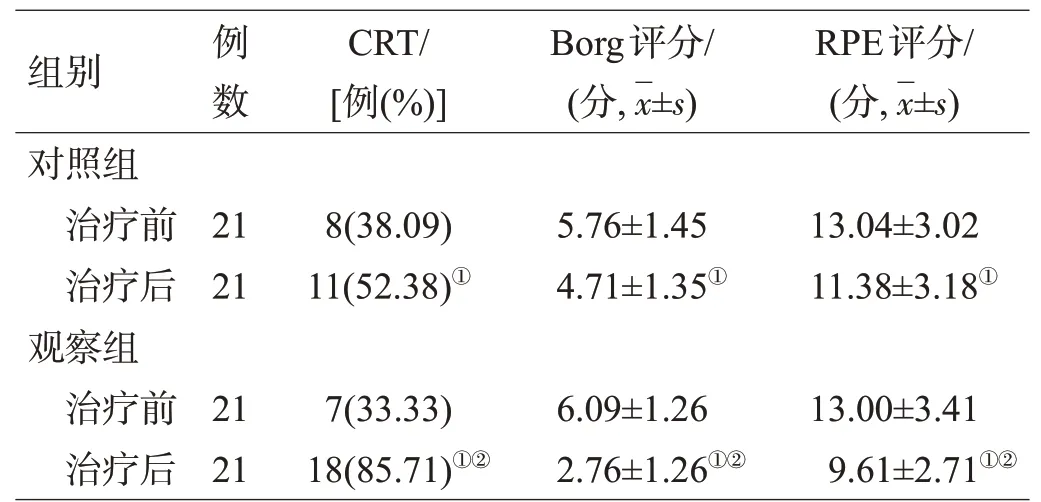
表2 2组治疗前、后CRT通过率、Borg及RPE评分比较
3 讨论
本研究采用EDP结合吞咽常规训练治疗PD后吞咽障碍,疗效优于单一的吞咽常规训练。正常生理过程中,由脑干的行为控制组件保证吞咽、呼吸动作安全协调进行。但PD发生后,由于神经调控通路受损,出现不同程度口咽期吞咽障碍及呼吸功能障碍。现在治疗手段大多从吞咽行为治疗入手,将病理性呼吸-吞咽模式作为治疗设计思路的病例国内并不多见。
PD后呼吸障碍病理机制可能包括以下几点:①由于上气道阻塞,出现间歇性的气流中断;②因呼吸肌震颤(特别是膈肌)问题降低呼吸运动的协调性且呼吸肌易疲劳;③咳嗽反射敏感性下降:正常的咳嗽反射和吞咽运动是有效气道保护的决定性因素[18]。PD患者该反射减退,可造成渗漏误吸,甚至是吸入性肺炎[19-22]。
EDP治疗通过大脑皮质-脑干-膈神经-膈肌的调控通路,联合延髓呼吸中枢的调节,将生理电信号传至为吸气提供了60%~70%[5]动力源的膈肌,膈肌收缩使胸腔负压增大,提高咳嗽反射的敏感性[23-25]。此外,EDP通过募集3种不同成分的膈肌纤维,改善膈肌肌力和肌耐力[26,27]。
本研究综合上述机制,回顾以往试验设计参考指标[5,6,12],将吞咽及呼吸障碍两方面指标均纳入观察、分析[22,28]。结果显示,治疗后2组吞咽功能均有所改善,其中观察组渗漏、误吸指标、呼吸肌疲劳程度、咳嗽反射灵敏性指标均优于对照组,差异具有统计学意义(P<0.05)。推测其是通过改善上述咳嗽反射机制,增强了反射灵敏性;同时,通过对膈肌的有效募集,提高了气体交换,减轻了呼吸肌疲劳程度,增强了吞咽-呼吸的协调性,对吞咽-呼吸模式亦有一定程度地改善作用[27-29]。
本研究也存在一些不足之处:①疗效指标多为主观指标,客观指标仅有MBSS评分和咳嗽反射通过率;②MBSS测评未纳入口腔期数据,可能致结果分析出现一定偏差;③缺乏治疗前后呼吸功能的精准量化指标[30,31]。在下一步的研究中,还应纳入更多样本量,且进一步结合呼吸功能数据,更深入分析探讨治疗机制。
