不同剂量尿激酶对大鼠脑出血后血脑屏障作用的研究
徐林,甄丽晓,齐宏顺,,李培培,吕涌涛,,冯肖亚,葛汝村
脑出血(intracerebral hemorrhage,ICH)是神经系统常见的急危重症,血肿周围脑组织水肿的形成是本病常见的继发性病理改变[1]。水肿可致颅内压进一步升高,造成神经功能障碍。血脑屏障(blood brain barrier,BBB)通透性的增加是形成血肿旁水肿的主要原因之一。研究发现,向大鼠ICH模型血肿腔内注射尿激酶不仅可以促进血肿吸收,还可减轻血肿周围脑组织水肿[2]。临床研究也证实了微创手术联合血肿腔内注射尿激酶治疗方法的有效性[3-5]。但其最佳治疗剂量及发挥作用的具体机制仍是研究的焦点。本实验通过对大鼠ICH后3 h给予不同剂量尿激酶进行干预,观察BBB的完整性,并对BBB紧密连接蛋白1(zonula occludens-1,ZO-1)和基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)的表达进行检测,为临床应用提供理论和实验依据。
1 材料与方法
1.1 主要试剂与材料
1.1.1 实验动物 SPF级雄性Wistar大鼠40只,体质量250~280 g;购于济南市朋悦实验动物繁育有限公司;实验动物生产许可证号:SCXK(鲁)20190003。
1.1.2 主要仪器及试剂 脑立体定位仪购于瑞沃德生命科技有限公司;台式高速离心机Fresco 21购于德国Thermo公司;PS普诺森FluorChem E Alpha化学发光凝胶成像系统购于Protein Simple公司;BX51荧光显微镜购于日本Olympus公司;尿激酶购自广东丽珠药业有限责任公司;ZO-1单克隆抗体、MMP-9单克隆抗体均购于Santa Cruz生物技术有限公司。
1.2 方法
1.2.1 ICH动物模型的建立 大鼠麻醉后固定于脑立体定位仪,取十字缝与人字缝交叉点为0点,向前0.2 mm,向左3 mm作为进针点,深度约6 mm。用微量注射器向颅内注入自体尾动脉血50μL,先注入20μL,停针7 min,再注入30μL,停针10 min,退针2 mm,再停针10 min,再完全退针缝合伤口。待大鼠完全清醒后,参照Longa五级评分法[6],进行神经功能缺损评分,1~3分为造模成功。
1.2.2 实验分组及用药 造模成功后,40只大鼠随机分为ICH组和低(3万U/mL)、中(5万U/mL)、高剂量(10万U/mL)尿激酶组(L、M、H组),每组10只。造模3 h后,将10μL不同浓度的尿激酶注入血肿处,ICH组在血肿处注入等量的生理盐水。
1.2.3 脑组织含水量的测定 造模后第3天,将实验动物麻醉后处死,迅速取脑血肿周围组织(100±10)mg,称取湿重,然后放入电热恒温箱(105℃)内烘烤24 h至恒重,测量干重。脑含水量(%)=(湿重-干重)/湿重×100%。
1.2.4 伊文斯蓝(EB)渗出实验 实验动物在处死前1 h经尾静脉注射2%EB染液(5 mL/kg),可见大鼠唇、眼结膜、四肢等部位变蓝。1 h后用预冷生理盐水灌注心脏,直至流出液颜色清亮,迅速取脑,于4%多聚甲醛溶液固定后,经20%、30%蔗糖溶液脱水,至脑组织沉底后取出,用OCT于-20℃包埋,冰冻切片机切片,厚度约8μm。荧光显微镜下观察并拍照,用Image J软件对图像进行分析,测量血管外EB染料的荧光强度,即EB的渗出情况。
1.2.5 Western Blot检测ZO-1和MMP-9的表达 造模后3 d,处死大鼠后,迅速分离注射点周围2 mm范围脑组织,保存于-80℃环境备用。按说明书将裂解提取蛋白质,BCA蛋白检测试剂盒检测蛋白质浓度。然后进行10%SDS-PAGE凝胶电泳,湿法转膜,加入一抗GAPDH抗体(1∶1 000)、ZO-1抗体(1∶1 000)、MMP-9抗体(1∶1 000)4℃孵育过夜,TBST漂洗3次,加入辣根过氧化物酶标记的二抗工作液(稀释比例l∶5 000),室温摇床2 h。TBST漂洗,用FluorChem E化学发光凝胶成像系统扫描条带,使用Alphaview图像分析系统,GAPDH为内参,目的条带的灰度值/GAPDH条带的灰度值分析蛋白表达情况。
1.3 统计学处理
采用SPSS 22.0统计学软件对实验数据进行统计分析,符合正态分布以及方差齐性的计量资料以(±s)表示,组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;P<0.05为差异有统计学意义。
2 结果
2.1 血肿周围脑组织含水量比较结果
L、M和H组大鼠血肿周围脑组织含水量均少于ICH组,差异有统计学意义(均P<0.05),且脑组织含水量随着尿激酶浓度的增加呈升高趋势,其中L组中脑组织的含水量低于M和H组,差异有统计学意义(均P<0.05),见图1。
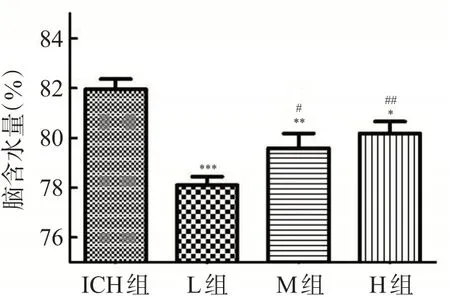
图1 各组大鼠脑组织含水量比较
2.2 EB渗出实验结果
与ICH组比较,L、M和H组大鼠脑组织的EB染料血管外渗出均减少(均P<0.05)。随着尿激酶浓度的增加,EB的渗出量先下降后升高,其中L组EB的渗出量低于其它各组(均P<0.05),见图2。
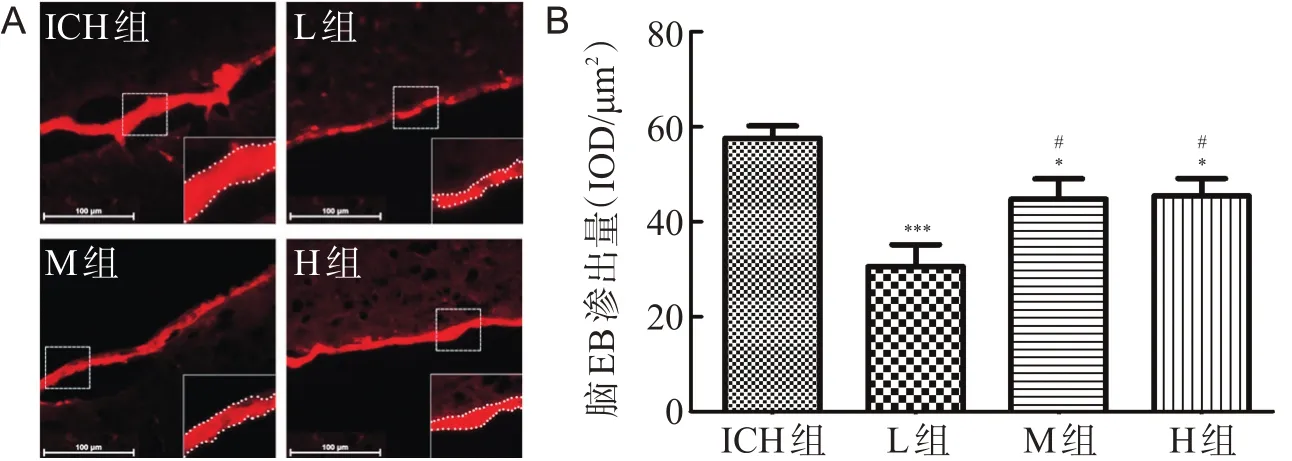
图2 EB渗出实验结果
2.3 脑组织ZO-1、MMP-9蛋白表达比较结果
与ICH组比较,L、M和H组脑组织ZO-1表达均明显升高(均P<0.05),MMP-9的表达明显降低(均P<0.05);其中L组ZO-1的表达最高,MMP-9的表达最低,与其它各组相比,差异均有统计学意义(均P<0.05),见图3。
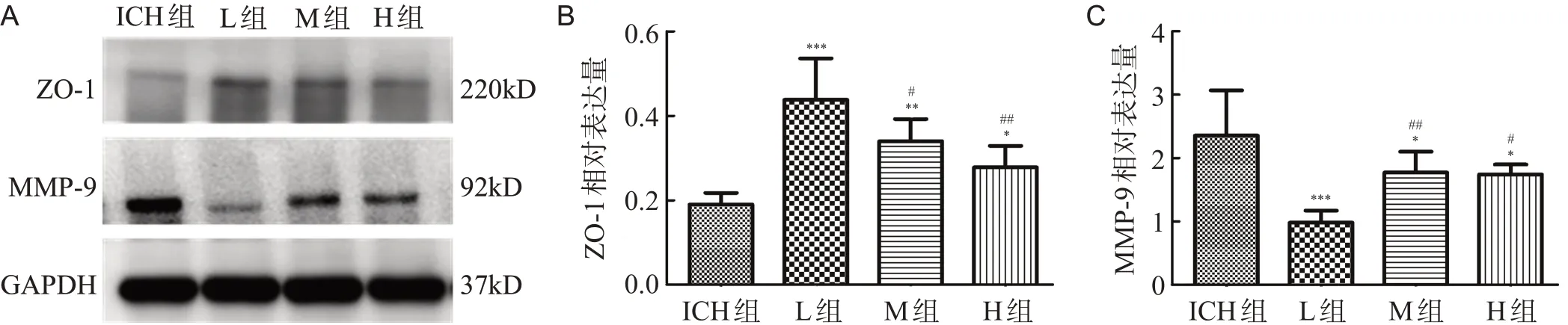
图3 各组大鼠脑组织ZO-1、MMP-9蛋白的表达
3 讨论
ICH占所有急性脑卒中病例的15%,是一种高死亡率、高致残率的严重脑血管疾病[7]。BBB的破坏是ICH诱导的脑损伤的关键机制之一[8,9],与预后不良密切相关。因此,减轻BBB的破坏可能是减少ICH后早期脑损伤的一种有前途的治疗策略。
BBB的功能依赖于相邻内皮细胞之间的紧密连接,它主要由跨膜蛋白、胞质附着蛋白和细胞骨架蛋白组成[10]。紧密连接蛋白ZO-1是一种胞质附着蛋白,其表达与BBB的完整性有关[11],ZO-1表达下调可作为BBB破坏的标志之一[12]。基质金属蛋白酶是钙依赖性锌内肽酶的一个超家族,其作用是对细胞外基质进行重塑和降解,这对BBB的功能至关重要[13],在一定病理条件下可以通过破坏微血管细胞外基质和蛋白成分来破坏BBB的完整性。大鼠ICH模型中,MMP-9表达增加,紧密连接蛋白和基底膜蛋白水平下降,导致BBB的破坏和脑水肿[14]。其他研究表明,MMP-9参与了紧密连接蛋白和微血管基底膜蛋白的降解,导致BBB的破坏和脑水肿[15]。Tan Qiang等[5]发现尿激酶可通过下调MMP-2与MMP-12的表达,减少血管外基质及紧密连接蛋白ZO-1的降解,对BBB起到保护作用;另一方面,又可上调MMP-9的表达,对BBB存在潜在的破坏作用。本研究发现尿激酶可使MMP-9表达降低,紧密连接蛋白ZO-1的表达增加,进一步验证了尿激酶在脑出血后BBB保护中的作用。但研究同时发现随着尿激酶剂量的增加,MMP-9的表达呈上升趋势,ZO-1的表达呈下降趋势,可能与高剂量尿激酶溶解血肿时释放血红蛋白代谢产物增多或激活相关因子进一步损伤BBB有关,也可能与尿激酶本身的作用有关[16],其具体机制有待进一步研究。
综上所述,尿激酶在保护ICH后BBB的完整性和减轻脑水肿方面确切有效。本研究结果显示,300 U的尿激酶注入50μL左右的脑内血肿中,可以较好的减轻BBB的通透性和脑水肿,而更大剂量的尿激酶可能会增加MMP-9的表达并减少ZO-1的表达。因此,对尿激酶的安全剂量仍需更多的动物实验及临床实验的研究,从而探讨临床上治疗脑出血的最佳剂量。
