塞来昔布对幽门螺杆菌感染的胃癌细胞凋亡及炎症反应的影响
王 竞,段志英,杨明月,朱秀芳,霍晓辉,范红云
河北医科大学第一医院消化内科,河北 石家庄 050081
胃癌是常见的恶性肿瘤之一,其形成是一个多基因、多因素和多步骤共同作用的结果[1]。幽门螺杆菌(Helicobacter pylori,H.pylori)是一种微需氧菌,其感染与胃癌、慢性胃炎、消化性溃疡等疾病发生发展密切相关,WHO已将H.pylori列为Ⅰ类致病因子[2],目前H.pylori感染引起胃癌发生发展的机制尚不明确。环氧合酶(COX)是前列腺素合成的关键酶,在多种肿瘤细胞中COX-2呈高表达,其表达可促进肿瘤进展[3-4]。有研究发现,选择性COX-2抑制剂塞来昔布对包括胃癌在内的多种肿瘤生长有抑制作用[5]。也有研究发现,塞来昔布对H.pylori感染的胃上皮细胞(GES-1)有抑制增殖和促凋亡作用[6],但机制尚不明确。微小RNA(miRNA)是一类非编码RNA,在细胞增殖、凋亡、分化等过程中发挥重要作用,其异常表达与肿瘤发生发展密切相关[7]。有研究显示,胃癌组织及细胞中miR-145低表达,其表达与胃癌进展有关[8]。塞来昔布可通过miR-145/TGFBR2/Smad3分子轴抑制膀胱癌上皮-间质转化(EMT)[9]。塞来昔布是否可调节miR-145影响H.pylori感染的胃癌细胞生长尚不明确。有研究显示,H.pylori感染可增加胃黏膜IL-6、IL-8、IL-1等炎性细胞因子的表达,改变胃的生理环境[10-11]。因此,本研究旨在探讨塞来昔布对H.pylori感染的胃癌细胞增殖、凋亡及炎症因子IL-6和IL-8表达的影响,并进一步研究对miR-145的影响。
1 材料与方法
1.1 试剂与仪器RPMI 1640培养基、胰酶、胎牛血清均购自美国Gibco公司;MTT、DMSO及塞来昔布均购自美国Sigma公司;RIPA裂解液、BCA蛋白定量试剂盒、Annexin V-FITC/PI双染细胞凋亡试剂盒均购自中国碧云天公司;PCNA、Bcl-2、Bax和p-AKT3抗体均购自美国Abcam公司;Trizol试剂盒及Lipofectamine 2000试剂盒均购自美国Invitrogen公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;qRT-PCR仪、酶标仪均购自美国Bio-Rad公司;流式细胞仪购自美国BD公司。
1.2 菌株与细胞H.pylori标准菌株NCTC11637及人胃癌SGC-7901细胞均购自美国ATCC细胞库。冻存的H.pylori常规复苏后,取100 μl接种于含质量浓度为100 g/L的脱纤维羊血的哥伦比亚琼脂培养基中,置于体积分数为5%的O2、10%的CO2、85%的N2微需氧三气培养箱中培养。接种72 h后对H.pylori进行鉴定。SGC-7901细胞使用含10% FBS的RPMI 1640培养基,置于体积分数5%的CO2、37 ℃、饱和湿度培养箱中常规培养、传代。实验为对数生长期的细胞。
1.3H.pylori与SGC-7901细胞共培养以2.5×105个/孔接种生长至对数期的SGC-7901细胞于6孔板,细胞贴壁后更换培养液(不含抗生素)。收集培养72 h的H.pylori,使用PBS稀释制备为细胞悬液,紫外分光光度计测定吸光度值(OD值),以1OD660 nm为1×108CFU/ml,按照1∶100比例加入细胞和细菌,继续培养。
1.4 MTT检测细胞增殖取生长至对数期的SGC-7901细胞,胰酶消化,计数,并以5×104个/ml密度接种96孔板,细胞完全贴壁后,弃掉孔内液体,按照100 μl/孔加H.pylori菌液。培养2 h后,按照100 μl/孔加终浓度为50、75、100 μmol/L的塞来昔布,每组设置5个重复孔,设置不加药的为对照组(共培养组)。继续培养24、48和72 h,每孔中加入20 μl的MTT(5 mg/ml),避光培养4 h,再每孔加入150 μl的DMSO,混匀。酶标仪测定波长为490 nm的OD值。实验重复3次。
1.5 流式细胞术检测细胞凋亡接种对数生长期的SGC-7901细胞于6孔板,待细胞贴壁后加入终浓度为20、40、80 μmol/L的塞来昔布,同时设置对照组(即共培养组)。培养48 h后,胰酶消化细胞,并调整细胞浓度为5×105个/ml。预冷PBS洗涤细胞,结合缓冲液重悬细胞,离心,弃上清,重复洗涤步骤2次。加入Annexin V-FITC和PI各5 μl,室温条件避光反应15~20 min。上机前再加入300 μl结合缓冲液,流式细胞仪检测各组细胞凋亡率。实验重复3次。
1.6 Western blotting检测PCNA、Bcl-2、Bax和p-AKT3蛋白表达收集塞来昔布处理48 h细胞,加适量RIPA裂解液,反应30 min后,离心,收集上清。BCA法定量蛋白。每孔等量蛋白,经SDS-PAGE电泳分离后,湿转PVDF膜,然后将膜置于质量浓度为50 g/L的脱脂奶粉中封闭2 h。加PCNA、Bcl-2、Bax和AKT3抗体,4 ℃孵育过夜,洗膜。加HRP标记的二抗,室温孵育1 h,洗膜。ECL显色,显影,定量,Quantity One软件分析各抗体条带灰度值。实验重复3次。
1.7 qRT-PCR检测IL-6、IL-8和miR-145表达收集塞来昔布处理48 h细胞,Trizol法提取细胞总RNA。取2 μl RNA,加入98 μl DEPC水,NanoDrop检测RNA样品在260 nm及280 nm处的OD值。将OD260/OD280为1.8~2.0的RNA逆转录为cDNA,以cDNA为模板,按照荧光定量试剂盒说明进行PCR扩增。以所得的Ct值,采用2-△△Ct法计算。实验重复3次。所有引物由海吉玛生物制药公司合成,序列如下:IL-6 F:5′-ATGAGGAGACTTGCCTGGTGAA-3′,R:5′-CAATCTGAGGTGCCCATGCTAC-3′;IL-8 F:5′-CTCTGTTGGCAGCCTTCCTGATTTC-3′,R:5′-AACTTCTCCACAACCCTCTG-3′;GAPDH F:5′-CATGAGAAGTATGACAACAGCCT-3′,R:5′-AG-TCCTTCCACGATACCAAAGT-3′;miR-145 F:5′-GGTCCAGTTTTCCCAGG-3′,R:5′-CAGTGCGTGTCGTGGAGT-3′;U6 F:5′-CGCAAGGATGACACG-3′,R:5′-GAGCAGGCTGGAGAA-3′。
1.8 双荧光素酶报告实验靶基因预测软件显示miR-145与AKT3存在连续的结合位点。构建含有结合位点的AKT3的野生型(WT)及突变型(MUT)3′UTR报告质粒。接种SGC-7901细胞(5×104个/孔)于24孔板,细胞达80%融合时可进行转染。将质粒与miR-145 mimics和miR-NC参照Lipofectamine 2000试剂盒说明共转染至细胞。转染48 h,参照双荧光素酶报告基因检测试剂盒说明检测各组细胞荧光素酶活性。
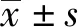
2 结果
2.1 塞来昔布对H.pylori感染的SGC-7901细胞增殖和凋亡的影响MTT检测结果显示,不同浓度塞来昔布处理SGC-7901细胞24~72 h,细胞增殖受到抑制,且呈剂量、时间依赖性。流式细胞术检测结果显示,不同浓度塞来昔布处理SGC-7901细胞48 h,随着塞来昔布浓度增加,细胞凋亡率升高,呈浓度依赖性(见图1、表1)。

图1 塞来昔布对H.pylori感染的SGC-7901细胞凋亡的影响Fig 1 The effect of Celecoxib on the apoptosis of SGC-7901 cells infected with H.pylori

表1 塞来昔布作用于H.pylori感染的SGC-7901细胞不同时间OD值及凋亡率Tab 1 The OD value and apoptosis rate of Celecoxib acted on H.pylori-infected SGC-7901 cells at different time
2.2 塞来昔布对H.pylori感染的SGC-7901细胞PCNA、Bcl-2和Bax表达的影响Western blotting检测结果显示,不同浓度塞来昔布均可明显抑制PCNA和Bcl-2表达,增强Bax表达,且随着塞来昔布浓度增加,对PCNA和Bcl-2表达抑制及Bax表达增强作用更明显(P<0.05)(见图2、表2)。

表2 各组细胞PCNA、Bcl-2和Bax蛋白相对表达量Tab 2 The relative expression of PCNA,Bcl-2 and Bax protein in each group of cells

图2 塞来昔布对H.pylori感染的SGC-7901细胞PCNA、Bcl-2和Bax表达的影响Fig 2 The effect of Celecoxib on the expression of PCNA,Bcl-2 and Bax in SGC-7901 cells infected with H.pylori
2.3 塞来昔布对H.pylori感染的SGC-7901细胞IL-6和IL-8的影响采用qRT-PCR检测不同浓度塞来昔布对炎症因子IL-6和IL-8表达的影响,结果显示,随着塞来昔布浓度增加,IL-6和IL-8表达水平降低,与对照组比较,差异有统计学意义,且呈浓度依赖性(P<0.05)(见表3)。

表3 各组细胞IL-6和IL-8 mRNA相对表达量Tab 3 The relative expression of IL-6 and IL-8 mRNA in each group of cells
2.4 塞来昔布对H.pylori感染的SGC-7901细胞miR-145表达的影响qRT-PCR检测结果显示,塞来昔布浓度越高,miR-145表达水平越高,与对照组比较,差异有统计学意义,且呈浓度依赖性(P<0.05)(见表4)。

表4 塞来昔布对H.pylori感染的SGC-7901细胞miR-145和p-AKT3表达的影响Tab 4 The effect of Celecoxib on the expression of miR-145 and p-AKT3 in SGC-7901 cells infected with H.pylori
2.5 塞来昔布可调节miR-145靶基因AKT3表达靶基因预测软件显示,miR-145的5′UTR与AKT3 3′UTR存在连续结合位点(见图3A)。双荧光素酶报告基因检测结果显示,miR-145 mimics可明显降低野生型AKT3质粒荧光素酶活性(P<0.05),而对突变型AKT3质粒荧光素酶活性无明显影响(P>0.05)(见表5)。提示miR-145和AKT3存在靶向关系。Western blotting结果显示,随着塞来昔布浓度增加,p-AKT3表达降低,与对照组比较,差异有统计学意义(P<0.05)(见图3B、表5)。

图3 miR-145和AKT3的结合位点及塞来昔布对p-AKT3表达的影响Fig 3 The binding site of miR-145 and AKT3 and the effect of Celecoxib on the expression of p-AKT3

表5 AKT3 WT/MUT与miR-145 mimics共转染SGC-7901细胞后的荧光素酶活性Tab 5 Luciferase activity of SGC-7901 cells co-transfected with AKT3 WT/MUT and miR-145 mimics
3 讨论
胃癌的发生发展与宿主遗传、环境、H.pylori等多种因素有关,H.pylori是目前所知可在人体胃中生存的唯一微生物。H.pylori是胃癌及癌前病变的始动因素,H.pylori的根除可延缓癌前病变进展,降低胃癌发病率[12]。COX-2是一种诱导型限速酶,有研究显示,H.pylori感染可引起胃癌COX-2表达升高[13]。在正常情况下,COX-2在多数组织低表达或不表达,在受到紫外线照射、肿瘤诱导剂、各种细胞因子等的刺激后,可出现异常表达。塞来昔布是第一个特异性COX-2抑制剂,可在体内体外抑制肿瘤生长[14]。以往研究已证实,H.pylori感染的胃癌细胞能够促进细胞生长和转移,此外,通过减少或增加各种miRNA的表达来改变胃癌细胞的主要过程,包括免疫应答、细胞凋亡、细胞周期和自噬[15]。因此,本实验未对H.pylori感染的胃癌SGC-7901细胞增殖和凋亡情况进行检测,以H.pylori感染的胃癌SGC-7901细胞为对照,探究塞来昔布对H.pylori感染的胃癌SGC-7901细胞增殖、凋亡的影响,结果显示,不同浓度塞来昔布均可抑制细胞增殖,促进细胞凋亡。
Bcl-2家族基因与细胞凋亡密切相关,有研究显示,H.pylori可引起Bcl-2家族抑凋亡基因Bcl-2表达升高,促凋亡基因Bax表达降低[16]。Bcl-2/Bax比率是启动细胞凋亡的“分子开关”,可决定细胞凋亡程度,Bcl-2表达增多,Bax-Bax分开,形成Bcl-2-Bax异源二聚体,可抑制细胞凋亡,有研究显示,塞来昔布可通过调节Bcl-2/Bax影响胃癌细胞凋亡[17]。PCNA是一个只存在于增殖细胞中的蛋白,其表达高低可衡量细胞增殖状态[18]。本研究结果显示,不同浓度塞来昔布均可抑制H.pylori感染的胃癌细胞PCNA和Bcl-2表达,增强Bax表达。提示塞来昔布对H.pylori感染的SGC-7901细胞增殖凋亡影响与调节PCNA、Bcl-2和Bax表达有关。IL-6是一种多功能的细胞因子,IL-8是一种细胞趋化因子,在H.pylori感染引起胃黏膜损伤时,IL-6和IL-8表达升高[19-20]。本研究结果显示,塞来昔布可明显抑制H.pylori感染的SGC-7901细胞IL-6和IL-8表达。提示塞来昔布可降低H.pylori感染的胃癌细胞炎症反应。
近年来研究发现,miRNA异常表达与胃癌增殖、凋亡等过程密切相关[21]。miR-145是miRNA家族成员之一,有研究显示,在H.pylori感染的胃癌中miR-145表达降低[22]。提示miR-145可能参与H.pylori感染的胃癌发生发展。PI3K/AKT信号通路是一条重要的信号途径,其激活是引起胃癌凋亡受阻的机制之一[23]。有研究发现,H.pylori可激活胃癌PI3K/AKT信号通路[24]。塞来昔布可通过抑制PI3K/AKT信号通路抑制胃癌细胞生长[25]。AKT是一种丝氨酸/苏氨酸激酶,在组织中广泛分布,其活化可通过调节下游分子表达,从而参与细胞增殖、肿瘤生长等过程[26]。本研究发现miR-145和AKT3存在靶向关系,且塞来昔布可抑制磷酸化的AKT3表达。提示塞来昔布对胃癌细胞生长影响与调节miR-145表达有关。
综上所述,塞来昔布可抑制H.pylori感染的胃癌细胞增殖,促进细胞凋亡,抑制炎症反应,机制可能与塞来昔布引起miR-145表达改变进而调控其靶基因AKT3表达有关。本研究为H.pylori感染的胃癌治疗研究提供了一定的理论依据。

