猪圆环病毒3型微滴式数字PCR检测方法的建立与应用
李原野 陈世界 林华 张婧 安薇 陈瑛琪 张继宗 朱玲


摘要: 为建立能灵敏、高效、准确诊断猪圆环病毒3型(PCV3)的检测方法,并运用该方法研究PCV3传播特性及组织嗜性,根据GenBank中PCV3 ORF2基因(MF631813.1)的核苷酸序列,设计合成PCV3的引物和探针,通过退火温度以及引物、探针用量和特异性等优化,建立了PCV3微滴式数字PCR检测方法。试验结果表明建立的猪圆环病毒3型微滴式数字PCR检测方法具有较好高的灵敏性、重复性和特异性,最低能检测到1 μl 16.35拷贝的质粒标准品,可用于猪圆环病毒3型的早期诊断。
关键词: 猪;圆环病毒3型;微滴式数字PCR
中图分类号: S852.65+9.2 文献标识码: A 文章编号: 1000-4440(2021)02-0389-08
Abstract: To establish a detection method that can diagnose porcine circovirus type 3 (PCV3) sensitively, efficiently and accurately and can be used to explore the transmission characteristics and tissue tropism of PCV3, the primers and probes of PCV3 were designed and synthesized according to the nucleotide sequence of PCV3 ORF2 gene (MF631813.1) in GenBank and the annealing temperature, primer and probe dosages and specificity of droplet digital PCR were optimized to establish droplet digital PCR detection method for PCV3. The results showed that, the established droplet digital PCR detection method for porcine circovirus type 3 with high sensitivity, reproducibility and specificity could detect a minimum of 16.35 copies/μl of plasmid standards. The method established in this study can be used for the early diagnosis of the porcine circovirus type 3.
Key words: pig;circovirus type 3;droplet digital PCR
豬圆环病毒3型(Porcine circovirus type 3,PCV3)能够引起繁殖障碍、皮炎肾病综合征、心脏及全身多系统衰竭综合征、淋巴组织病变以及渐行性消瘦等多种病症[1]。目前,圆环病毒家族中的猪圆环病毒2型和猪圆环病毒3型具有致病性[2],国内外多地区均检测出PCV3[3]。PCV3流行广泛,感染后发病率高,死亡率较低,因此常常伴发其他的病毒性疾病和细菌性疾病的混合感染。最近报道,在羚羊[4]、狍子[5]和蜱中检测出PCV3[6-7]。总之,PCV3可以感染猪[8]、野猪[9]、牛、小鼠、狗和蜱等动物,有宿主广泛性特点,这为PCV3的跨物种传播提供了条件。因此,野生动物可能成为PCV3的潜在宿主,并对养猪业造成威胁。据报道PCV1和PCV2可以感染人体细胞[10],而PCV3是否能够感染人体细胞需要进一步研究。PCV3自然感染后主要攻击猪的免疫系统,尚无特效药物以及疫苗。因此,对PCV3的早期带毒检测是防控PCV3最有效的方式。
目前实验室常用的检测方法包括荧光定量PCR、普通PCR等都存在局限性。微滴式数字PCR(Droplet digital PCR,ddPCR)是第3代PCR技术,是一种对核酸分子进行绝对定量的方法,具有高灵敏性及准确性。该方法不依赖Ct值或内参基因,就可以确定低至单拷贝数的待检靶分子的绝对数目[11]。该方法主要用于病原微生物分子诊断、复杂来源病原微生物的检测和肿瘤标志因子的检测[12]。此方法大大增加了检测的准确性和灵敏性,有利于低病毒含量样品的检测以及批量早期诊断检测。
本试验运用建立的PCV3微滴式数字PCR检测方法对猪临床各样品进行检测,从而探究该病毒的流行情况、传播途径、组织嗜性,以期为PCV3的检测提供一种更精确、高效、灵敏的方法,并为该病毒早期诊断及防控提供技术支持。
1 材料与方法
1.1 材料
1.1.1 试验样品 猪圆环病毒3型(PCV3)、猪圆环病毒2型(PCV2)、猪圆环病毒1型(PCV1)、猪伪狂犬病毒(Porcine pseudorabies virus,PRV)、猪蓝耳病毒(Porcine reproductive and respiratory syndrome,PRRSV)阳性病料、E. coli DH5α由四川农业大学动物生物技术中心提供。
1.1.2 临床样品的收集 238份临床血清样品,于2018年采自四川省绵阳市某发病猪场,该批发病猪出现疑似断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome,PMWS)症状,其中仔猪出现震颤、消瘦、皮肤黏膜苍白等症状,病死后剖解发现呼吸系统病变明显,肺部较为突出,部分死亡猪全身多处发生淋巴结水肿,收集的样品置于-70 ℃保存。47份流产胎儿、39份公猪精液、62份唾液拭纸、53份皮肤样品,为2017-2019年四川地区猪场送检样品。5头死亡仔猪为2019年四川地区猪场送检疑似PCV3感染仔猪,对其进行解剖,无菌采集心脏、肝脏、脾脏、肺脏、肾脏、淋巴结、脑等样品,-70 ℃保存备用。
1.1.3 试剂与耗材 ddPCR Supermix for Probes (no DUTP)、ddPCR Droplet Generation Oil、ddPCR Droplet Reader Oil、Droplet Generator DG8 Cartndge Droplet Gene rator、DG8 Gasket Pierceable Foil Heat Seal、核酸蛋白仪均购自美国Bio-Rad公司,DL2000 DNA marker购于北京索莱宝科技有限公司,磁珠法病毒DNA/RNA提取试剂盒(Magnetic Viral DNA/RNA Kit)、普通琼脂糖凝胶DNA回收试剂盒、质粒抽提试剂盒均购自天根生化科技(北京)有限公司,Premix Ex Taq(Probe qPCR)、Prime Script RT reagent Kit、pMD19-T Simple Vector、Prime STAR Max DNA Polymerase、2×Taq PCR Master Mix等均购自宝生物工程(大连)有限公司,引物、探针购自生工生物工程(上海)股份有限公司,其余试剂均为国产分析纯试剂。
ddPCR微滴生成仪QX100、ddPCR读数仪QX100、ddPCR板热封仪PX1、PCR仪、核酸蛋白测定仪购自美国Bio-Rad公司。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank已公开PCV3 ORF2基因核苷酸序列(MF631813.1),遵循TaqMan复合荧光引物探针设计原则,利用Primer Premier 5.0软件设计一对特異性引物(PCV3-F1/PCV3-R1)和探针(PCV3-P),探针5′端标记荧光报告基团为FAM,3′端标记荧光淬灭集团BHQ。根据GenBank已公开PCV3 ORF2( MF139082.1)全基因核苷酸序列,设计检测上下游引物(PCV3-F2/PCV3-R2)。引物和探针均由生工生物工程(上海)股份有限公司合成。引物序列见表1。
1.2.2 重组质粒标准品的制备 采用特异性PCV3 ORF2检测引物(PCV3 F2/R2)对模板进行PCR扩增,反应条件为95 ℃ 4 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃ 7 min。依据天根普通琼脂糖凝胶DNA回收试剂盒说明书进行扩增产物的回收、纯化。将回收的产物连接至pMD 19-T simple Vector,转化至DH5α感受态细胞,构建重组质粒pMD19-PCV3-ORF2。阳性克隆经上海生工生物工程技术服务有限公司测序分析,依据天根质粒抽提试剂盒明书对阳性克隆菌进行质粒抽提,测定计算出拷贝数,以阳性质粒作为PCV3 ddPCR的阳性标准品和后续试验的阳性模板。
1.2.3 核酸提取与反转录 采用Magen MagPure Viral Nucleic Acid KF Kits磁珠法病毒DNA/RNA提取试剂盒,从PCV3、PCV1、PCV2、PRV、PRRSV阳性病料、238份血清样品、47份流产胎儿、39份公猪精液、62份唾液拭纸、53份皮肤样品、35份疑似PCV3感染猪组织样品中提取DNA/RNA,并移至干净的EP管中保存。提取后的RNA使用Prime Script RTKit反转录试剂盒进行反转录。反转录体系为:5×PrimeScript Buffer 4.0 μl,PrimeScript RT Enzyme Mix I 1.0 μl,Oligo dT Primer 1.0 μl,Random 6 mers 4.0 μl,ddH2O 4.0 μl,RNA模板6.0 μl。反应条件为37 ℃,15 min;85 ℃,5 s,并将cDNA产物保存于-20 ℃备用。
1.3 PCV3 ddPCR方法的建立
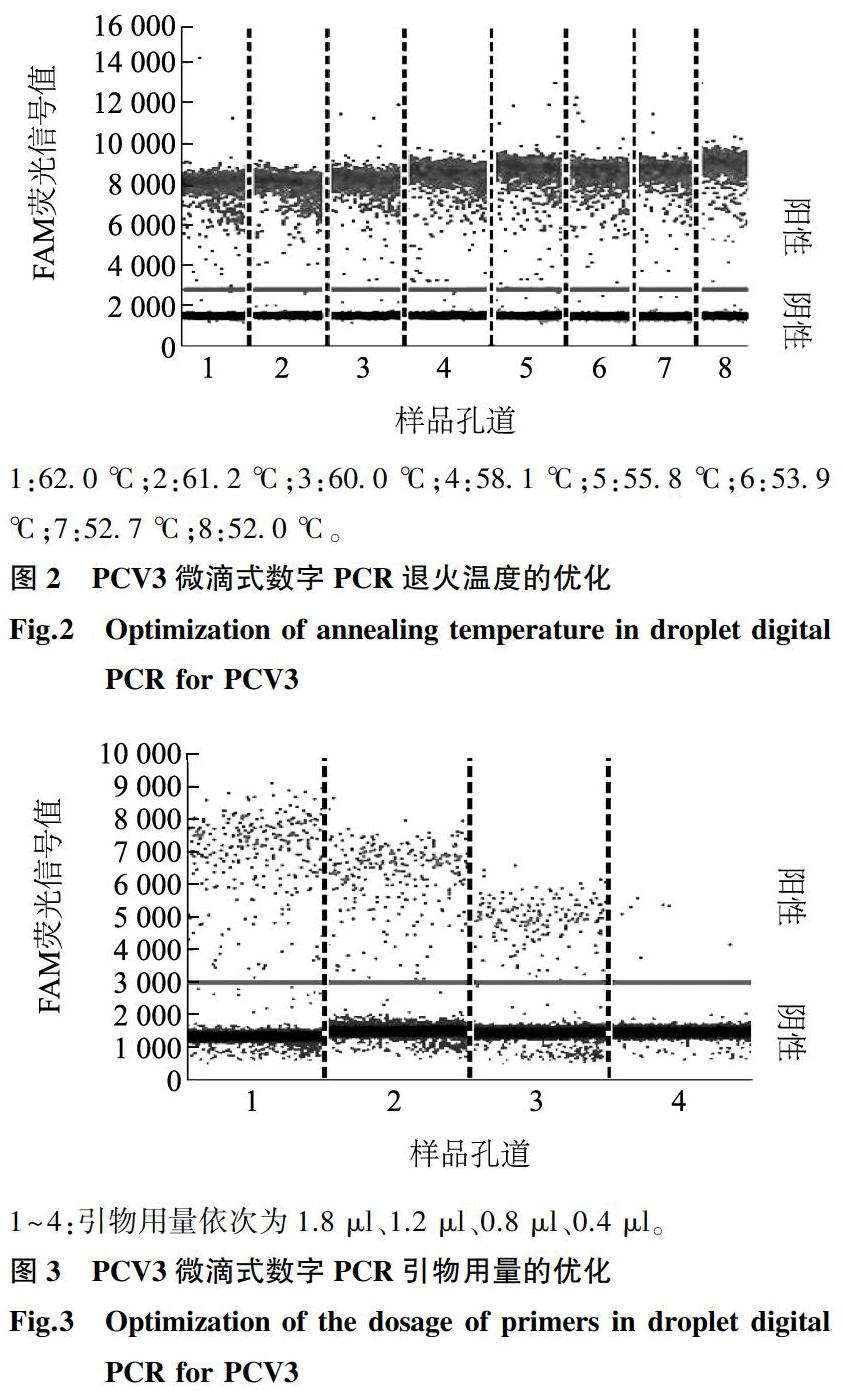
1.3.1 退火温度的确立 选取1 μl 6.54×103拷贝的质粒标准品pMD-PCV3进行退火温度优化试验。扩增体系为:ddPCRTM Supermix for Probes(no dUTP)10 μl,上、下游引物各2 μl,探针1 μl,加ddH2O至20 μl。根据ddPCRTM Supermix for Probes(no dUTP)的扩增程序进行PCR扩增,扩增条件为:95 ℃ 10 min;94 ℃ 30 s,Tm 52~62 ℃,40个循环;98 ℃ 10 min,4 ℃ 2 min。进行扩增之前将PCR扩增仪的退火温度设定为52~62 ℃,进行PCR扩增,最终根据阴、阳微滴数的比例以及荧光信号收集情况,得到最佳退火温度,特别注意升降温速度不得超过2 ℃/s。
1.3.2 引物用量的确立 选取1 μl 6.54×103拷贝的质粒标准品pMD-PCV3进行引物用量优化试验。总反应体系为20.0 μl,在ddPCRTM Supermix for Probes(no dUTP)10.0 μl、模板2.0 μl、探针量1.0 μl不变的情况下,分别加入1.8 μl、1.2 μl、0.8 μl和0.4 μl的上、下游引物,剩余用ddH2O补全。在优化后的反应程序下进行反应,得出最佳引物量,使阴阳性微滴的荧光信号差异明显。
1.3.3 探针用量的确立 选取1 μl 6.54×103拷贝的质粒标准品pMD-PCV3进行探针用量优化试验。总反应体系为20.0 μl,在ddPCRTM Supermix for Probes(no dUTP)10.0 μl、模板2.0 μl、最优上下游引物量各1.8 μl不变的情况下,分别加入0.25 μl、0.50 μl、0.75 μl和1.00 μl的探针进行PCR扩增,剩余用ddH2O补全。确立最优的探针量,得出扩增效率最高、具有明显阴阳性微滴荧光信号差值的最优探针量。
1.3.4 特异性试验 分别提取PCV1、PCV2、PRV、PRRSV的核酸,以DNA或反转录后的cDNA为模板,运用优化的反应条件进行ddPCR扩增,验证本方法的特异性。
1.3.5 敏感性试验 将质粒标准品pMD-PCV3-ORF2高浓度原液进行10倍梯度稀释,最终稀释成1 μl 6.54×103~6.54×101拷贝,再从1 μl 65.4拷贝依次进行2倍稀释,稀释成1 μl 32.7拷贝、16.35拷贝、8.18拷贝共6个系列,并设置阴性对照,以这6个系列的PCV3重组质粒标准品梯度进行ddPCR,得出该方法能够检出的最低浓度。
1.3.6 重复性试验 选取4个来自同一批次但浓度不同的质粒标准品pMD-PCV3-ORF2,每个浓度设置3个重复,测试批内重复性。以选出的4个浓度不同的PCV3重组质粒标准品为模板,不同时间点做3次ddPCR,测试批间的重复性,试验过程中设置阴性对照,分析批内和批间的变异系数,验证本方法的重复性。
1.4 临床样品的检测
依据本研究所建立的ddPCR检测方法分别对收集的238份临床血清样品分析本方法的有效性及符合度,对47份流产胎儿、39份公猪精液、62份唾液拭纸、53份皮肤样品进行检测并分析探究PCV3的传播途径,对35份疑似PCV3感染猪组织样品进行检测并探究PCV3的组织嗜性。
2 结果与分析
2.1 重组质粒pMD-PCV3-ORF2的鉴定
以PCV3的DNA,用设计的特异性引物(PCV3 F2/R2)进行PCR扩增,获得与目的片段大小一致的扩增产物,约651 bp(图1)。将PCR产物进行回收、连接转化、阳性克隆增菌培养,通过PCR、酶切测序鉴定,证实成功构建重组质粒,命名为pMD-PCV3-ORF2。质粒含量经检测计算为1 μl 6.54×1011拷贝。
2.2 PCV3 ddPCR退火温度的优化
在设置的8个退火温度梯度(52.0 ℃、52.7 ℃、53.9 ℃、55.8 ℃、58.1 ℃、60.0 ℃、61.2 ℃、62.0 ℃)中,均能收集到PCV3阳性微滴。从图2可以看出当退火温度在55.8 ℃ 时,PCR反应具有较高的FAM荧光信号值以及明显的阴阳性荧光信号差值,因此55.8 ℃ 为最佳的退火温度。
2.3 PCV3 ddPCR引物用量的优化
在其他反应条件不变的情况下,对4个不同上、下游引物用量(1.8 μl、1.2 μl、0.8 μl和0.4 μl)进行ddPCR反应,均收集到PCV3阳性微滴。从图3可以看出当上、下游引物为1.8 μl时,扩增效率最高,具有较明显的阴阳性微滴荧光信号差值,且微滴弥散度小。
2.4 PCV3 ddPCR探針用量的优化
在其他反应条件不变的情况下,对4个不同探针用量(0.25 μl、0.50 μl、0.75 μl、1.00 μl)进行ddPCR反应,均收集到PCV3阳性微滴。从图4可以看出探针用量为1.00 μl和0.75 μl时阴阳性微滴差值明显,但其微滴不集中。综合考虑后选取探针用量为0.5 μl,在该探针用量时荧光信号较高,并且阴阳性微滴差值明显,微滴弥散度低且集中。
2.5 PCV3 ddPCR的特异性
对PCV3 ddPCR检测方法进行特异性验证,PCV1、PCV2、PRV、PRRSV均只扩增出阴性微滴,只有PCV3扩增出阳性微滴(图5),说明本试验建立的PCV3 ddPCR检测方法特异性较高。
2.6 PCV3 ddPCR的敏感性
对连续稀释的6个系列质粒标准品进行本方法的敏感性验证, PCV3 ddPCR方法能检测出的最低样品含量为1 μl 16.35拷贝,低于该含量的样品无法检测到阳性微滴(表2)。
2.7 PCV3 ddPCR的重复性
从表3可以看出组内以及组间试验的变异系数都小于3%,说明所建立的PCV3微滴式数字PCR检测方法的重复性以及稳定性较好。
2.8 PCV3 ddPCR检测方法的运用
2.8.1 临床样品的检测 238份临床血清样品的检测结果显示本研究所建立的ddPCR检测方法可用于血清样品的检测,阳性检出率为50%(119/238)。运用李晓菲等[13]建立的PCV3-MGB荧光定量PCR检测方法(qPCR)同时对238份临床血清样品进行平行检测,阳性检出率为47.05%(112/238)(表4)。利用Kappa分析软件对2种方法进行Kappa分析,结果显示Kappa系数为0.941(SE=0.065,95%置信区间),说明这2种检测方法具有良好的符合率。血清样品的阳性率达到半数,表明目前PCV3的传播较普遍。
2.8.2 PCV3传播特性的探究 从表5可以看出,47份流产胎儿样品检出29份阳性样品,阳性率为61.7%;62份唾液拭纸样品检出43份阳性样品,阳性率为69.4%;39份精液样品检出27份阳性样品,阳性率为69.2%;53份皮肤样品检出31份阳性样品,阳性率为58.5%。表明本研究所建立的方法可用于临床流产胎儿、唾液拭纸、精液、皮肤样品的检测。在流产胎儿和精液中也被普遍检出,表明PCV3具有垂直传播的特性,该种特性可能成为导致猪繁殖障碍的因素之一;在唾液拭纸中被广泛检出,表明PCV3可能存在于唾液中;在皮肤中被广泛检出,体现PCV3可存活于皮肤表面,并可能通过接触传播。
2.8.3 PCV3组织嗜性的探究 将送检的5头疑似PCV3感染症状的死亡仔猪分别取心脏、肝脏、脾脏、肺脏、肾脏、颌下淋巴结、脑样品。样品检测结果(表6)显示,病毒核酸检出率为60%,表明本研究所建立的ddPCR检测方法具有较高的准确性及灵敏性,且可直接检测出目标病毒的拷贝数。5头送检死亡仔猪均检测出目标病毒,其中3号、5号仔猪在各组织器官均检测出目标病毒,表明PCV3广泛存在于猪的各个器官中。送检的5头死亡仔猪各器官检测结果显示,在不同内脏器官中PCV3病毒核酸含量具有明显的差异,病毒含量较高的组织器官为颌下淋巴结、肺脏、脑、肾脏、心脏,脾脏和肝脏病毒含量相对较低(图6)。
3 讨论
近年来,从PCV3检测数据中可知PCV3并不只存在于发病猪,在健康猪中同样存在[14]。Zhai等[3]在健康母猪和生猪屠宰样本中检出的PCV3阳性率分别为21.9%和19.14%,且认为PCV3可能联合猪蓝耳病病毒引起更严重的疾病。Saraiva等发现健康猪的PCV3阳性检出率比发病猪高11.9%[15]。上述研究结果表明PCV3不仅存在于发病猪中,对健康猪进行早期诊断、带毒检测也尤为重要。目前,PCV3的实验室诊断方法主要包括免疫组化、基于SYBR和TaqMan的qPCR[16-17]、LAMP、ELISA。ddPCR檢测技术是第3代PCR技术,具有更保守精密的检测系统,目前该技术广泛用于病原微生物分子诊断[18]、复杂来源病原微生物检测、肿瘤标记因子检测等领域。研究结果表明,ddPCR具有灵敏度极高、直接实现绝对定量、PCR反应稳定不受抑制剂影响等明显优势[19-20]。
PCV3 ORF2基因编码该病毒的衣壳(Cap)蛋白质,PCV3 Cap蛋白质是病毒的主要结构蛋白。本研究针对PCV3 ORF2基因的相关保守区域设计1对特异性引物和探针,建立了猪圆环病毒3型(PCV3)ddPCR检测方法。ddPCR最低能检测出1 μl被稀释到16.35拷贝的质粒标准品。运用本试验建立的PCV3 ddPCR检测PCV1、PCV2、PRV、PRRSV,结果均为阴性,表明该方法特异性较高,检测结果具有可靠性。在本研究重复性试验中,组内以及组间试验结果的变异系数均小于3%,表明本方法的重复性好,较稳定。该方法有效减少了样品处理各环节中的污染,降低了样品中出现假阳性的风险。ddPCR适用于早期鉴别诊断,低病毒滴度样本检测。
运用建立的ddPCR检测方法对PCV3传播特性进行初探,发现流产胎儿ddPCR检测阳性率为61.7%(29/47),精液为69.2%(27/39),表明该病毒可能与繁殖障碍相关,且具有垂直传播的特性,该病毒可能是导致母猪繁殖障碍的因素之一。Ku等[21]用PCR技术在公猪精液中检测出PCV3。Kedkovid等[22]在对38份母猪初乳样品检测中,发现17份样品呈PCV3阳性,提示母猪乳液中存在PCV3,且可能发生垂直传播。Kwon等[23]在韩国不同地区唾液拭子样本中也检出PCV3。表明该病毒可能潜伏存在于唾液中,最终可能通过唾液排毒进行水平传播。Palinski等[24]在具有猪皮炎与肾病综合征(Porcine dermatitis and nephropathy syndrome,PDNS)症状的母猪及流产胎儿体内及皮肤中检出PCV3核酸,表明PCV3可能具有皮肤接触传播的特性。上述结果表明PCV3在临床上可能通过精液传播、唾液和皮肤的接触传播,能突破胎盘屏障感染胎儿,感染PCV3的猪群可以通过唾液排毒感染同居猪群,具备水平传播和垂直传播的可能性。
吕素芳等[25]研究发现PCV3存在于淋巴结且含量较高。Chen等[26]在PCV3与仔猪先天性震颤研究中也发现该病毒在脑中的含量较高。Qi等[27]从患有呼吸系统疾病猪采集的病料中检测出PCV3阳性率为26.6%。Palinski等[24]也在皮炎肾病综合征病猪体内检测出高病毒滴度的PCV3。目前由于检测方法不同,检测的敏感性、准确性也存在差异,对PCV3组织嗜性的研究结果也存在差异。运用本试验建立的ddPCR方法对5头送检死亡仔猪各器官共35份样品进行检测,结果表明,从5头送检死亡仔猪中均检测到PCV3,其中有2头死亡仔猪的不同内脏组织中均检测出该病毒,且具有较高的病毒载量。在颌下淋巴结病毒载量最高,推测PCV3主要入侵的组织器官可能是淋巴结;其次为肺脏、肾脏、脑。该病毒在病猪体内存在广泛,可入侵不同组织器官,且在不同的组织器官中病毒含量存在差异,感染后可能引起各器官广泛感染最终引起全身性病毒血症。
目前PCV3存在普遍流行与隐性感染,极大增强了该病毒的防控难度,该病毒尚未被分离出且无特效药与疫苗,因此对该病的早期诊断、带毒检测、流行病学研究十分重要。常规的实验室检测方法,耗时长、操作复杂、易污染。本研究建立的PCV3 ddPCR检测方法,不需要制作标准曲线,直接对样品进行绝对定量,具有较高的敏感性、特异性、便捷性,可用于PCV3的早期诊断、带毒监测、进出口贸易等环节,对该病的深入研究以及防控有重大意义。
参考文献:
[1] BAEKBO P, KRISTENSEN C S, LARSEN L E. Porcine circovirus diseases: A review of PMWS[J]. Transbound Emerg Dis, 2012, 59(S1): 6067-6075.
[2] 胡会龙,魏小兵,朱红晓,等. 猪圆环病毒3型研究概况[J].动物医学进展,2019,40(8):110-113.
[3] ZHAI S,ZHOU X,ZHANG H,et al.Comparative epidemiology of porcine circovirus type 3 in pigs with different clinical presentations[J].Virology Journal,2017,14(1):222.
[4] 高盛茂,王菲菲. 猪圆环病毒3型研究进展[J]. 农村科学实验, 2018, 1(1): 110-111.
[5] HAN H Y, ZHENG H H, ZHAO Y, et al. Development of a SYBR green I based duplex real time fluorescence quantitative PCR assay for the simultaneous detection of porcine epidemic diarrhea virus and porcine circovirus3[J]. Mol Cell Probes, 2019, 44(1): 44-50.
[6] WANG W, SUN W, CAO L, et al. An epidemiological investigation of porcine circovirus3 infection in cattle in Shandong province, China[J]. BMC Vet Res, 2019, 15(2): 60-68.
[7] ESONA M D, MIJATOVIC S, YEN C, et al. Detection of PCV-2 DNA in stool samples from infants vaccinated with RotaTeq[J]. Hum Vaccin Immunother, 2014, 10(1): 25-32.
[8] 湛 洋,王東亮,王乃东,等. 猪圆环病毒3型检测及其Cap结构序列和抗原性预测分析[J]. 畜牧兽医学报, 2017, 48(6): 1076-1084.
[9] FRANZO G, LEGNARDI M, HJULSAGER C K, et al. Full-genome sequencing of porcine circovirus3 field strains from Denmark, Italy and Spain demonstrates a high within-Europe genetic heterogeneity[J]. Transbound Emerg Dis, 2018, 65: 602-606.
[10]WANG J, ZHANG Y, ZHANG R, et al. Recombinase polymerase amplification assay for rapid detection of porcine circovirus3[J]. Mol Cell Probes, 2017, 36: 58-61.
[11]朱强远,杨文秀,高一博,等. 一种可绝对定量核酸的数字PCR微流控芯片[J].高等学校化学学报,2013,34(3):68-73.
[12]张爱琼,梁海英,曾智勇,等. 猪圆环病毒3型检测方法研究进展[J]. 中国兽医学报, 2018, 38(12): 194-197.
[13]李晓菲,陈 婷,孙爱荣,等. 猪圆环病毒3型TaqMan-MGB荧光定量PCR方法的建立及应用[J]. 中国预防兽医学报, 2019, 41(2): 151-155.
[14]ZHANG J, LIU Z, ZOU Y, et al. First molecular detection of porcine circovirus type3 in dogs in China[J]. Virus Genes, 2018, 54(1): 140-144.
[15]SARAVIA G L, VIDIGAL P, ASSAO V S, et al. Retrospective detection and genetic characterization of porcine circovirus3 (PCV3) strains identified between 2006 and 2007 in Brazil[J]. Viruses, 2019, 11(3): 214-225.
[16]周康平,郑 虎,王美玉,等. 猪繁殖与呼吸综合征病毒荧光定量RT-PCR和RT-LAMP快速检测方法的建立[J].中国畜牧兽医,2014,41(1):72-75.
[17]徐朋丽,张鸿鑫,张 宇,等. 猪圆环病毒3型PCR检测方法的建立及应用[J]. 中国预防兽医学报, 2017, 39(9):43-46.
[18]朱庆义. 现代分子生物学技术在病原微生物快速诊断中的应用[J].中华检验医学杂志,2003,26(12):737-740.
[19]冯兆民,赵 翔,邹晓辉,等. 基于微滴式数字PCR技术的甲型流感病毒绝对定量方法的建立及应用[J].病毒学报,2017,33(1):5-9.
[20]原 霖,董 浩,倪建强,等. 非洲猪瘟病毒微滴数字PCR检测方法的建立[J].畜牧与兽医,2019,51(7):81-84.
[21]KU X, CHEN F, LI P, et al. Identication and genetic characterization of porcine circovirus type 3 in China[J]. Transbound Emerg Dis, 2017, 64(2): 703-708.
[22]KEDKOVID R, WOONWONG Y, ARUNORAT J, et al. Porcine circovirus type3 (PCV3) shedding in sow colostrum[J]. Vet Microbiol, 2018, 220(1): 12-17.
[23]KWON T, YOO S J, PARK C K, et al. Prevalence of novel porcine circovirus3 in Korean pig populations[J]. Vet Microbiol, 2017, 207(3): 178-180.
[24]PALINSKI R, PINEYRO P, SHANG P, et al. A novel porcine circovirus distantly related to known circoviruses is associated with porcine dermatitis and nephropathy syndrome and reproductive failure[J]. J Virol, 2016, 91(1): 1879-1891.
[25]吕素芳,李 峰,郭广君,等. 猪圆环病毒3型SYBR Green 荧光定量PCR方法的建立及初步应用[J].中国兽医学报,2019,39(7):1250-1255.
[26]CHEN G H, MAI K J, ZHOU L, et al. Detection and genome sequencing of porcine circovirus3 in neonatal pigs with congenital tremors in South China[J]. Transbound Emerg Dis, 2018, 64(2): 1650-1654.
[27]QI S, SU M, GUO D, et al. Molecular detection and phylogenetic analysis of porcine circovirus type3 in 21 provinces of China during 2015-2017[J]. Transbound Emerg Dis, 2019, 66(3): 1004-1015.
(责任编辑:张震林)

