一株金鲳鱼源屎肠球菌的分离鉴定
宋华文 王金才 赵丽梅

摘要:为分离出可用于水产养殖用的乳酸菌,本实验采集恒兴集团徐闻养殖基地3个月大的金鲳鱼12条,将其肠道及其粪便分离、捣碎,利用MRS琼脂培养基分离培养初筛目标分离菌株的形态和培养特性,再通过生理生化鉴定法和16srDNA基因系列分析,最终确定一株分离菌株为屎肠球菌,为后续水产养殖上的功能研究奠定了基础。
关键词:金鲳鱼;屎场球菌;生化鉴定;16srDNA
中图分类号:S94 文献标识码:A
文章编号:1006-3188(2021)02-012-03
益生菌是一类能定殖于宿主肠道内、能产生健康功效,改善宿主微生态平衡、发挥有益作用的活性有益微生物的总称[1]。乳酸菌因其无毒、无抗药性、无残留及无副作用等特点,是目前在动物饲料中运用最广的一类益生菌。屎肠球菌是动物肠道中的一种常见菌,它是一种兼性厌氧的乳酸菌[2]。黏附力的强弱是筛选乳酸杆菌成为益生菌株的重要标准之一。屎肠球菌为肠道共生菌,具有多种优良生物学特性。屎肠球菌的黏附能力仅次于干酪乳杆菌,可在肠道中粘附生长,形成优势菌群。由于其生长速度快,具较好粘附力,产生乳酸以及一些抗菌物质,在许多动物新出生 2~3 d 内即可占有优势地位,从而增加有益菌数量,抑制有害菌,促进肠道健康,调节肠道微生态平衡[3]。金鲳鱼是一种重要的海洋生物资源,其肉质鲜美、营养丰富,是鱼片及鱼糜制品深加工的优质原料。随着我国人民生活水平的提高,以金鲳鱼为代表的海洋养殖鱼类深受青睐[4]。
本研究对健康金鲳鱼的屎肠球菌进行分离培养并进行鉴定,旨在为其在饲料添加剂和水质改良剂的研发及应用打下了物质基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
2017年4月,湛江市徐闻县恒兴集团湛江南部海岸渔业有限公司养殖基地采集金鲳鱼12条。
1.1.2 主要试剂和仪器
MRS培养基和MRS肉汤培养基购自广东环凯微生物科技有限公司,血琼脂平板购自青岛海博生物技术有限公司,革兰氏染色液试剂盒购自北京陆桥技术股份有限公司,链球菌鉴定系统 MID Strep MID-62广东环凯微生物科技有限公司。电子天平购自厦门佰伦斯电子科技有限公司,LDZX型-50KBS 立式压力蒸汽灭菌器购自上海申安医疗器械厂,生化培养箱购自上海博讯实业有限公司医疗设备厂,生物显微镜购自尼康仪器(上海)有限公司,单人单面水平净化工作台购自苏州博莱尔净华设备有限公司。
1.2 方法
1.2.1 分离纯化
取采集的金鲳鱼解剖,将肠道分离出来,用无菌剪刀剪成小段,于无菌环境下的研钵中研磨碎,用无菌生理盐水连续稀释至10-2,分别选择稀释度原液、10-1、10-2、10-3四个稀释度的悬液100 uL,混合培养于MRS固体培养基上,37℃倒置培养24~48 h后,观察结果。取单个菌落反复划线分离至得到纯化菌株,进行血琼脂平板培养,观察细菌形态;取纯化菌株进行革兰氏染色后光学显微镜观察染色特性。
1.2.2 菌株培养液
将初步鉴定为肠球菌的菌落接种于MRS肉汤培养基中,于37℃120 r/min培养24 h,以便下一步生理生化试验与基因鉴定。
1.2.3 生理生化试验
取纯化的菌株培养液接种于链球菌鉴定系统 MID Strep MID-62,37℃生化培养箱中培养24~48 h,记录生化反应结果。
1.2.4 16srDNA基因系列分析
将获得菌株培养液送往广东省微生物分析检测中心测16S rRNA 基因序列,将所得到的16srDNA基因序列在GenBank数据库中进行Blast相似性搜索,获取与分离菌株16S rDNA基因序列最为相近的序列。采用MEGA7.0软件进行多重序列同源性比对分析,并构建系统发育树。
1.3 结果
1.3.1 血琼脂平板培养
在血平板上37℃ 培养48 h,菌落表面光滑,不透明,乳白色,圆形隆起,边缘整齐。
1.3.2 革兰氏染色
革兰氏染色后在光学显微镜下观察,菌体球形或卵圆形,无鞭毛,无芽孢,单个或成双排列,也有一部分短链状排列,蓝紫色,属于革兰氏阳性菌。
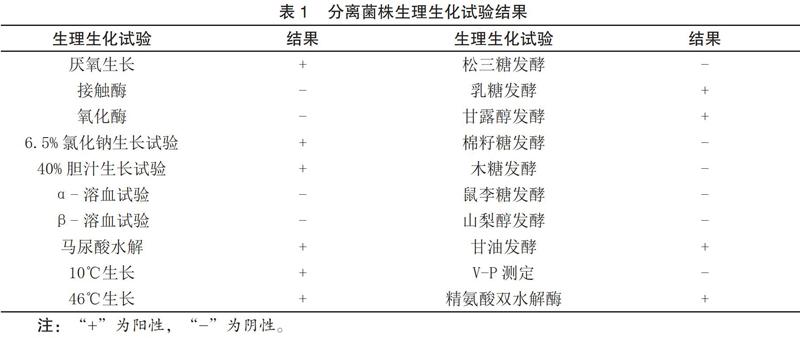
1.3.3 生理生化特性
生理生化试验表明,该菌兼性厌氧,在10℃~45℃条件下能生长,在6.5%氯化钠中和40%胆汁中生长,接触酶与氧化酶阴性,精氨酸双水解酶阳性,可发酵乳糖、甘露醇、甘油,水解马尿酸阳性,结果符合肠球菌生化标准,结合菌株形态与革兰氏染色结果,可初步鉴定该分离菌株为肠球菌。
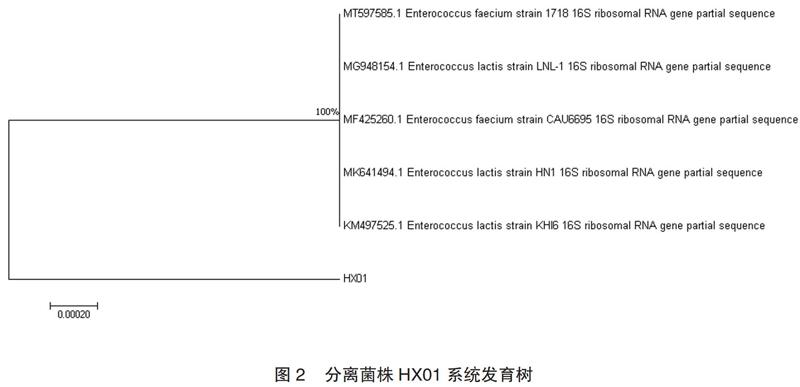
1.3.4 16srDNA基因系列分析
该分离菌株HX01的16S rDNA测序序列在GeneBank经Blast后显示,与GeneBank中屎肠球菌和乳酸肠球菌的序列同源性均在99.09%与99.16%。选取GeneBank中相似度达99.0%以上的屎肠球菌和乳酸肠球菌的部分序列共5个16S rDNA序列经过多重序列比对,使用MEGA7.0软件按 Neighbor-Joining 法构建系统发育树,如图2所示,分离菌株HX01与屎肠球菌和乳酸肠球菌的同源性均达100%。结合菌株形态、革兰氏染色结果及生理生化特征,可鉴定该菌株为屎肠球菌。
3 讨论
根据该分离菌株的菌落特征,革兰氏染色后镜检的形态特征及生理生化特性,可初步鉴定为肠球菌。通过该菌株的16S rDNA基因序列分析的结果,鉴定该分离菌株为屎肠球菌。屎肠球菌为我国农业部2013年公布的可作为饲料添加剂的微生物菌种,在畜禽上已经得到了广泛的研究与应用。在水产动物上,有研究显示,饲料中添加屎肠球菌能够降低水产动物肠道中有害菌如肠道中金黄色葡萄球菌、大肠杆菌、弧菌、嗜水气单胞菌等的数量,提高水产动物的生长速率[5-7]。本研究从金鲳鱼肠道中分离出屎肠球菌,说明屎肠球菌能够在金鲳鱼肠道中生长,可能对维持水产动物肠道微生态平衡起着重要作用。本实验室将对该菌株进行后续研究,即该菌株是否在水产动物消化道内是否能够发挥益生作用,如影响动物的营养特性,产生干扰素,产生非特异性免疫调节因子等;是否能够调节水质,如降低氨氮、亚硝酸盐,抑制弧菌等致病菌等。
参考文献
[1]孟霄鹏,孟阳,王悦,等. 益生菌对凡纳滨对虾免疫功能及肠道菌群的影响[J]. 水产科学,2017,36(1):60-65.
[2]夏鍇,陈振强,王蕾. 屎肠球菌饲用效果及作用机理[J]. 粮食与饲料工业,2016,5: 44-47.
[3]马丰英,景宇超,崔 栩,等. 屎肠球菌及其微生态制剂的研究进展[J]. 中国畜牧杂志,2019 ,55(07):54-57.
[4]李川. 金鲳鱼加工技术与综合利用研究进展. 肉类研究,2018,32(02):63-67.
[5]Bogut I, Milakovic Z, Brkic S, et a1. Effects of Enterococcus faecium on the growth rate and content of intestinal microflora in sheat fish(Silurus glanis)[J].Veterindrni Medicina, 2000,45 (4):107-109.
[6]Gopalakannan A, Arul V. Inhibitory activity of probiotic Enterococcus Faecium MC13 against hemorrhagic septicemia in common carp Cyprinus carpio[J]. AquacultureInter national, 2011, 19(5):973-985.
[7]Avella M A, Olivotto I, Silvi S, et a1. Use of Enterococcus faecium to improve common sole(Solea solea)larvieulture[J]. Aquaculture, 2011, 3l5(3-4):384-393.

