携带猪流行性腹泻病毒S1抗原表位的乙肝核心抗原病毒样颗粒的构建与鉴定
刘如月,范京惠,刘 涛, 苑军辉,李清艳,翟向和*,左玉柱*
(1. 河北农业大学动物医学院/科教兴农中心,保定 071001; 2. 瑞普(保定)生物药业有限公司,保定 071001; 3. 行唐县动物卫生监督所, 行唐 050600)
猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)主要引起新生仔猪水样腹泻,致死率高达80%~100%[1]。自1973年,猪流行性腹泻在我国多有发生[2],2010年,在我国大规模暴发,给我国生猪产业带来了严重的损失[3]。目前,市面上商品化的灭活疫苗和弱毒活疫苗不够安全[4]。所以,研制一种安全且有效的新型PED疫苗就显得尤为重要。
PEDV主要编码E、S、M和N蛋白这4种结构蛋白[5]。将PEDV的S蛋白分为S1、S2两个区域,S1集中了多个中和表位,其中,包含两个短的保守的B细胞中和表位,分别为744YSNIGVCK752和756SQYGQVKI771,它们主要决定病毒的抗原性[6-8]。所以,PED亚单位疫苗多基于S1蛋白来构建。
乙肝核心抗原 (hepatitis B core antigen, HBcAg)能够在酵母表达系统、大肠杆菌表达系统及杆状病毒-昆虫表达系统等多种表达系统中表达[9]。本研究选择的大肠杆菌表达系统和其他系统相比具有表达周期短、经济、易于操作和表达蛋白量高等优点[10]。当外源基因表位插入到HBcAg的主要免疫优势区(MIR)时,可在原核系统中进行表达,重组蛋白自发装配成病毒样颗粒(virus like particle, VLP),且可增强外源基因表位的免疫原性[11-12]。VLP是具备病毒的一些抗原性,但不具备感染性的能够自我组装的类病毒粒子。
因此,本研究以HBcAg作为呈现PEDV S1 抗原表位的载体,构建了重组质粒,表达获得重组蛋白HBcAg-PEDV S1,通过透射电镜检测发现其可以形成VLP,这为今后研制PED的新型疫苗提供研究方法及理论依据。
1 材料与方法
1.1 材料和试剂
限制性内切酶为宝生物工程(大连)有限公司产品;PEDV HB/HS株(JQ862708.1) 及大肠杆菌DH5α和BL21(DE3)感受态菌细胞由河北农业大学动物医学院动物传染病实验室保存;pcDNA3.1(+)-HBcAg(编码1—144 aa)质粒由河北农业大学王家鑫教授惠赠。
1.2 方法
1.2.1 引物设计 根据GenBank中乙肝核心抗原基因序列(KC774394)及PEDV的S基因(JQ862708.1,与CV777相似性为96.9%),分别设计引物P1、P2及P5并添加相应酶切位点及终止密码子;设计引物P3-R重叠S1的18个碱基,设计引物P4-F重叠HBcAg的17个碱基(表1)。

表1 构建重组质粒的引物
1.2.2 重组质粒的构建 用引物P3、P4通过融合PCR扩增HBcAg(编码1—74 aa)-S1片段;用引物P5进行PCR扩增HBcAg(编码83—144 aa)片段;回收目的片段进行连接转化并且测序正确后,提取质粒。对上述两个质粒用HindⅢ和XhoⅠ进行双酶切并连接。取连接完成的重组质粒pET-32a(+)-HBcAg-PEDV S1,用EcoR Ⅰ和XhoⅠ进行双酶切鉴定,再送生工生物工程(上海)股份有限公司测序。
1.3 目的蛋白的表达及纯化
将测序正确的重组质粒pET-32a(+)-HBcAg- PEDV S1转化至大肠杆菌BL21(DE3)中,表达并纯化重组蛋白,SDS-PAGE检测。
1.4 重组蛋白的复性
用尿素浓度梯度法透析法复性重组蛋白,检测复性后的蛋白浓度,SDS-PAGE检测。
1.5 透射电镜检测HBcAg-PEDV S1病毒样颗粒结构
将复性蛋白浓度调整至200 μL·mL-1,取蛋白样品滴于铜网上,滴加2%的磷钨酸负染液,自然干燥后,将样品置于透射电子显微镜下观察样品形态。
2 结 果
2.1 重组质粒pET-32a(+)-HBcAg-PEDV S1的鉴定
用EcoRⅠ和XhoⅠ对pET-32a(+)-HBcAg- PEDV S1重组质粒进行双酶切鉴定,经琼脂糖凝胶电泳检测酶切产物,可见702 bp的目的条带,对重组质粒的测序结果与目的序列进行比对,结果显示,与预期完全相符,表明成功构建重组质粒。
2.2 重组蛋白HBcAg-PEDV S1的纯化和复性
SDS-PAGE结果(图1)显示,重组蛋白HBcAg-PEDV S1通过纯化和复性后,可见43.1 ku目的蛋白;复性蛋白浓度约为1.5 mg·mL-1。
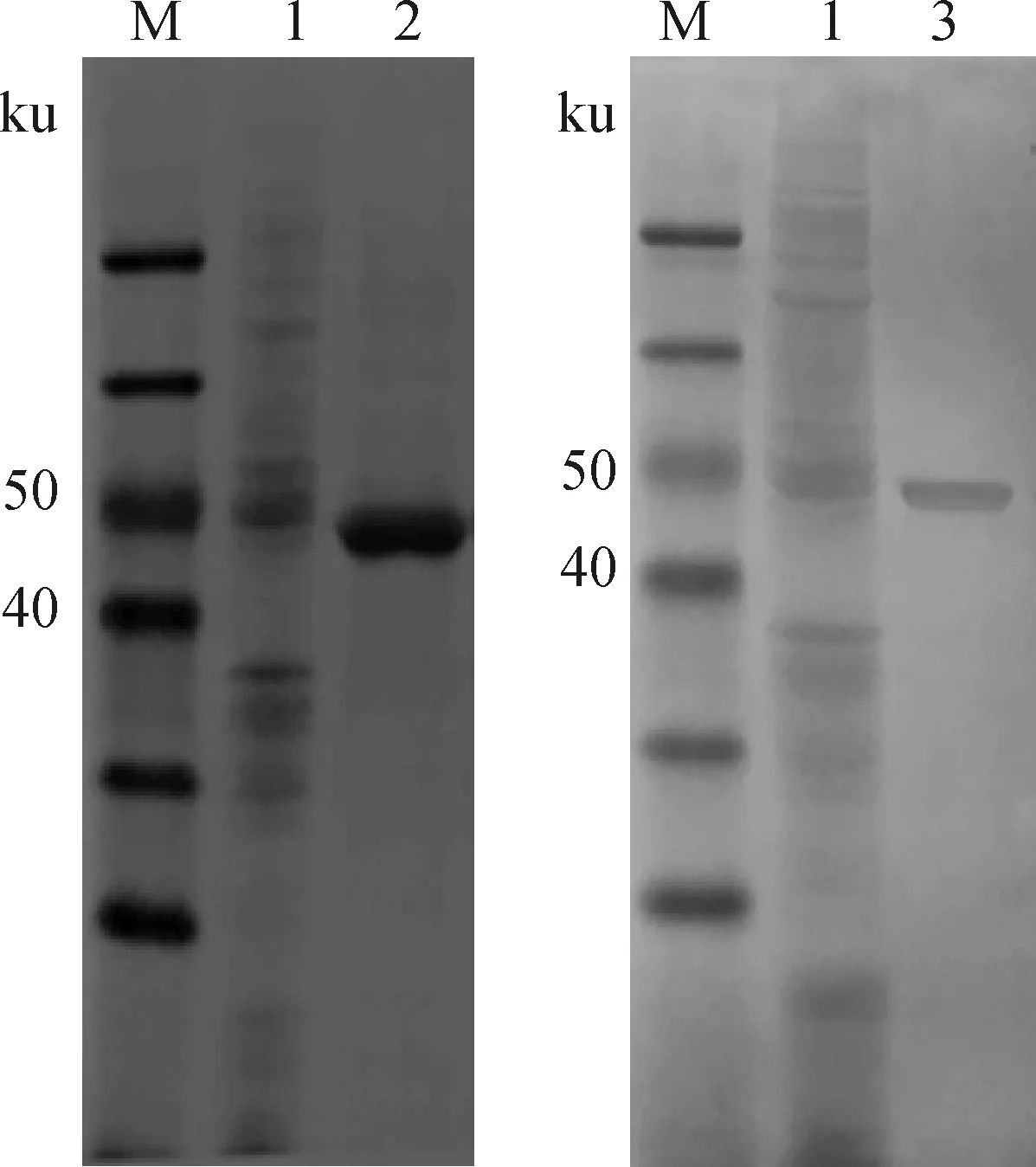
M.蛋白相对分子质量标准;1.pET-32a(+)空载体对照;2.纯化蛋白;3.复性蛋白
2.3 VLPs的透射电镜鉴定
透射电镜结果显示,可看到大小均匀的粒子形成,并且直径在30 nm左右,与预期相符(图2)。
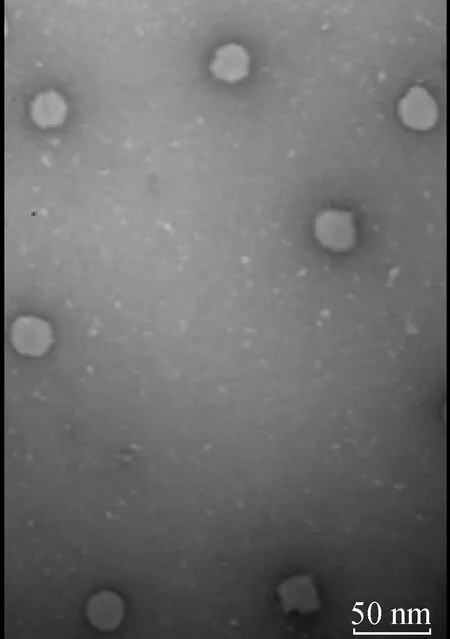
图2 HBcAg-PEDV S1 VLP的透射电镜观察
3 讨 论
目前,国内控制PEDV的主要手段是为猪群接种传统灭活疫苗和弱毒活疫苗。而传统灭活疫苗多选用经典毒株,这造成疫苗对各地的猪群免疫保护能力参差不齐;而弱毒活疫苗虽然免疫效果远优于传统灭活疫苗,但其研发成本较高、周期较长,并且基于目前的研究和临床观察发现,有弱毒活疫苗与流行毒株基因重组的现象发生[13-14],这就要求对其进行进一步研究,研发有效且安全的PED新型疫苗。
以HBcAg为载体可用于新型疫苗的研发,在美国等国家允许应用于疫苗中[15]。近期在研发PED的亚单位疫苗中, 以基因重组HBcAg与PEDV S蛋白上的B细胞表位构建了VLP,并且可在小鼠体内诱导产生特异性抗体,证明成功构建PED的基因工程疫苗[16-17]。与其相比,本研究优势在于利用融合PCR将其B细胞表位插入到HBcAg中,而不是直接由生物公司合成,降低成本的同时,可以达到相同的免疫效果。
VLP能够自发装配成类病毒粒子,具备病毒的一些抗原性,但不具备感染性[18]。1986年,乙肝表面抗原(HBsAg)作为第一种基于病毒样颗粒的商业疫苗被批准上市[19]。大肠杆菌表达系统是第一个用于生产VLPs的系统,已经生产了几种商业VLPs疫苗,例如,抗戊型肝炎病毒VLPs疫苗[20]。
PEDV S1区包含多个主要B细胞表位和受体结合域,与病毒抗原性和吸附入侵密切相关。其主要的两个B细胞表位为744YSNIGVCK752、756SQYGQVKI771[21]。 据此,本研究通过设计融合PCR[22]将PEDV S1 的B细胞表位插入到HBcAg中,成功构建了pET-32a(+)-HBcAg-PEDV S1重组质粒。将其诱导表达、纯化并复性,通过透射电镜检测到形成VLPs,表明利用大肠杆菌表达系统成功表达了PEDV S1 VLPs。本研究为后续PED疫苗的研制提供了进一步的参考。
4 结 论
作者将PEDV S1中含B细胞表位的270 bp片段插入到HBcAg的MIR区域,利用大肠杆菌表达系统表达其重组蛋白,经过透射电镜检测到成功形成HBcAg-PEDV S1 VLPs,为今后PED疫苗的研究提供了进一步的理论依据。

