猪源组织蛋白酶S抑制O型口蹄疫病毒在PK-15细胞复制
史喜绢,刘原子,张大俊,侯 景,申超超,杨 博,张 婷,袁兴国,任瑞瑞,杜晓华*,张克山*,郑海学,刘湘涛
(1.甘肃农业大学动物医学院,兰州 730070; 2.中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 农业部畜禽病毒学重点开放实验室 国家口蹄疫参考实验室,兰州 730046)
口蹄疫(foot-and-mouth disease,FMD)是由口蹄疫病毒(foot-and-mouth disease virus,FMDV)感染偶蹄动物引起的一种烈性传染病[1-3]。FMDV是微RNA病毒科(Picornaviridae)口蹄疫病毒属(Aphthovirus)的成员,已知有O、A、C、Asia1和SAT1、SAT2、SAT3 7种血清型,成熟的FMDV粒子无囊膜,具有二十面体对称性[4-6]。FMDV全基因组约为8 400 bp,含有一个大的开放阅读框(ORF),ORF编码的多聚蛋白被病毒自身编码的蛋白酶(L、2A、3C)切割成4个结构蛋白和8个非结构蛋白[7-9]。FMDV可利用自身编码的蛋白进化形成抑制或逃避宿主先天性免疫反应,从而促进其自身在宿主体内的存活和复制[10]。FMDV前导蛋白酶(LPro)通过降低IFN-α/β和干扰素刺激因子的早期分泌水平,从而阻止宿主蛋白的合成[11]。FMDV 3A蛋白能抑制病毒触发的IFN-β信号通路,从而逃避宿主免疫反应[12]。同样,宿主也可以识别病原体并激发炎症反应来抑制病毒复制[13]。已经发现有一些宿主蛋白在FMDV复制过程中起重要作用,如DCTN3与FMDV 3A结合负调控FMDV复制[14]。
CTSS是半胱氨酸蛋白酶家族中具有内切肽酶活性的重要成员,由N端16 aa信号肽(SP)、前肽和成熟肽331个氨基酸组成的非活化酶原,其活化需要蛋白酶裂解其N端前肽或由各种因素诱导[15]。CTSS酶活性是其发挥功能的关键,如棕榈酸酯抑制组织蛋白酶诱导内皮细胞侵袭从而抗血管生成,部分是通过抑制CTSL和CTSS活性而起作用的[16]。CTSS的N端有3个凹槽(S1、S2 和S3)与底物的特异性结合相关,这一特性也决定了半胱氨酸蛋白酶抑制剂的特异性;该基因C端有一个与底物结合的位点,即S1’,在酶与主要组织相容性复合体二类分子(MHC-Ⅱ)保守区的特异性结合中起关键作用[17]。CTSS主要在树突状细胞、B细胞和巨噬细胞等抗原呈递细胞中表达[18],其参与细胞外基质、抗血管生成肽和黏附蛋白的降解,促进新生血管形成和肿瘤细胞侵袭转移[19]。CTSS通过调节p38 MAPK和JNK1 途径参与甲基原薯蓣皂苷(methyl protodioscin,MP)诱导的细胞凋亡和自噬[20];通过激活NF-κB和caspase-3 从而诱导肝癌细胞凋亡并增加其化学敏感性[21];也可通过激活CD74调控趋化因子CCL2的表达,进而对肿瘤微环境产生影响[22]。目前对CTSS的研究主要集中在自身免疫性疾病[23]、心血管疾病[24]及肿瘤相关疾病[25],目前尚无有关病原体方面的报道。
初乳在抵抗病原感染中具有重要作用[26]。本团队前期应用iTRAQ技术研究发现母猪初乳中CTSS的含量显著高于常乳,但目前对宿主CTSS在病原感染中的作用研究较少,宿主CTSS在FMDV感染中的作用及其调控机制至今尚不明确。为阐明宿主CTSS在FMDV-O感染过程中发挥的作用,本研究探究了FMDV-O感染和宿主CTSS的相互调控作用,发现宿主CTSS能够抑制FMDV-O在PK-15细胞中复制,而FMDV-O感染增加了宿主CTSS酶活性,进一步研究发现CTSS促进FMDV-O诱导的抗病毒细胞因子产生,明确了猪源CTSS抑制FMDV-O复制的初步原因。本研究结果为更深层次探究猪源CTSS在FMDV-O触发的免疫应答中的作用机制奠定了基础。
1 材料与方法
1.1 材料
口蹄疫病毒毒株FMDV O/MYA98/BY/2010、PK-15细胞和FMDV-O抗体由兰州兽医研究所口蹄疫与新发病流行病学团队保存;兔多克隆抗体CTSS购于Abcam公司;鼠抗Flag单抗、鼠抗Myc单抗、鼠抗β-actin单抗、HRP标记山羊抗鼠IgG二抗和HRP标记山羊抗兔IgG二抗均购于Thermo Scientific公司。
大肠杆菌DH5α感受态、LATaqDNA聚合酶、限制性核酸内切酶BamHⅠ和XhoⅠ、T4 DNA连接酶、RNA抽提试剂Trizol、5×Prime script RT Master Mix、SYBR Permix ExTaqII和蛋白预染Marker均购于宝生物工程大连有限公司; LipofectamineTM2000转染试剂购于Invitrogen公司;Opti-MEM、0.25% EDTA胰酶和胎牛血清(FBS)均购于Gibco公司;MEM细胞培养液和PBS溶液购于建顺公司;ECL显色剂购于Thermo Scientific公司;NP-40裂解液和PMSF购于碧云天公司;织蛋白酶S试剂盒(货号ab65306)购于艾博抗(上海)贸易有限公司;CTSS干扰序列由上海吉玛制药有限公司合成。
1.2 方法
1.2.1 CTSS真核表达质粒的构建 根据GenBank公布的CTSS基因序列(XM_021089893.1)设计合成CTSS引物,引入酶切位点BamHⅠ和XhoⅠ,以pcDNA3.1为载体,构建pcDNA3.1-CTSS-Myc真核表达质粒,进行PCR扩增、酶切和序列测定。
1.2.2CTSS基因 RNAi序列设计与合成 根据GenBank公布的CTSS基因序列(XM_021089893.1)设计并合成CTSS RNAi序列。分别设计了3对针对CTSS基因的RNAi序列。
1.2.3 细胞瞬时转染和病毒感染 将细胞消化后接种于细胞板中,待细胞长至70%~90%时,将质粒与Lip2000试剂(DNA∶Lip2000=1 μg∶2 μL) 分别加至Opti-MEM中,混合后静置15 min,将Opti-MEM混合物直接加至细胞中,将细胞放于培养箱中培养数小时。用无血清的MEM清洗细胞,用无血清的MEM将FMDV-O稀释至MOI为1.0时感染PK-15细胞,置于37 ℃、5%CO2培养箱孵育1 h之后,弃去病毒液,用含2% FBS的MEM维持液继续培养。在感染后12 h收取2份细胞样品,一份用于RT-qPCR,分别检测CTSS和FMDV-O转录水平的变化,并以猪源GAPDH作为内参;一份用于Western blot,分别检测CTSS和FMDV-O蛋白水平的变化,并以β-actin作为内参。
1.2.4 RT-qPCR 收集细胞样品,采用Triozl法提取细胞总RNA,利用合成好的引物进行绝对定量和相对定量检测[1]。相关定量扩增引物信息见表2。

表2 引物序列信息
1.2.5 CTSS酶活性测定 利用组织蛋白酶S活性检测试剂盒(货号ab65306;Abcam)提供的裂解液裂解细胞,离心取50 μL上清于96孔板,加等量反应缓冲液和10 mmol·L-1Ac-VVR-AFC(CTSS底物),根据试剂盒说明书进行处理。使用SpectraMax M5荧光计在400 nm激发波长和505 nm发射波长下测量荧光。
1.2.6 Western blot 收样并处理细胞样品,加入适量的NP-40裂解液(PMSF 1 mol·L-1);充分裂解后,12 000 r·min-1离心10 min,取上清加入含β-巯基乙醇的5×SDS Loading Buffer,100 ℃变性10~15 min,按20 μL的上样量进行SDS-PAGE凝胶电泳[1],最后用高分辨图像采集系统进行ECL显影并保存结果。
1.2.7 数据分析 所有试验至少重复3次,应用 GraphPad Prism 7软件进行分析并作图,运用独立样品T检验进行统计学分析,*.P<0.05表示数据具有统计学意义,**.P<0.01表示数据具有显著性差异,***.P<0.001表示数据间具有极显著性差异。
2 结 果
2.1 FMDV-O感染PK-15细胞促进内源性CTSS表达
将PK-15细胞铺于35 mm小皿中,待细胞长至80%~90%,用MOI为1的FMDV-O感染PK-15细胞,在0、4、8、12 h后收取细胞样品,利用RT-qPCR和Western blot方法检测内源性CTSS的变化。结果表明FMDV-O感染PK-15细胞后内源性的CTSS蛋白水平(图1A)和转录水平(图1B)均高于对照组,提示FMDV-O感染可促进宿主细胞内源性CTSS的表达。
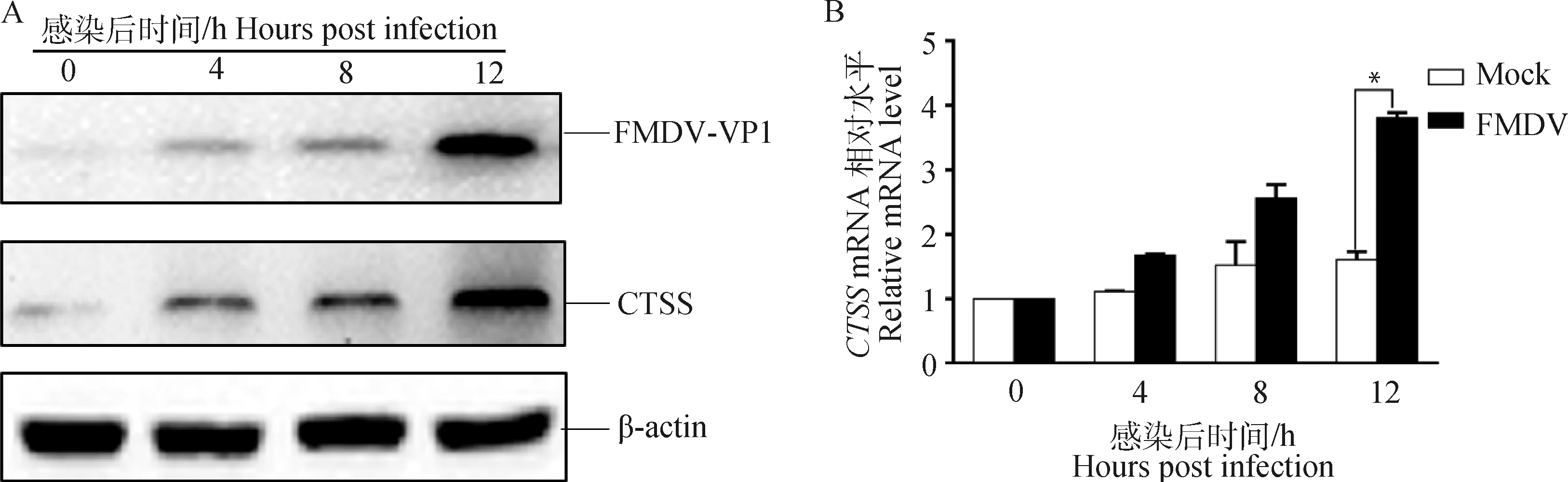
A. Western blot检测CTSS蛋白水平的变化;B. RT-qPCR检测CTSS转录水平的变化;*.P<0.05
2.2 CTSS重组质粒构建及表达验证
构建pcDNA3.1-CTSS-Myc重组质粒,进行PCR扩增,用BamH Ⅰ和XhoⅠ双酶切鉴定,10 g·L-1琼脂糖凝胶电泳检测可在1 000 bp处见目的条带,在5 000 bp 见载体条带(图2A)。经测序后进一步确定该真核质粒构建成功。将构建的pcDNA3.1-CTSS-Myc以不同的剂量分别瞬时转染PK-15细胞,24 h后收取细胞样品,处理样品并进行Western blot验证其表达情况,结果表明pcDNA3.1-CTSS-Myc重组质粒在PK-15细胞中呈剂量依赖性表达(图2B)。

A. 双酶切鉴定结果(M. DL5000 DNA相对分子质量标准;1. BamHⅠ和XhoⅠ酶切产物);B. Western blot验证CTSS蛋白在PK-15细胞表达
2.3 FMDV-O感染能上调CTSS酶活性
转染0.25 μg CTSS重组质粒至PK-15细胞,20 h后用FMDV-O(MOI=1)感染细胞,同时设不用病毒刺激的Mock组,收取0、2、4、6、8、10、12、14 h 细胞样品,裂解细胞用Fluorometric Method检测CTSS酶活性。结果表明,FMDV-O感染能上调CTSS酶活性,且随着FMDV-O感染时间的增加,CTSS的活性也随之增加(图3)。

图3 FMDV-O感染上调CTSS酶活性
2.4 过表达CTSS能抑制FMDV-O复制
转染1、2、4 μg pcDNA3.1-CTSS-Myc至PK-15细胞,转染24 h后用MOI为1的FMDV-O感染细胞,12 h后收取细胞样品,检测其对FMDV-O复制的调控作用,发现随着CTSS表达量增加(图4A、C),FMDV-O复制水平呈现剂量依赖性降低(图4B、C)。结果表明,过表达CTSS抑制FMDV-O在PK-15细胞中复制。

A. RT-qPCR检测CTSS转录水平的变化;B. RT-qPCR检测FMDV-O拷贝数的变化;C. Western blot检测CTSS和FMDV-O蛋白水平的变化; *.P<0.05; **.P<0.01; ***.P<0.001
2.5 CTSS siRNA干扰序列的筛选及其对FMDV-O复制的促进作用
为进一步确定宿主CTSS对FMDV-O复制的影响,针对CTSS设计合成3对特异性siRNA(表1),将siRNA-2947、siRNA-3629、siRNA-3458分别转染至PK-15细胞, 在24和36 h分别收取样品,用RT-qPCR方法选择干扰效果最好的序列,结果显示编号siRNA-2947的干扰效果最好(图5A)。在此试验结果基础上,PK-15细胞转染siRNA-2947,以NC siRNA为对照,36 h后用等量FMDV-O(MOI=1)感染细胞,12 h后收取细胞样品,用RT-qPCR和Western blot检测siRNA-2947对FMDV复制的影响,结果表明siRNA-2947能下调宿主CTSS的表达进而促进FMDV-O在PK-15细胞中复制(图5B、C)。

表1 干扰序列信息

A. RT-qPCR检测CTSS转录水平的变化;B. RT-qPCR检测FMDV-O拷贝数的变化;C. Western blot检测CTSS和FMDV-O蛋白水平的变化; *.P<0.05; **.P<0.01; ***.P<0.001
2.6 过表达CTSS促进FMDV-O诱导的宿主抗病毒细胞因子产生
为明确猪源CTSS抑制FMDV-O复制的原因,检测宿主CTSS是否影响由FMDV-O感染诱导的抗病毒细胞因子产生。在PK-15细胞中分别转染CTSS和pcDNA3.1,24 h后感染FMDV-O(MOI=1),并设无FMDV-O感染对照组,12 h后收集细胞处理样品。RT-qPCR结果显示,CTSS可促进FMDV诱导的IFN-α、IFN-β、IFN-γ、IL-6、IL-10、IL-4的mRNA水平,说明宿主CTSS能激活FMDV-O诱导的宿主抗病毒细胞因子产生。
*.P<0.05; **.P<0.01; ***.P<0.001
3 讨 论
CTSS是一种溶酶体蛋白酶,主要在抗原呈递细胞中表达,其活性调节对于MHC-Ⅱ信号传导及CD4+T细胞介导的免疫反应激活非常重要[27]。有研究报道CTSS活性可以由肠道菌群调节,共生体触发生理性CTSS活性;病原体引起病理性CTSS活性增加,导致T细胞活化和增殖[28]。而本研究发现FMDV-O感染PK-15细胞可上调内源性CTSS的表达并增强CTSS活性。
FMDV以其自身优势拮抗宿主免疫应答进而达到成功感染宿主的目的,当然其生命周期也受不同宿主因素影响[29-32]。有文献报道热休克蛋白DNAJA3与VP1互作并通过自噬/溶酶体途径降解VP1,从而减弱VP1对IFN-β信号通路的拮抗作用,最终抑制FMDV复制[30]。本研究发现FMDV-O感染PK-15细胞可上调内源性CTSS的表达并增强CTSS活性,过表达CTSS抑制FMDV-O在PK-15细胞中复制,而下调内源性CTSS能促进FMDV-O复制。有报道称CTSS能使CX3CL1与CX3CR1相互作用,将免疫细胞募集到炎症部位增加CX3CL1脱落进入间质,从而改变自身免疫性泪腺炎和泪腺分泌[33];干燥综合征患者泪液中CTSS活性升高可诱导促炎细胞因子产生[34];缺乏CTSS会增加高血压小鼠线粒体的受损并提高ROS水平和NF-κB活性,从而调节心脏炎症和纤维化[35]。笔者随后检测了CTSS对抗病毒细胞因子mRNA水平的影响,RT-qPCR结果显示CTSS可促进FMDV-O诱导的IL-6、IL-10、IL-4、IFN-α、IFN-β、IFN-γ基因的转录。这一结果与文献报道一致,提示CTSS可能参与炎症反应。天然杀伤细胞(NKT)可募集并激活其他先天免疫细胞,从而调节多种免疫反应,以加剧肝的炎症反应,但CTSB和CTSS抑制剂可降低LPS诱导的炎症过程中NKT细胞的活化[36],进一步说明CTSS可能与炎症有关。FMDV在进化过程中获得了许多逃避宿主免疫系统的策略[37], 例如FMDV 3A通过破坏RIG-Ⅰ、MDA5和VISA蛋白的表达而抑制病毒触发的IFN-β信号通路[12];FMDV VP3降解JAK1以抑制IFN-γ信号转导途径[38]; LPro可以抑制天然免疫下游抗病毒细胞因子的产生从而促进病毒的复制[39-41],本文虽然检测了抗病毒细胞因子的变化,但机体的免疫系统是一个错综复杂的网络,宿主除了通过调控干扰素信号通路发挥抗病毒功能;还可以通过自噬和凋亡途径影响病毒复制,比如PCBP2和FMDV VP0互作可以通过凋亡途径促进FMDV复制[42]。这说明CTSS促进FMDV-O诱导的抗病毒细胞因子的产生,可能是宿主CTSS抑制FMDV-O复制的原因之一,具体详细机制还需要进一步研究。
本研究首次证实了CTSS在FMDV-O感染过程中发挥抗病毒作用的新功能,为宿主 CTSS拮抗FMDV-O感染方面的研究提供了理论依据,也为下一步探究猪源CTSS在FMDV-O触发的免疫应答中的作用积累了素材;此外,本研究结果也提示CTSS可能作为抑制FMDV-O复制的潜在靶点发挥作用。
4 结 论
FMDV-O感染与宿主CTSS之间具有相互调控作用,FMDV-O感染PK-15细胞显著上调内源CTSS表达并增强CTSS酶活性;过表达CTSS能抑制FMDV-O在PK-15细胞中复制,利用特异性siRNA干扰CTSS表达可以促进FMDV-O复制,并且 CTSS能促进FMDV-O诱导的IFN-α、IFN-β、IFN-γ、IL-6、IL-10和IL-4细胞因子上调表达,明确了CTSS抑制FMDV-O复制的初步原因,具体机制将是下一步研究的方向和重点。

