茄子脂氧合酶家族基因全基因组鉴定与表达分析
赵国富,严亚琴,汪精磊,魏庆镇,包崇来,*
(1.台州科技职业学院 农业与生物工程学院,浙江 温岭318020; 2.浙江省农业科学院 蔬菜研究所,浙江 杭州 310021)
脂氧合酶(lipoxygenase,LOX)又名脂肪氧化酶,是一类重要的含非血红素铁的蛋白,能够催化多不饱和脂肪酸氧合生成脂肪酸氢过氧化物,广泛存在于植物、动物和真菌中,参与茉莉酸,以及醛类和醇类等芳香物质的生物合成[1-2]。LOX家族蛋白是一类进化上高度保守的蛋白质,其典型的特征是都含有一个N端由α-螺旋构成的酶催化中心保守结构域和C端由β-折叠而成的PLAT(polycystin-1,lipoxygenase,alpha-toxin)保守结构域[3]。根据LOX家族基因催化底物亚油酸或亚麻酸被氧化时不同的反应位置可将LOX家族基因分为9-LOX(C-atom 9)和13-LOX(C-atom 13)2个亚家族。其中,根据氨基酸序列的相似性和N端有无叶绿体运输多肽可以将13-LOX亚家族基因分为Type I 13-LOX和Type Ⅱ 13-LOX[1]。LOX蛋白在植物各个组织器官中普遍存在,但是LOX家族基因的表达在植物不同组织器官、各个发育阶段,以及对生物和非生物的逆境胁迫响应中表现出较大差异[4],意味着LOX家族基因在调节植物生长和植物逆境响应方面具有重要的作用。在拟南芥(Arabidopsisthaliana)中鉴定到了6个候选LOX基因[5],AtLOX1的表达水平在病原菌侵染和脱落酸、茉莉酸甲酯的诱导的情况下会发生变化[6];AtLOX2参与调控茉莉酸酯前体的生物合成[7];AtLOX3和AtLOX4是拟南芥育性和花朵发育所必需的[8]。在番茄(Solanumlycopersicum)中,RT-PCR分析表明,LOX家族基因TomloxA和TomloxB在番茄果实中表达[9-10];TomloxC只在番茄成熟期表达,并且可以催化脂肪衍生的芳香物质的合成,从而影响番茄风味[11-12]。TomloxD在果实中表达量非常低,但在果实损伤处理后表达量显著升高,被证实参与茉莉酸的生物合成,以及番茄对非生物和生物胁迫的耐受性[13];TomloxE的表达则主要受机械损伤的诱导[12]。TomloxF基因编码13-LOX类型蛋白,并受恶臭假单胞菌(Pseudomonasputida)BTP1刺激[14]。在黄瓜(CucumissativusL.)基因组中鉴定到了23个LOX候选基因,通过表达分析发现有12个CsLOX基因在果实发育过程中差异表达,并在不同逆境胁迫下和不同激素处理中也具有不同表达水平[15-16]。Wang等[17]在萝卜(Raphanussativus)基因组中鉴定了11个LOX候选基因,比较萝卜在不同逆境条件下RsLOX基因表达水平发现,在低温处理下RsLOX7、RsLOX8和RsLOX9的基因表达水平均高于其他RsLOX基因;此外,RsLOX7和RsLOX8在盐胁迫处理过程中的基因表达水平也高于其他RsLOX基因,推测RsLOX7和RsLOX8可能在萝卜抗逆过程中发挥重要作用。所以,深入发掘不同植物的LOX基因信息和研究LOX基因的作用机制,有助于更好地了解植物器官发育和响应环境胁迫的机制,对作物品质和抗逆育种具有实际的应用价值。
茄子(SolanummelongenaL.),别名矮瓜、落苏,一年生草本植物,原产温带和亚热带。茄子适应性强,营养丰富,产量高,是我国广泛栽培的主要蔬菜之一,具有重要经济价值。茄子在生长过程中极易受极端天气、病原菌等多种非生物和生物胁迫影响,造成经济损失。深入研究茄子的抗逆机制对今后的茄子育种具有重要的意义。目前,茄子的三代基因组测序已完成[18],为从基因组水平对LOX家族基因进行鉴定和分析打下了良好的基础。本研究通过生物信息学手段对茄子的LOX家族基因进行鉴定和分类,同时利用实时荧光定量PCR(qRT-PCR),分析LOX家族基因在茄子不同器官的表达情况,为进一步探索LOX家族基因在茄子生长发育的功能奠定基础。
1 材料与方法
1.1 茄子LOX家族基因的鉴定
茄子全基因组数据库来源于浙江紫红线茄(杭茄类型)HQ-1315的基因组数据(http://eggplant-hq.cn/Eggplanthomeindex)。以Pfam数据库(http://pfam.xfam.org)中LOX结构域(PF00305)为模型,利用HMMER软件包中hmmsearch软件对茄子全基因组数据进行Blast P(E-value=10-5),筛选得到茄子SmeLOX家族基因的序列信息。利用python语言中的Biopython模块(https://biopython.org/)对茄子12个SmeLOX蛋白的等电点(PI)、蛋白分子量(MW)、亲水性、芳香性等理化性质进行预测[19]。
1.2 茄子LOX基因在染色体上的分布与系统发育树构建
通过python编程处理茄子基因组数据,获取12个SmeLOX基因在茄子染色体上的位置信息;使用MG2C软件(http://mg2c.iask.in/mg2c_v2.0/)绘制茄子LOX家族基因染色体分布图。使用Clustal软件将茄子LOX家族基因编码的蛋白氨基酸序列与来自其他17个物种的123个LOX蛋白氨基酸序列[17]进行多序列比对,利用MEGA-X软件,选择邻接法(neighbor-joining method,NJ)构建系统发育树。参数设置如下:Bootstrap设置为500次,模型选择JTT Matrix(Jones-Taylor-Thornton),缺失值处理设置为partial deletion,阈值设置为70%。
1.3 基因结构与保守基序分析
使用MEME(Multiple EM for Motif Elicitation)交互式分析工具对茄子LOX家族基因编码的蛋白结构域进行分析,Motif数量设为20,Motif长度设置为6~200。使用TBtools软件[20]对茄子LOX家族基因结构进行分析,获得茄子LOX家族基因结构和保守结构域的示意图。使用EMBOSS工具(http://emboss.sourceforge.net/)比较序列之间的相似度。
1.4 表达模式分析
浙江紫红线茄(HQ-1315)5个组织(根、茎、叶、花、果实)总RNA的提取参照天漠生物总RNA提取试剂盒的说明进行操作。提取后的RNA,使用德国ABM公司反转录试剂盒(5×All-In-One RT masterMix)按照说明书方法进行cDNA合成。使用ABI Step One Plus荧光定量PCR仪进行荧光定量PCR,在荧光定量PCR仪专用96孔板中依次加入cDNA模板1 μL,10 μmol·L-1正向引物和10 μmol·L-1反向引物(表1)各0.4 μL,2×TranStart®Tip Green qPCR SuperMix 10 μL,ddH2O 8.2 μL。反应条件:95 ℃ 30 s;95 ℃ 5 s;60 ℃ 30 s,40个循环。荧光定量PCR结束后,以18SRNA为内参基因,使用2-ΔΔCt方法计算基因的相对表达量[21]。

表1 本研究使用的qRT-PCR引物
2 结果与分析
2.1 茄子LOX家族基因的鉴定与基本信息
在浙江紫红线茄(杭茄类型)的基因组中一共鉴定到12个LOX基因,然后依据这12个LOX基因在染色体上的位置依次命名为SmeLOX1~SmeLOX12。分别对这12个LOX家族蛋白的氨基酸(aa)长度、蛋白质相对分子质量(MW)、芳香度(aromaticity)、不稳定指数(instability index)、等电点(protein isoelectric point)和亲水性(gravy)进行了统计和分析。结果显示,LOX蛋白氨基酸序列长度介于793~909 aa,其中,SmeLOX6蛋白氨基酸序列长度最长,为909 aa,SmeLOX7蛋白氨基酸序列长度最短,为793 aa;这12个蛋白的相对分子质量介于90 715.48~103 351.01 u,其中SmeLOX6蛋白的相对分子质量最大,为103 351.01 u;芳香度介于0.09~0.11;蛋白不稳定指数介于37.98~53.28;等电点介于5.41~8.54;所有蛋白的总平均亲水性系数均为负值,推测这12个蛋白均为亲水性蛋白质(表2)。

表2 茄子LOX家族基因基本信息
2.2 茄子LOX家族基因的染色体定位
从绘制出的茄子LOX家族基因染色体分布图(图1)可以看出,12个LOX基因在4条染色体上(E01、E03、E08和E09)呈不均匀分布。其中,分布在E01染色体上的LOX基因数量最多,有5个;在E03和E09染色体上均有3个LOX基因分布;E08染色体上基因数量最少,只有1个LOX基因分布(图1)。SmeLOX蛋白序列比较发现,SmeLOX家族蛋白氨基酸序列间的相似性为34.7%~89.0%(图2)。


图1 SmeLOX家族基因在茄子染色体上的位置分布Fig.1 Distribution of SmeLOX gene family on Solanum melongena chromosomes

图2 SmeLOX家族蛋白氨基酸序列相似性Fig.2 Amino acid sequence identities and similarities of LOX family proteins in Solanum melongena
2.3 茄子LOX家族系统进化关系
为了明晰茄子LOX蛋白家族成员与其他物种中已知LOX家族成员的进化关系,将茄子LOX家族蛋白的氨基酸序列与来自其他17个物种的123个LOX蛋白氨基酸序列构建了进化树(图3)。进化树中LOX家族蛋白被分为9-LOX和13-LOX两个亚家族,其中13-LOX亚家族又被分为Type I型和Type II型两类。茄子的12个LOX家族蛋白中,属于9-LOX亚家族的有6个(SmeLOX1、SmLOX2、SmeLOX3、SmeLOX9、SmeLOX11和SmeLOX12),属于Type II 13-LOX亚家族的有5个(SmeLOX4、SmLOX5、SmeLOX6、SmeLOX7和SmeLOX8),SmeLOX10蛋白属于Type I 13-LOX亚家族。此外,系统发育树中9-LOX分支又可以划分为单子叶植物组和双子叶植物组,表明9-LOX亚家族在单子叶和双子叶植物进化过程中出现了分化。
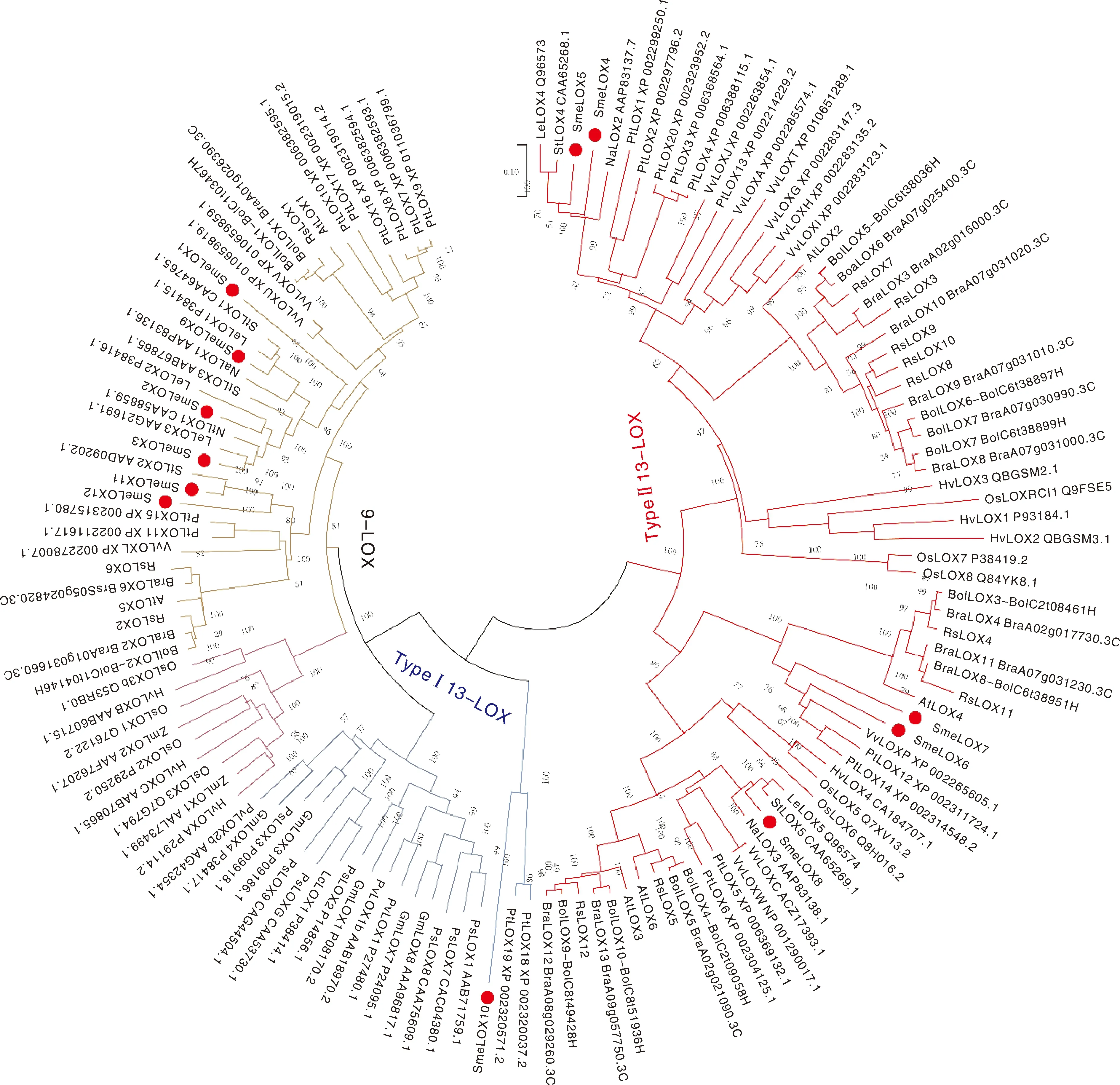
Gm,大豆;Hv,大麦;Lc,扁豆;Le,番茄;Na,野生烟草;Nt,红花烟草;Os,水稻;Ps,豌豆;Pv,菜豆;St,马铃薯;Zm,玉米;Vv,葡萄;Pt,杨树;Rsa,萝卜;At,拟南芥;Bra,白菜;Bol,甘蓝。Gm,Glycine max; Hv,Hordeum vulgare; Lc,Lens culinaris; Le,Lycopersicon esculentum; Na,Nicotiana attenuate; Nt,Nicotiana tabacum; Os,Oryza sativa; Ps,Pisum sativum; Pv,Phaseolus vulgaris; St,Solanum tuberosum; Zm,Zea mays; Vv,Vitis vinifera; Pt,Populus trichocarpa; Rsa,Raphanus sativus; At,Arabidopsis thaliana; Bra,Brassica rapa; Bol,Brassica oleracea.图3 SmeLOX家族蛋白的系统发育及其分类Fig.3 Phylogenetic relationships and classification among LOX family proteins from Solanum melongena and other species
2.4 茄子LOX家族基因的基因结构与保守基序
为了进一步阐明茄子LOX家族基因结构与保守基序的变异,对茄子12个LOX蛋白氨基酸序列构建了单独的系统发育树,并对其相应的外显子、内含子,以及编码的保守基序进行了分析(图4)。图4-B是茄子中SmeLOX基因的结构示意图,SmeLOX基因外显子的数量均为14或15个,外显子数量相似,表明它们在功能上可能有一定相似性。分析发现,9-LOX亚家族(SmeLOX1、SmLOX2、SmeLOX3、SmeLOX9、SmeLOX11和SmeLOX12)包含9~10个内含子,而13-LOX亚家族具有8~11个内含子。其中SmeLOX4和SmeLOX10的内含子最少,为8个,而SmeLOX6和SmeLOX8的内含子最多,有11个(图4-B)。
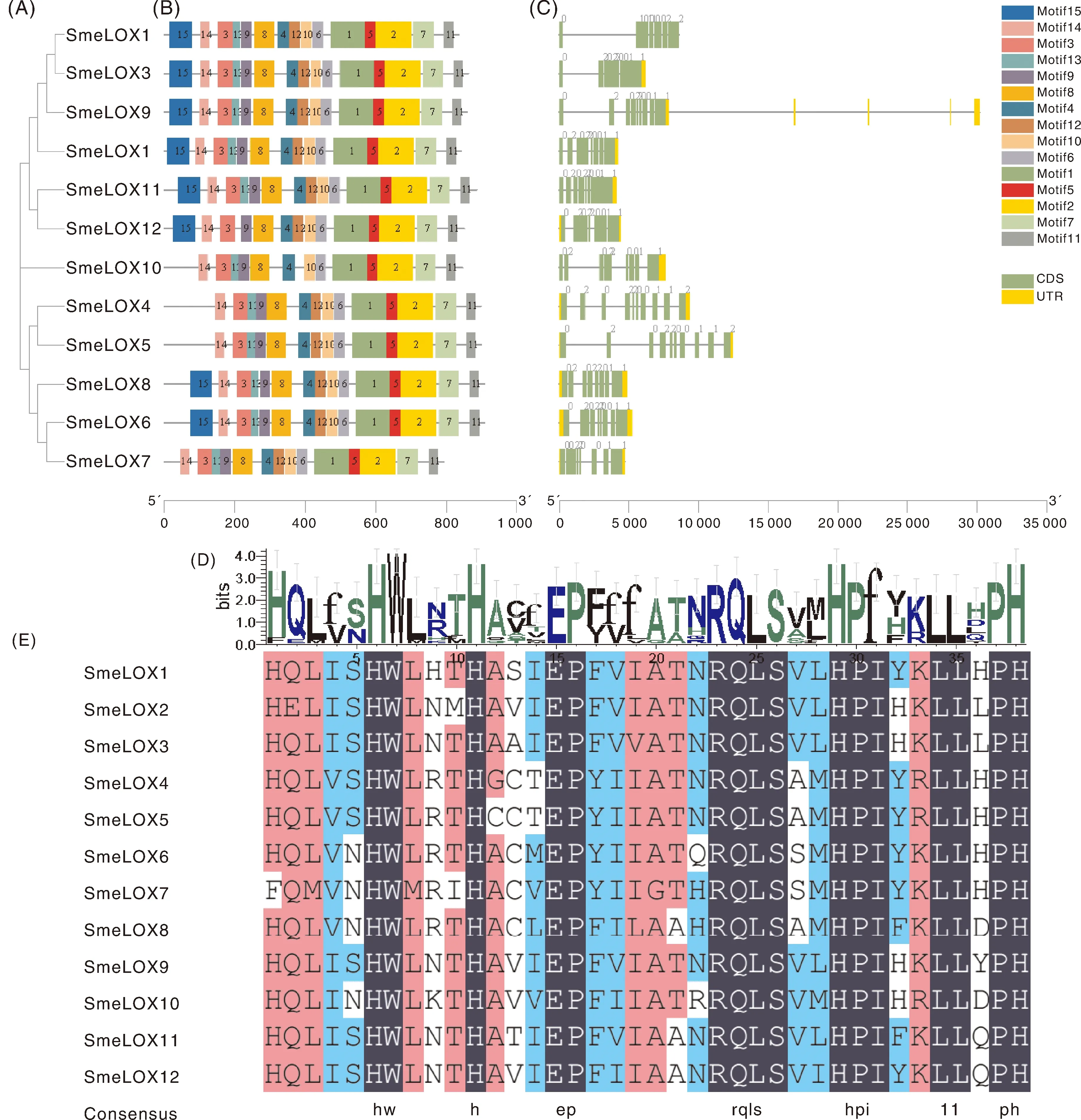
A,茄子SmeLOX蛋白系统发育树;B,茄子SmeLOX基因的内含子和外显子结构图;C,SmeLOX蛋白保守基序的示意图;D,茄子SmeLOX蛋白具有的38个氨基酸残基的保守基序;E,茄子SmeLOX蛋白保守基序的序列比对。A,Phylogenetic tree of SmeLOX proteins;B,Exon-intron structures of SmeLOX gene; C,Schematic representation of the conserved motifs in SmeLOX protein; D,A 38-residue sequence motif of SmeLOX protein;E,Alignment of a 38-residue conserved motif of SmeLOX protein.图4 茄子SmeLOX家族基因和蛋白结构分析Fig.4 Analyses of structure of SmeLOX family genes and proteins inSolanum melongena
为了深入了解茄子中LOX家族的潜在功能和多样性,对LOX家族蛋白序列的保守性进行了分析。如图4-C所示,茄子LOX家族蛋白有15个保守的motif,在这15个motif中,有12个motif(motif 1~11和14)广泛存在于每一个茄子的LOX蛋白中。其中,motif 1是LOX蛋白的典型结构域,是由38个氨基酸组成的富含组氨酸的结构(His-(X)4-His-(X)4-His-(X)17-His-(X)8-His),在茄子SmeLOX蛋白中高度保守(图4-D和E)。
2.5 茄子LOX家族基因的表达模式
为了阐明茄子LOX家族基因的表达模式,采用qRT-PCR的方法对茄子12个SmeLOX基因在茄子5种组织(根、茎、叶、花、果实)中的表达模式进行了分析。结果(表3)显示,除SmeLOX2和SmeLOX7基因在茎秆中不表达,SmeLOX3基因在根和花中不表达,SmeLOX5和SmeLOX9基因在根中不表达,SmeLOX10基因在花中不表达,SmeLOX11基因在果实中不表达,SmeLOX12基因在根和花中不表达外,其余4个SmeLOX基因在茄子5种组织中均有表达。其中,SmeLOX1和SmeLOX4基因在茄子花和果实中的相对表达量高于根等其他组织,SmeLOX6基因在根中的表达量高于花等其他组织;SmeLOX8基因在花、茎秆和果实中均有较高表达。

表3 qRT-PCR分析SmeLOX家族基因在茄子不同组织部位的相对表达水平
3 结论与讨论
LOX家族蛋白在植物的生长发育、逆境胁迫和病菌防御等过程中具有重要作用,尽管其在拟南芥、番茄、黄瓜等植物中已经被鉴定;但在茄子中,LOX家族基因尚未被鉴定和分类。本研究基于茄子“HQ-1315”参考基因组数据,采用生物信息学分析方法,对茄子中的LOX家族基因成员个数、染色体定位情况、基因的结构与保守结构域进行了分析。同时,采用qRT-PCR测定了茄子不同组织中SmeLOX基因的相对表达量。
本研究在茄子中共鉴定出12个SmeLOX基因,数量大于大麦(7)、水稻(10)、玉米(2)等粮食作物[22-23],以及辣椒(8)、马铃薯(5)和番茄(5)等茄科植物[24-26]。氨基酸序列比对和系统发育树结果显示,茄子LOX家族被分为9-LOX和13-LOX两个亚家族。与前人报道的类似;根据LOX氨基酸序列相似性和有无叶绿体运输多肽,茄子13-LOX亚家族又被进一步分为Type I 13-LOX和Type II 13-LOX;有6个SmeLOX属于9-LOX亚家族,1个SmeLOX属于Type I 13-LOX亚家族,5个SmeLOX属于Type II 13-LOX亚家族。进一步分析发现,LOX家族蛋白在单双子叶植物中存在不同的进化模式。系统发育树中9-LOX亚家族中单子叶和双子叶植物的LOX蛋白形成单独的进化枝,Type I 13-LOX亚家族LOX蛋白的进化枝中仅含有双子叶植物,表明Type I 13-LOX亚家族LOX蛋白可能是在双子叶植物分化后进化产生的,而9-LOX和Type Ⅱ 13-LOX亚家族可能在单、双子叶植物分化之前已经存在。
有报道表明,脂氧合酶富含组氨酸(His)残基的保守基序[His-(X)4-His-(X)4-His-(X)17-His-(X)8-His],其对脂肪酸氧和酶的稳定性和活性具有重要影响[27]。SmeLOX家族的蛋白结构分析结果表明,茄子SmeLOX蛋白均具有此保守基序,与前人报道一致。植物LOX催化细胞膜脂的过氧化反应产生的氢过氧化物和含氧自由基等多种物质,可参与细胞内的多种信号传导,对植物抵御环境胁迫起着重要调节作用[28]。研究表明,植物中LOX活性在受到极端天气、病原菌、高温和机械损伤等多种非生物和生物胁迫下会显著升高,从而增强对逆境胁迫的抗性[4]。系统进化树分析结果表明,茄子LOX家族蛋白可能在生物和非生物胁迫过程中发挥着重要作用。系统进化树中,SmeLOX4和SmeLOX5蛋白与番茄LeLOX4、马铃薯StLOX4、烟草NaLOX3亲缘关系十分相近,而这几个蛋白均被报道参与植物对病原菌等生物胁迫的防御反应[29-30]。杨树中PtLOX12和PtLOX14基因的表达受茉莉酸甲酯的诱导[31],茄子中SmeLOX6和SmeLOX7蛋白与PtLOX12和PtLOX14蛋白亲缘关系较近,推测SmeLOX6和SmeLOX7可能在植物抗病中起重要作用。此外,SmeLOX10与13-LOX亚家族中茄子的其他SmeLOX蛋白亲缘关系较远,推测SmeLOX10蛋白可能在茄子中具有独特的功能。
LOX家族基因在植物不同组织中的表达存在显著差异,例如,黄瓜中有3个LOX基因在根中的表达量比其他组织高[15],甜瓜中CmLOX15仅在生殖器官中表达[32]。本研究中,SmLOX基因在茄子不同组织的表达量也存在显著差异,表明茄子LOX家族基因可能参与茄子不同器官组织的发育过程。
参考文献(References):
[1] BRASH A R. Lipoxygenases: occurrence,functions,catalysis,and acquisition of substrate[J].TheJournalofBiologicalChemistry,1999,274(34): 23679-23682.
[2] LIAVONCHANKA A,FEUSSNER I. Lipoxygenases: occurrence,functions and catalysis[J].JournalofPlantPhysiology,2006,163(3): 348-357.
[3] ANDREOU A,FEUSSNER I. Lipoxygenases: structure and reaction mechanism[J].Phytochemistry,2009,70(13/14): 1504-1510.
[4] 曹嵩晓,张冲,汤雨凡,等. 植物脂氧合酶蛋白特性及其在果实成熟衰老和逆境胁迫中的作用[J]. 植物生理学报,2014,50(8): 1096-1108.
CAO S X,ZHANG C,TANG Y F,et al. Protein characteristic of the plant lipoxygenase and the function on fruit ripening and senescence and adversity stress[J].PlantPhysiologyJournal,2014,50(8): 1096-1108.(in Chinese with English abstract)
[6] MELAN M A,DONG X,ENDARA M E,et al. AnArabidopsisthalianalipoxygenase gene can be induced by pathogens,abscisic acid,and methyl jasmonate[J].PlantPhysiology,1993,101(2): 441-450.
[7] BELL E,CREELMAN R A,MULLET J E. A chloroplast lipoxygenase is required for wound-induced jasmonic acid accumulation inArabidopsis[J].ProceedingsoftheNationalAcademyofSciences,1995,92(19): 8675-8679.
[8] CHAUVIN A,CALDELARI D,WOLFENDER J L,et al. Four 13-lipoxygenases contribute to rapid jasmonate synthesis in woundedArabidopsisthalianaleaves: a role for lipoxygenase 6 in responses to long-distance wound signals[J].NewPhytologist,2013,197(2): 566-575.
[9] FERRIE B J,BEAUDOIN N,BURKHART W,et al. The cloning of two tomato lipoxygenase genes and their differential expression during fruit ripening[J].PlantPhysiology,1994,106(1): 109-118.
[10] GRIFFITHS A,BARRY C,ALPUCHE-SOLIS A G,et al. Ethylene and developmental signals regulate expression of lipoxygenase genes during tomato fruit ripening[J].JournalofExperimentalBotany,1999,50(335): 793-798.
[11] HEITZ T,BERGEY D R,RYAN C A. A gene encoding a chloroplast-targeted lipoxygenase in tomato leaves is transiently induced by wounding,systemin,and methyl jasmonate[J].PlantPhysiology,1997,114(3): 1085-1093.
[12] CHEN G P,HACKETT R,WALKER D,et al. Identification of a specific isoform of tomato lipoxygenase (TomloxC) involved in the generation of fatty acid-derived flavor compounds[J].PlantPhysiology,2004,136(1): 2641-2651.
[13] HU T Z,HU Z L,ZENG H,et al. Tomato lipoxygenase D involved in the biosynthesis of jasmonic acid and tolerance to abiotic and biotic stress in tomato[J].PlantBiotechnologyReports,2015,9(1): 37-45.
[14] MARIUTTO M,DUBY F,ADAM A,et al. The elicitation of a systemic resistance byPseudomonasputidaBTP1 in tomato involves the stimulation of two lipoxygenase isoforms[J].BMCPlantBiology,2011,11: 29.
[15] LIU S Q,LIU X H,JIANG L W. Genome-wide identification,phylogeny and expression analysis of the lipoxygenase gene family in cucumber[J].GeneticsandMolecularResearch,2011,10(4): 2613-2636.
[16] YANG X Y,JIANG W J,YU H J. The expression profiling of the lipoxygenase (LOX) family genes during fruit development,abiotic stress and hormonal treatments in cucumber (CucumissativusL.)[J].InternationalJournalofMolecularSciences,2012,13(2): 2481-2500.
[17] WANG J L,HU T H,WANG W H,et al. Bioinformatics analysis of the lipoxygenase gene family in radish (Raphanussativus) and functional characterization in response to abiotic and biotic stresses[J].InternationalJournalofMolecularSciences,2019,20(23): E6095.
[18] WEI Q Z,WANG J L,WANG W H,et al. A high-quality chromosome-level genome assembly reveals genetics for important traits in eggplant[J].HorticultureResearch,2020,7: 153.
[19] 赵国富,魏庆镇,汪精磊,等. 萝卜(Raphanussativus)Dof基因家族全基因组鉴定分析[J]. 分子植物育种,2019,17(23): 7683-7691.
ZHAO G F,WEI Q Z,WANG J L,et al. Genome-wide identification and analysis of the Dof gene family in radish(Raphanussativus)[J].MolecularPlantBreeding,2019,17(23): 7683-7691.(in Chinese with English abstract)
[20] CHEN C J,CHEN H,ZHANG Y,et al. TBtools,a toolkit for biologists integrating various HTS-data handling tools with a user-friendly interface[J].MolecularPlant,2020,13(8): 1194-1202.
[21] LIVAK K J,SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J].Methods,2001,25(4): 402-408.
[22] UMATE P. Genome-wide analysis of lipoxygenase gene family inArabidopsisand rice[J].PlantSignaling&Behavior,2011,6(3): 335-338.
[23] OGUNOLA O F,HAWKINS L K,MYLROIE E,et al. Characterization of the maize lipoxygenase gene family in relation to aflatoxin accumulation resistance[J].PLoSOne,2017,12(7): e0181265.
[24] SARDE S J,KUMAR A,REMME R N,et al. Genome-wide identification,classification and expression of lipoxygenase gene family in pepper[J].PlantMolecularBiology,2018,98(4/5): 375-387.
[25] ROYO J,VANCANNEYT G,PÉREZ A G,et al. Characterization of three potato lipoxygenases with distinct enzymatic activities and different organ-specific and wound-regulated expression patterns[J].JournalofBiologicalChemistry,1996,271(35): 21012-21019.
[26] 宋辉,赵术珍,侯蕾,等. 野生花生全基因组抗病相关LOX基因的生物信息学分析[J]. 山东农业科学,2015,47(10): 1-7.
SONG H,ZHAO S Z,HOU L,et al. Bioinformatics analysis onLOXgenes related to disease resistance in whole genome ofArachisduranensisandArachisipaёnsis[J].ShandongAgriculturalSciences,2015,47(10): 1-7.(in Chinese with English abstract)
[27] MINOR W,STECZKO J,STEC B,et al. Crystal structure of soybean lipoxygenase L-1 at 1.4 Å resolution[J].Biochemistry,1996,35(33): 10687-10701.
[28] 沙伟,任巍巍,马天意. 脂氧合酶基因在植物中的研究进展[J]. 分子植物育种,2019,17(24): 8102-8107.
SHA W,REN W W,MA T Y. Research advances of lipoxygenase genes in plants[J].MolecularPlantBreeding,2019,17(24): 8102-8107.(in Chinese with English abstract)
[29] HALITSCHKE R,BALDWIN I T. AntisenseLOXexpression increases herbivore performance by decreasing defense responses and inhibiting growth-related transcriptional reorganization inNicotianaattenuata[J].ThePlantJournal,2003,36(6): 794-807.
[30] ALLMANN S,HALITSCHKE R,SCHUURINK R C,et al. Oxylipin channelling inNicotianaattenuata: lipoxygenase 2 supplies substrates for green leaf volatile production[J].Plant,Cell&Environment,2010,33(12): 2028-2040.
[31] 陈竹. 杨树脂氧合酶(LOX)家族的全基因组分析及PtLOX11基因的功能研究[D]. 合肥: 安徽农业大学,2017.
CHEN Z. Genome-wide identification of lipoxygenase gene family in poplar and function analysis ofPtLOX11[D]. Hefei: Anhui Agricultural University,2017. (in Chinese with English abstract)
[32] 张冲. 甜瓜脂氧合酶基因家族成员鉴定、表达调控及CmLOX8在果实香气合成中的作用[D]. 沈阳: 沈阳农业大学,2016.
ZHANG C. Identification,expression and regulation of lipoxygenase gene family in melon (Cucumismelovar.makuwaMakino) and the role ofCmLOX18 in synthesis of fruit aroma volatiles[D]. Shenyang: Shenyang Agricultural University,2016. (in Chinese with English abstract)

