miR-449b表达对慢性乙型肝炎合并肝细胞癌患者预后的影响
梁伊乐 胡新俊△ 岳 峰 徐 芸
1.河南科技大学第一附属医院感染科 (河南 洛阳,471000) 2.郑州大学第一附属医院消化内科
miRNA是18~25个核苷酸组成的小RNA分子,通过掺入RNA诱导的沉默复合物充当基因表达的调节剂。掺入的miRNA与miRNA互补的mRNA序列结合后,使mRNA链切割,从而导致目标转录物降解,使基因沉默[1]。通过这种转录过程,miRNA可以影响基因表达,从而调节各种生物学过程,包括肿瘤发生、进展、侵袭和转移[2]。已有研究证实,miRNA在肝癌发生和转移的细胞过程中起作用[3]。虽然原发性肝细胞癌(HCC)的治疗和诊断取得较大进步,但5年生存率仍较低[4]。了解miRNA在HCC中作用对寻找临床标志物、治疗靶点能提供有效帮助,既往研究已经证实miR-449b的表达与HCC转移和进展有关[5],但miR-449b的表达与慢性乙型肝炎(CHB)合并HCC患者预后关系尚不清楚,本研究对此进行观察,为临床早期预测预后提供帮助。
1 资料与方法
1.1 研究对象 选取2014年1月至2018年1月在河南科技大学第一附属医院治疗的100例CHB合并HCC患者为观察组,选取同期40例CHB患者作为对照组。观察组男52例,女48例;年龄37~78岁,平均(54.5±6.4)岁,乙型肝炎家族史17例,病毒载量(25.6±7.8)IU/ml,HBeAg阳性29例。对照组男21例,女19例;年龄36~79岁,平均(54.9±6.5)岁,乙型肝炎家族史9例,病毒载量(26.3±7.9)IU/ml,HBeAg阳性13例。两组患者年龄、HBeAg阳性、性别、乙型肝炎家族史、病毒载量差异无统计学意义(P>0.05),该研究符合我院伦理委员会要求。
1.2 纳入排除标准 纳入标准:①经病理学和影像学资料确诊为HCC;②年龄>18岁;③资料完整;④签署研究同意书;⑤均为慢性HBV感染;⑥既往无接受其他癌症相关治疗。排除标准:①合并其他恶性肿瘤、严重心脑内科疾病、复发转移性肝细胞癌、精神疾病、免疫性肝病、丙型肝炎、酒精性及非酒精性肝病、肿瘤家族史、血吸虫病性肝病;②正在参与其他研究;③预期生存时间较短(<3个月)。
1.3 检测方法
1.3.1 患者外周血miR-449b检测 将采集肘静脉血约5 ml,置入分离胶真空管中,3 500 r/min离心10~15 min,取上清液,采用miRNA分离试剂盒(北京百奥莱博生物科技有限公司)分离外周血miRNA。用NanoDrop1000分光光度计对RNA浓度及纯度进行测量,A260/A280为1.8~2.0为合格。使用实时荧光定量聚合酶链反应(qRT-PCR)对两组患者外周血中miR-449b水平进行检测。根据miScrptⅡreverse transcription kit(德国Qiagen公司)说明书进行逆转录,miR-449b引物及内参U6引物由上海生工生物合成。PCR反应条件:95℃ 10 min,95℃ 15 s,60℃ 1 min,共45个循环。miR-449b表达用2-△△CT法计算。
1.3.2 患者外周血HBV DNA病毒载量检测 用Roche COBAS Taqman试剂盒检测外周血中HBV DNA病毒载量,检测下限为20 IU/ml。高病毒载量为>20 IU/ml。
1.4 患者随访方法 自患者入院开始对CHB合并HCC患者进行随访,包括上门、查找病例、电话及门诊随访等方式,每3个月1次,随访终点为死亡,截止时间为2020年1月,观察总生存期(OS),即截止时间或死亡时间减去入院时间。
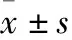
2 结果
2.1 两组患者外周血miR-449b表达 合并HCC组外周血miR-449b表达水平为(0.27±0.10),低于对照组(0.64±0.10),差异有统计学意义(P<0.05)。
2.2 miR-449b表达与病毒载量及临床病理资料关系 以外周血miR-449b表达量中位数0.40将患者分为两组:miR-449b表达增高组(≥0.40,50例)、miR-449b表达降低组(<0.40,50例)。miR-449b表达与病毒载量、TNM分期、Chid-Pugh分级具有相关性(P<0.05)。见表1。
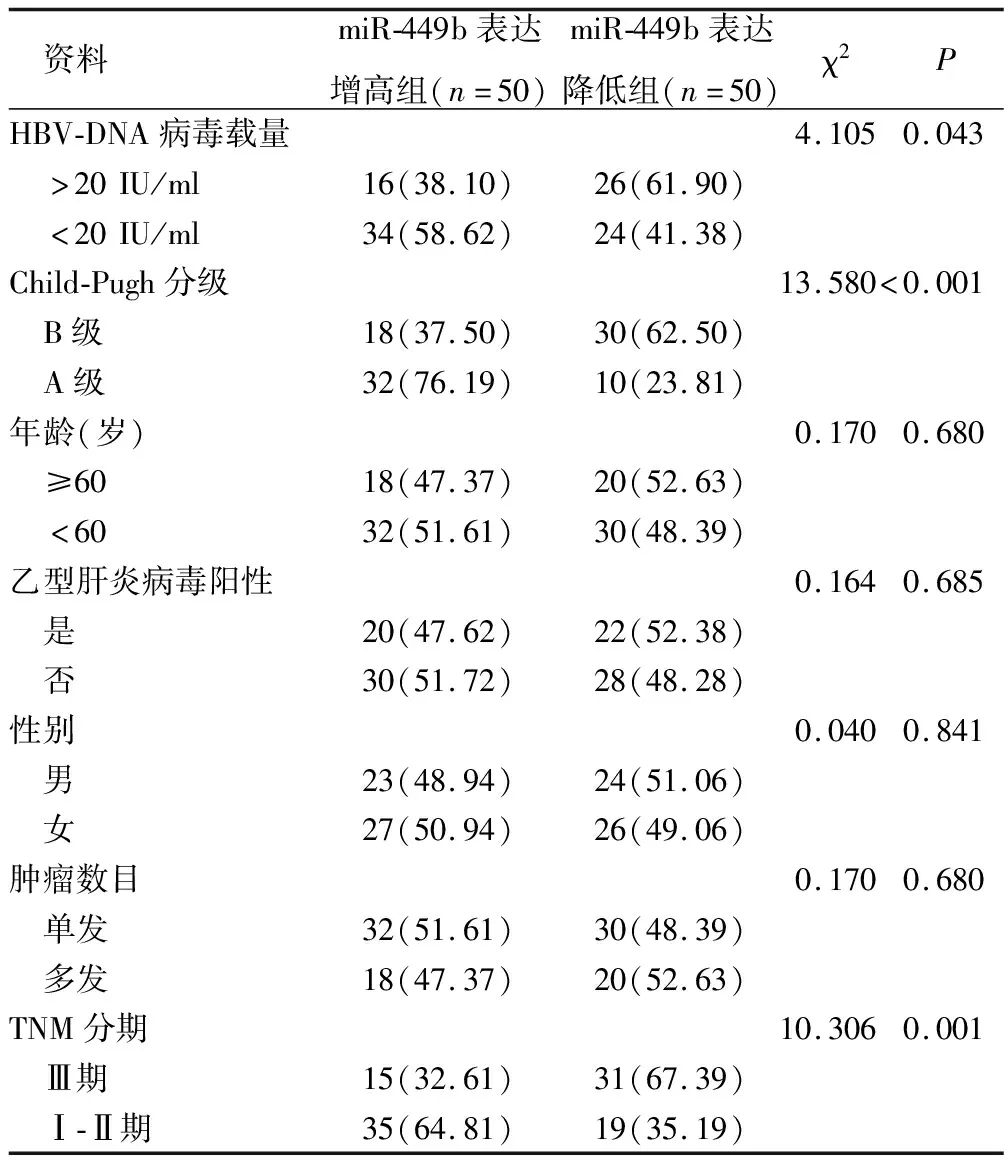
表1 患者临床资料在miR-449b不同表达组的组间比较 [例(%)]
2.3 患者外周血miR-449b表达量与OS关系分析 观察组共91例获得随访,9例失访,成功随访率91.0%,随访时间24~72个月,平均(49.9±7.9)个月,中位随访时间为50个月,患者死亡51例。miR-449b表达增高组2年死亡率为15.91%(7/44),miR-449b表达降低组2年死亡率为38.30%(18/47),组间差异有统计学意义(χ2=5.717,P=0.017)。Kaplan-Meier联合Log-rank检验提示,miR-449b表达降低组OS短于miR-449b表达升高组(P<0.05),见图1。年龄、Chid-Pugh分级、TNM分期、病毒载量与OS具有相关性(P<0.05),见表2。Cox分析结果显示,miR-449b表达、年龄、TNM分期、病毒载量是CHB合并HCC OS的独立影响因素(P<0.05),见表3。
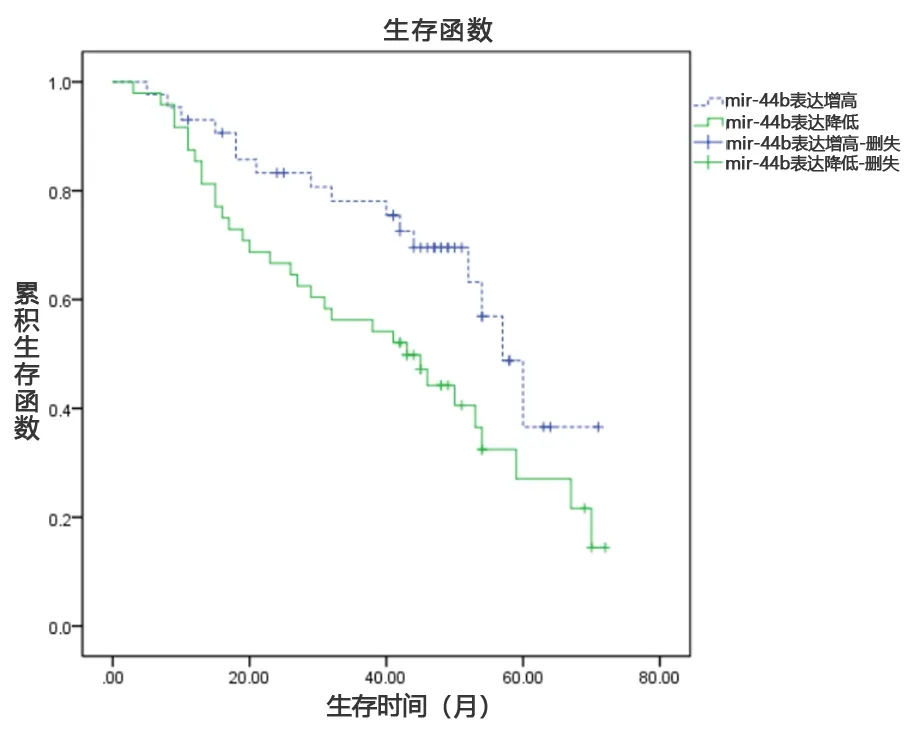
图1 miR-449b表达升高和降低患者的OS曲线
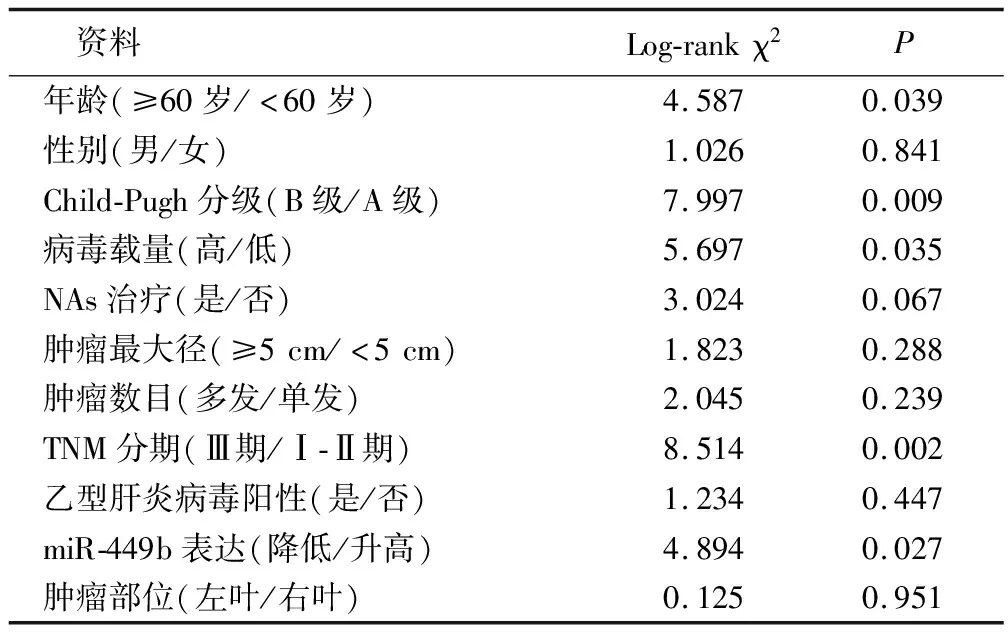
表2 CHB合并HCC患者OS的单因素分析
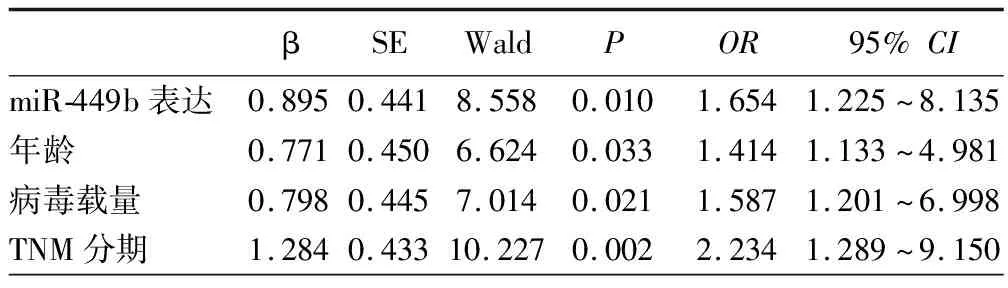
表3 HCC患者OS的多因素分析
3 讨论
HCC是世界范围内较为常见的恶性肿瘤,具有发病率高、发病年轻化、进展快、治疗敏感性低、生存期短等特点,尤其是CHB合并HCC预后更差,治疗难度更高[6,7]。虽然HCC诊断及治疗水平提高,但仍缺乏有效治疗靶点及预后标志物。目前研究已经证实多种miRNA与HCC发生及进展有关,miR-449b表达下调与肿瘤不良预后相关,但在CHB合并HCC预后中尚未见报道[8,9]。
miR-449b下调被证实与鼻咽癌、非小细胞肺癌等较差预后显著相关,miR449b可能具有抑制肿瘤的作用[10,11]。研究显示,miR-449b在肝癌中具有靶基因特征,可通过抑制癌基因SOX4表达,从而抑制肝癌细胞死亡和迁移[5];也可靶向β-catenin和Wnt信号传导,从而抑制肝母细胞瘤生长[12,13]。
本研究显示,CHB合并HCC患者外周血miR-449b表达下调,与既往研究结果相符[14]。miR-449b表达增高组患者2年死亡率显著低于miR-449b表达降低组,且OS显著高于后者,提示miR-449b表达降低的CHB合并HCC患者死亡率高,预后差。本研究表明miR-449b表达与病毒载量、TNM分期、Child-Pugh分级具有相关性,miR-449b表达升高患者病毒载量低、TNM分期低、Child-Pugh分级A级的比例更高,提示miR-449b可能通过降低肿瘤分期抑制肿瘤进展,但机制尚不明确。本研究显示,外周血中miR-449b表达下调是CHB合并HCCOS的独立危险因素,提示临床可通过早期检测外周血中miR-449b来早期判断预后,从而指导临床治疗。本研究还表明病毒载量是CHB合并HCC预后的影响因素,与既往研究结果相符[15]。

