根肿病生防放线菌B18发酵条件的研究
蒋欢 唐贵婷 吴朝君 张勇 彭玉梅 苏宇 赵冰峰 王旭祎

摘要 :B18是一株對十字花科根肿病菌Plasmodiophora brassicae具有抑制作用的优良生防放线菌,其活菌以及发酵液都可抑制根肿病菌休眠孢子萌发。为提高其菌体量以及孢子萌发抑制率,本文以菌体生物量和发酵液抑制根肿病菌休眠孢子活性为指标,通过单因素试验和正交设计优化B18的发酵培养基组分以及培养条件。结果表明:B18最适发酵培养基(1L)为蔗糖20 g,大豆粉10 g,牛肉膏5 g,NaCl 2.5 g,CaCO32.0 g;且在初始pH 7.0,初始接种量3%~7%,装瓶量150 mL/250 mL,温度25~30℃,150~200 r/min下发酵 72 h 所得的发酵液对孢子萌发抑制率最高且菌体量最大。随后测定了发酵条件优化后的B18发酵液的热、酸碱、紫外线以及储藏稳定性。结果表明:B18发酵产物的热稳定性较差,40℃以上其抑菌活性随着温度的升高而降低;发酵液在酸性、中性以及弱碱性条件下稳定性较好,在强碱性条件下稳定性变差;发酵液对紫外线不敏感,有较好的稳定性;发酵液在4℃条件下更稳定,30 d时孢子萌发抑制率仍可达到61.58%,常温条件下不稳定,15 d后抑制率明显降低。
关键词 :根肿菌; 生防菌B18; 榨菜; 发酵条件; 发酵液
中图分类号:
S 436.344
文献标识码: A
DOI: 10.16688/j.zwbh.2020070
A study of cultural conditions for biocontrol actinomycetes
strain B18 against clubroot disease
JIANG Huan, TANG Guiting, WU Chaojun, ZHANG Yong, PENG Yumei,
SU Yu, ZHAO Bingfeng, WANG Xuyi*
(1. Southeast Chongqing Academy of Agricultural Sciences, Fuling 408099, China)
Abstract
Antagonistic Zhihengliuella aestuarii B18 is an excellent biocontrol actinomycetes which can inhibit Plasmodiophora brassicae. The living bacteria and fermentation broth can inhibit the germination of dormant spores. In order to increase the biomass and the inhibition rate of B18, the biomass and the inhibitory activity of fermentation liquid against resting spores of rhizopus were used as indicators, and the media and cultural conditions of strain B18 were optimized by single factor tests and orthogonal design. The results showed that the optimum fermentation medium(1L) for B18 included 20 g sucrose, 10 g soybean powder, 5 g beef extract, 2.5 g NaCl and 2.0 g CaCO3. When fermented at 25-30℃ and 150-200 r/min for 72 h, with an initial pH 7.0, initial inoculum amount of 3%-7% and a medium volume of 150 mL in 250 mL flask, the largest volume of B18 and the highest inhibition rate could be achieved. The heat, acid, alkali, ultraviolet and storage stability of B18 fermentation broth were determined. The results showed that the thermal stability of B18 fermentation products was poor; the bacteriostatic activity decreased with increasing temperature after 40℃; the stability of fermentation broth under acidic, neutral and weak alkaline conditions was better; the stability of fermentation broth became worse under strong alkaline conditions; the fermentation broth was insensitive to ultraviolet light and had a strong UV stability; the fermentation broth was more stable under 4℃ conditions, and the inhibition rate could reach 61.58% 30 d after storage, unstable at room temperature and decreased obviously after 15 d.
Key words
Plasmodiophora brassicae; antagonistic actinomycetes strain B18; mustard; fermentation conditions;fermentation broth
十字花科根肿病俗称根癌病,是由芸薹根肿菌Plasmodiophora brassicae Woron. 引起的十字花科作物的土传病害,现全世界均有分布[1]。在中国,根肿病常年危害面积占十字花科作物种植面积的 1/3以上,平均产量损失达 20%~30%,发病严重田块产量损失可达 60%以上,有的甚至绝收[24]。根肿病菌是一种专性寄生菌,不可人工培养,其休眠孢子可以在土壤中存活20年以上[5],其寄主范围广,可危害榨菜、油菜、大白菜、甘蓝、芥菜、萝卜和板蓝根等多种栽培以及野生的十字花科作物[610]。
国内外已针对该病原菌进行了大量防治技术的研究,包括抗病品种选育[11]、农业和化学防治[1213]、生物防治[1415]等,其中生物防治因具有对人畜安全,环境兼容性好且病菌不易产生抗药性等优点而被重视并初见成效。本团队在对榨菜根肿病的生物防治前期研究中,从榨菜根际土壤中筛选出一株对榨菜根肿病防治效果良好的菌株B18。通过形态特征、生理生化特征、16S rDNA序列、DNA-DNA杂交,保守基因比对等鉴定方法,得到菌株B18的16S rDNA序列与模式菌株刘志恒属Zhihengliuella aestuarii DY66T (EU939716)的相似度为100%,大于97%;与刘志恒属菌落杂交相似度为76.4%,大于70%,综合各项指标,将B18归类为刘志恒菌属Zhihengliuella aestuarii。目前关于刘志恒属菌的报道较少,在潮汐沉淀物中曾分离得到该属放线菌[16]。但目前还没有刘志恒属菌作为生防菌的报道。该属菌的生防机制目前还不清楚,抑制根肿病菌休眠孢子萌发可能是其主要的生防机制。在温室和田间试验中,使用B18菌液的防治效果最好,离心后的上清液效果次之,菌沉淀效果最差。因此可能是B18的代谢产物和菌体同时发挥了生防作用。我们在前期研究中对B18做了全基因组测序,测序结果表明,B18含有抗生素万古霉素和链霉素合成基因,以及几丁质酶和葡聚糖酶等降解细胞壁的酶基因,这些数据都很好地解释了B18的生防功能,所以该菌具有良好的生防产品应用开发前景。
为进一步提高B18的生防效果,本文以菌体生物量和发酵液对根肿病菌休眠孢子的抑制率(后文简称孢子萌发抑制率)为指标,应用单因素以及正交试验设计对B18的发酵培养基组分和发酵条件进行筛选,确定其最适培养基组分、各组分的最佳组合和最佳组合下的最适培养条件,以期能提高菌株对根肿病菌休眠孢子萌发的抑制率,并为其在生产中的应用奠定基础。
生防菌发酵产物施用后,会受到阳光、温度、土壤的酸碱性等各种因素的影响,本文将对B18培养基组分及培养条件优化后的发酵液进行UV稳定性、热稳定性、酸碱稳定性以及储藏稳定性测定,作为评价B18发酵液是否具有应用开发价值的参考指标之一。
1 材料与方法
1.1 供试材料
供试榨菜‘涪杂5号,为本单位自制杂交品种。根肿病生防放线菌菌株B18为本团队从榨菜根际土壤中筛选出对榨菜根肿病防治效果良好的菌株;榨菜根肿病菌(未进行单孢分离)采自重庆市渝东南农业科学院根肿病试验田,均放置冰箱-20℃保存备用。
初始发酵培养基为豆粉液体培养基:大豆粉10.0 g,葡萄糖10.0 g,NaCl 2.5 g,蛋白胨 3.0 g,CaCO32.0 g,蒸馏水1 000 mL,pH 7.2~7.4。
NA固体培养基:蛋白胨10.0 g,牛肉膏3.0 g,NaCl 5.0 g,琼脂粉15.0~18.0 g,蒸馏水1 000 mL,pH 7.0。
1.2 試验方法
1.2.1 种子液制备
B18接入NA培养基平板上进行活化,30℃条件下培养72 h。再将活化的菌株接入豆粉液体培养液中,180 r/min,30℃条件下振荡培养48 h,得到的培养液即为种子液。
1.2.2 发酵液制备
将种子液以1%的量接入豆粉液体培养基中,180 r/min,30℃下振荡培养3 d,6 000 r/min离心5 min,收集上清液即为B18发酵液。
1.2.3 拮抗活性测定
1.2.3.1 根分泌物的收集
将榨菜种子在24℃条件下催芽2 d,播种在盛有100 mL 1/2 Hoagland营养液的100 mL小烧杯中的纱布上(纱布用橡皮筋固定在小烧杯杯口且与液面刚好接触,后续培养过程中需要每天观察,及时添加营养液以保持营养液体积不变),每杯播20粒,在24℃恒温培养箱中(光照16 h,黑暗8 h)光暗交替培养14 d后收集含根分泌物的溶液,0.22 μm细菌过滤器过滤后4℃保存备用,用于休眠孢子萌发试验。
1.2.3.2 根肿菌孢子悬浮液的制备
根肿菌休眠孢子悬浮液的制备参照肖崇刚等[17]和郭向华[18]的方法。
1.2.3.3 根肿菌休眠孢子萌发抑制试验
在15 mL 离心管内进行根肿菌休眠孢子萌发抑制试验。首先将无菌根分泌物溶液和休眠孢子悬浮液(由无菌根分泌物溶液悬浮)混合均匀,休眠孢子终浓度为1.0×108个/mL,混合液 pH 用1 mol/L NaOH调节至6.2。
在无菌条件下将混合液加入15 mL离心管中,无菌根分泌物溶液和休眠孢子囊悬浮液混合液4.5 mL, 生防菌发酵液0.5 mL,空白对照用等量液体培养基代替,每个处理重复3次。所有处理均置于24℃、黑暗条件下培养(每天需振荡离心管2次以分散休眠孢子),于第10天 镜检休眠孢子萌发情况。
1.2.4 B18菌体生物量测定
B18培养液稀释至10-7~10-9后取样100 μL,涂布于NA平板,倒置于恒温培养箱30℃培养36~48 h后进行菌落计数。
1.2.5 最适培养基组分以及培养条件对B18孢子萌发抑制率以及菌体生物量的影响
1.2.5.1 不同碳源对B18孢子萌发抑制率以及菌体生物量的影响
将初始发酵培养基中的碳源依次用10 g/L可溶性淀粉、葡萄糖、蔗糖、麦芽糖、乳糖替换,其他条件保持不变。测定不同碳源条件下的发酵液孢子萌发抑制率以及B18菌体生物量,确定最佳碳源,每个处理3次重复。
1.2.5.2 不同氮源对B18孢子萌发抑制率以及菌体生物量的影响
将初始发酵培养基中的氮源依次用10 g/L的大豆粉、蛋白胨、酵母膏、牛肉膏、硫酸铵,及1%大豆粉+0.3% 蛋白胨、1%大豆粉+0.3%酵母膏、1%大豆粉+0.3%牛肉膏、1%大豆粉+0.3%硫酸铵替换(大豆粉用量为10 g/L,其余氮源用量为3 g/L),其他条件保持不变。测定不同氮源条件下的发酵液孢子萌发抑制率以及B18菌体生物量,确定最佳氮源,每个处理3次重复。
1.2.5.3 无机盐对B18孢子萌发抑制率以及菌体生物量的影响
将初始发酵培养基中的无机盐依次用2.5 g/L K2HPO4、MgSO4·7H2O、NaCl、FeSO4·7H2O、CuSO4·5H2O替换。由于CaCO3在培养基中起调节的作用,液体发酵培养基中往往要加入一定的量,所以需要保持初始发酵培养基中CaCO3的量,其他条件保持不变。测定不同无机盐条件下的发酵液孢子萌发抑制率以及B18菌体生物量,确定最佳无机盐,每个处理3次重复。
1.2.5.4 发酵培养基成分正交试验
以单因子试验筛选出的最佳碳源、氮源、无机盐为变异因素,采用L9(34)正交表进行培养基优化试验,确定培养基各组分的最佳配比。
1.2.5.5 B18 发酵条件优化
对B18发酵时间、温度、初始pH、转速、装液量、初始接菌量等发酵条件进行优化。发酵时间分别为1、2、3、4、5、6、7、8 d;温度分别为10、15、20、25、30、35℃;初始pH分别为5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0;转速分别为60、90、120、150、180、200 r/min;装液量为250 mL三角瓶分别装液30、60、90、120、150、180 mL;初始接菌量分别为装液量的1%、3%、5%、7%、10%、15%。每个处理3次重复,测定各处理条件下发酵液的孢子萌发抑制率以及B18菌体生物量。
1.2.6 发酵液稳定性测定
1.2.6.1 热处理对B18发酵液抑菌效果的影响
将10 mL B18发酵液置于15 mL离心管中于20、40、60、80℃和100℃ 分别处理30 min 和 60 min,3次重复。待自然冷却后以原发酵液为对照测定孢子萌发抑制率。
1.2.6.2 酸碱度变化对B18發酵液抑菌效果的影响
将发酵液用1 mol/L HCl和1 mol/L NaOH分别调整 pH 至3、5、7、9、11和13,静置6 h后,再分别将各发酵液的 pH 慢慢调至7.2,每处理3次重复,测定孢子萌发抑制率。
1.2.6.3 紫外线照射对B18发酵液抑菌效果的影响
在15 mL离心管中加入10 mL B18发酵液后置于30 W紫外灯下(距灯管20 cm)分别照射15、30、45、60、75 min 和 90 min 后测定孢子萌发抑制率。
1.2.6.4 B18发酵液储藏稳定性测定
将B18发酵液置于4℃和常温(重庆涪陵6月日均气温约为白天25~33℃,夜间20~25℃)下,保存1、8、15、22 d 和 30 d 后测定孢子萌发抑制率。
1.3 数据统计与分析
试验数据用DPS软件进行差异显著性分析,用Microsoft Excel软件作图并进行分析。
孢子萌发率=视野下萌发孢子数/视野下总孢子数×100%;
孢子萌发抑制率=(对照组孢子萌发率-处理组孢子萌发率)/对照组孢子萌发率×100%。
2 结果与分析
2.1 发酵培养基成分优化
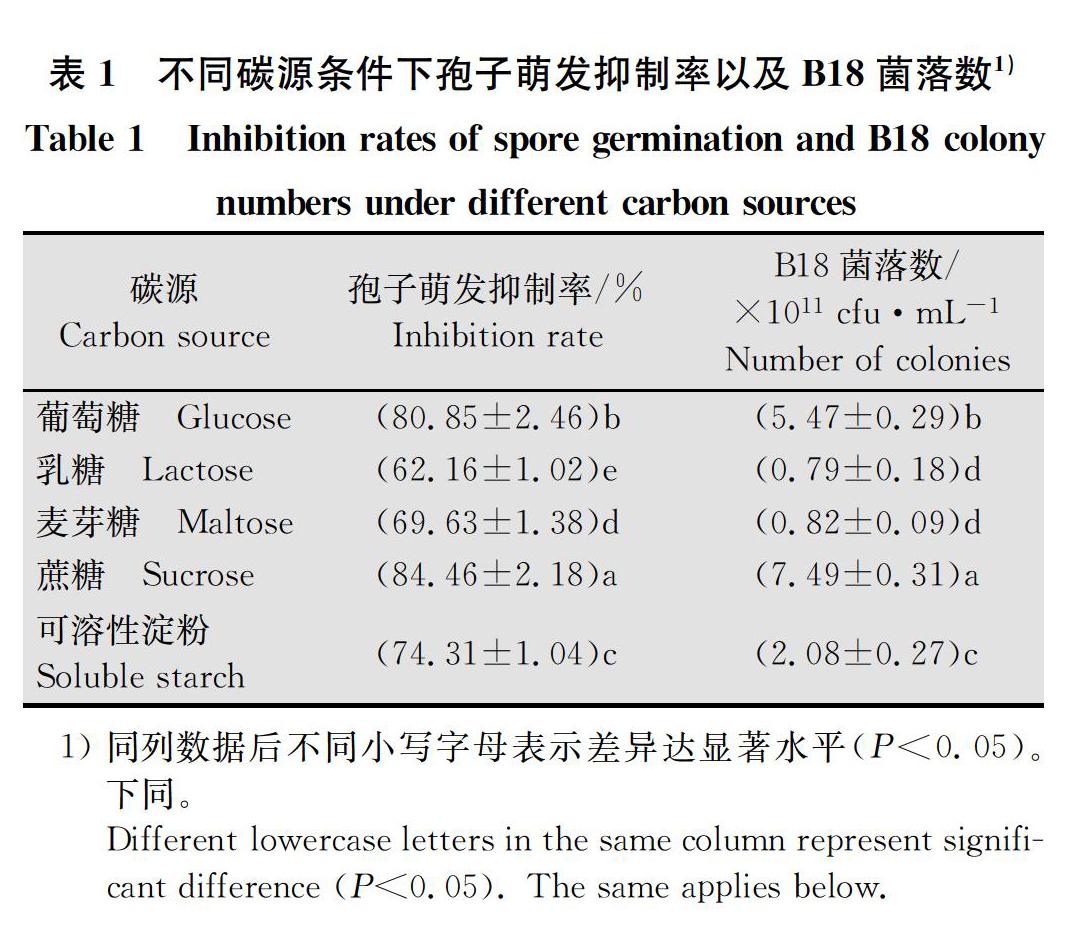
2.1.1 不同碳源条件下孢子萌发抑制率以及B18菌落数测定结果
不同碳源条件下孢子萌发抑制率以及B18菌落数差异显著,多重比较结果(表1)显示,以蔗糖为碳源时孢子萌发抑制率以及B18菌落数最高,分别为84.46%和7.49×1011 cfu/mL,显著高于其他4种碳源;以乳糖为碳源时孢子萌发抑制率以及B18菌落数最低,分别为62.16%和0.79×1011 cfu/mL,显著低于其他4种碳源,但菌落数与麦芽糖为碳源时差异不显著,因此选择蔗糖作为发酵培养基碳源。
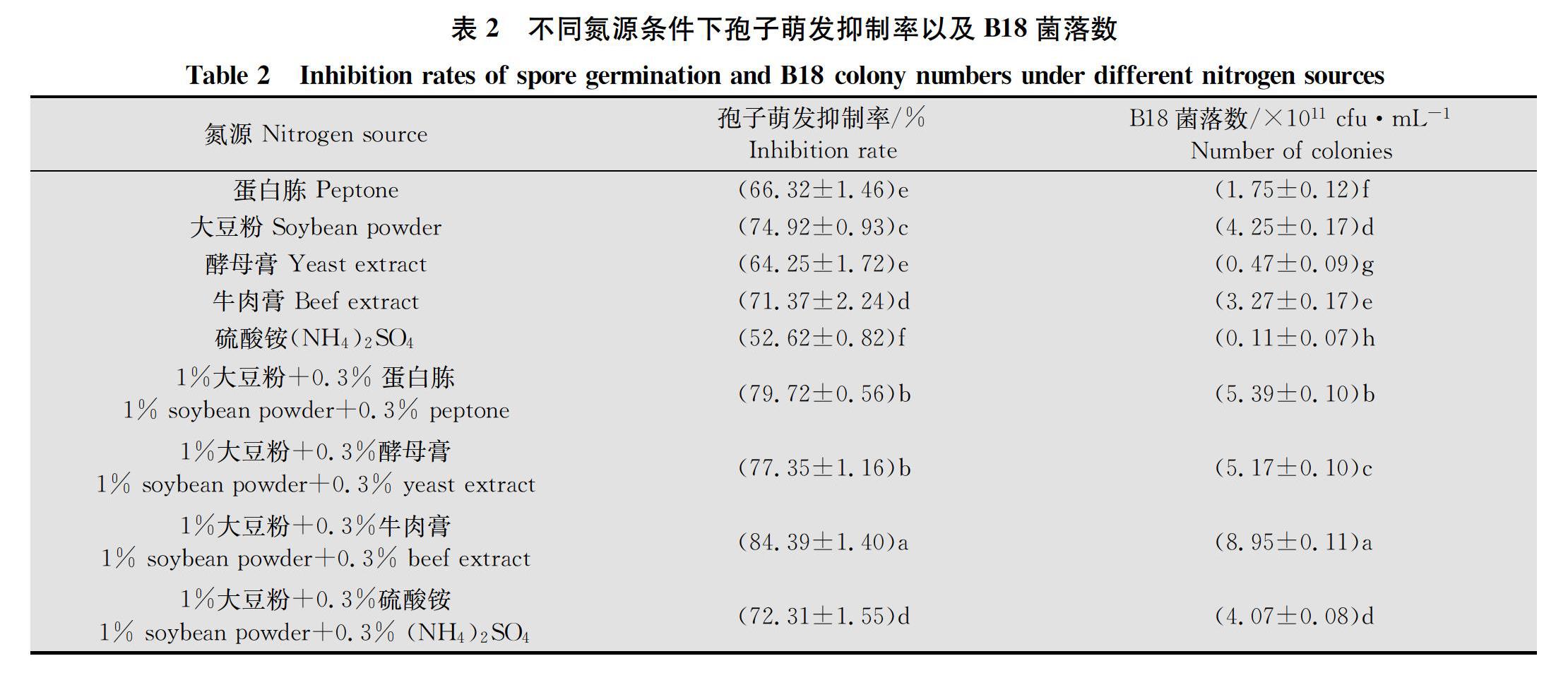
2.1.2 不同氮源条件下孢子萌发抑制率以及B18菌落数测定结果
不同氮源条件下孢子萌发抑制率以及B18菌落数差异显著。多重比较结果(表2)显示,以1%大豆粉+0.3%牛肉膏为氮源时孢子萌发抑制率以及B18菌落数最高,分别为84.39%和8.95×1011 cfu/mL,显著高于其他氮源;以硫酸铵为氮源时孢子萌发抑制率以及B18菌落数最低,分别为52.62%和0.11×1011 cfu/mL,显著低于其他氮源,所以选择1%大豆粉+0.3%牛肉膏作为培养基氮源。
2.1.3 不同无机盐条件下孢子萌发抑制率以及B18菌落数测定结果
不同无机盐条件下孢子萌发抑制率以及B18菌落数差异显著。多重比较结果(表3)显示,以NaCl为无机盐时孢子萌发抑制率以及B18菌落数最高,分别为78.43%和4.25×1011 cfu/mL,显著高于其他4种无机盐;以MgSO4·7H2O、FeSO4·7H2O 和CuSO4·5H2O为无机盐时孢子萌发抑制率以及菌落数均较低,分别为7.56%、12.88%、7.28%,4.97×106、5.15×106、4.92×106cfu/mL,显著低于NaCl和K2HPO4,所以选择NaCl作为培养基无机盐。
2.2 发酵培养基成分正交试验
B18培养基营养成分正交试验设计如表4所示,F检验表明不同营养成分组合对B18发酵液的孢子萌发抑制率存在显著影响,通过极差分析(k)可知,3种因素对菌株抑菌效果的影响依次为蔗糖>大豆粉>牛肉膏。蔗糖作为碳源对孢子萌发抑制率的影响最大。根据均值大小,得出发酵培养基中最佳的因素和水平组合为A3B1C3,即蔗糖20 g/L,大豆粉10 g/L,牛肉膏5 g/L是B18碳氮用量的最佳组合。
1) 各成分列括号内数值代表各因素的值,即1 L培养基中的添加量(单位:g)。
Value in the brackets in the columns of nutrient components represent the content per one liter medium (Unit: g).
选取正交试验中抑菌效果较好的3个组合(A3B1C3、A3B2C1、A3B3C2)测定B18生长情况,结果如表5所示。多重比较结果显示,组合A3B1C3中B18生长最好,菌落数为7.68×1011 cfu/mL,显著高于其他两种组合和NA;NA中B18生长最差,菌落数仅为0.85×1011 cfu/mL,显著低于其他3种组合,所以选择A3B1C3作为B18发酵培养基最佳组合。
2.3 培养条件优化结果
B18在不同发酵条件下孢子萌发抑制率以及菌落数如图1所示,不同初始pH(图1a)下B18孢子萌发抑制率以及菌落数差异显著,在pH 5.0~7.0范围内孢子萌发抑制率和菌落数随 pH 升高而上升,pH超过7.0时随 pH 升高而下降;pH 7.0时孢子萌发抑制率和菌落数最高,显著高于其他pH, pH 5.0时最低,显著低于其他pH;碱性条件下孢子萌发抑制率以及菌落数均优于酸性条件。
不同接种量对B18孢子萌发抑制率以及菌落数影响显著,接种量为15%时,孢子萌发抑制率显著低于其他接种量,菌落数与接种量1%、7%差异不显著,但显著低于其他接种量;接种量为5%时,孢子萌发抑制率最高,显著高于其他接种量,但与3%接种量差异不显著;接种量为3%时,菌落数最多,显著高于其他接种量,但与10%接种量差异不显著;接种量在1%~7%时,孢子萌发抑制率在73.97%~78.69%,接种量为10%、15%时,降至63.47%~66.21%,综合分析选择初始接菌量为3%~7%(图1b)。
不同发酵温度对B18孢子萌发抑制率以及菌落数影响显著,30℃以前孢子萌发抑制率以及菌落数随温度升高而上升,随后随温度升高而下降;30℃时孢子萌发抑制率和菌落数最高,显著高于其他温度,但与25℃时的孢子萌发抑制率差异不显著, 40℃时最低,显著低于其他温度;故选择25~30℃为B18发酵温度(图1c)。
不同转速对B18孢子萌发抑制率以及菌落数影响显著,随转速增大而升高;孢子萌发抑制率在转速为60 r/min时最低,显著低于其他转速,转速为150、180、200 r/min时,差异不显著,但显著高于其他转速;菌落数在转速为60 r/min时最低,显著低于其他转速,转速为180 r/min和200 r/min时,B18菌落数差异不显著,但显著高于其他转速(图1d)。
不同装液量之间B18孢子萌发抑制率差异不显著。装液量为90 mL时,生长最好,菌落数除与150 mL装液量差异不显著外,显著高于其他装液量;装液量为30 mL时生长最差,菌落数显著低于60、90 mL和150 mL,与120 mL和180 mL差异不显著(图1e)。
发酵时间对B18孢子萌发抑制率以及菌落数影响显著,前3 d孢子萌发抑制率以及菌落数随发酵时间延长而升高,3 d后随时间延长逐渐递减,第3天最高,显著高于其他发酵天数,但与第2天差异不显著;第8天孢子萌发抑制率显著低于前5 d,与第6天和第7天差异不显著,菌落数显著低于前6 d,与第7天差异不显著(图1f)。
2.4 B18发酵液稳定性测定结果
2.4.1 热稳定性
温度对B18发酵液孢子萌发抑制率影响显著,40℃以上各温度处理间差异显著,随温度升高孢子萌发抑制率降低,且处理时间越长,孢子萌发抑制率越低,在100℃处理30 min 和 60 min 时,孢子萌发抑制率最低,仅为27.30%和28.79%(图2)。说明B18发酵液热稳定性差。
2.4.2 酸碱稳定性
pH 对B18发酵液孢子萌发抑制率影响显著,pH 7.0时孢子萌发抑制率最高,显著高于其他pH,但与pH 5.0差异不显著;pH 13.0时最低,孢子萌发抑制率显著低于其他pH;发酵液在酸性、中性以及弱碱性(pH 3.0~9.0)条件下,孢子萌发抑制率达到50.09%~72.75%;pH大于9.0的碱性条件下发酵液对孢子萌发抑制率均低于50%(图3)。
2.4.3 紫外线稳定性
紫外线照射对B18发酵液孢子萌发抑制率无显著影响,发酵液对紫外线照射不敏感。在紫外线照射时间15~90 min范围内,孢子萌发抑制率在70.24%~76.17%(图4)。
2.4.4 储藏稳定性
儲藏时间以及温度对B18发酵液稳定性影响显著,发酵液在4℃下较常温下更稳定,孢子萌发抑制率随存放时间延长而缓慢降低,到第30天时抑制率仍可达61.58%;常温下,储藏稳定性差,孢子萌发抑制率随时间延长显著降低,在第22天和第30天时,抑制率分别为40.25%和32.36%,说明菌株的发酵液在低温下储藏更稳定,30 d时仍可达到61.58%的孢子萌发抑制率;常温下不稳定,只能在15 d 之内维持较高的孢子萌发抑制率(图5)。
综上所述,B18发酵液热稳定性差,40℃以上对根肿病菌孢子萌发抑制率降低;在酸性、中性以及弱碱性条件下,发酵液的稳定性较好,强碱性条件下,稳定性差;对紫外线不敏感;4℃低温储藏更稳定,30 d之内孢子萌发抑制率可保持61.58%~78.55%,常温条件下仅在15 d 之内维持较高的孢子萌发抑制率。
3 结论与讨论
根肿病是由根肿病菌侵染引起,最明显的特征是植物根部形成“肿瘤”,故名根肿病。对于该病的防治目前主要还是以化学防治为主,但生物防治由于具有与生态环境相和谐、和可持续发展等特点[19],越来越受重视,目前已有许多关于根肿病生物防治的报道。Lee等[20]从大白菜根际土壤中筛选出3株内生放线菌,对根肿病温室防效分别为58%、33%和42%。Jaschke等[19]筛选出的内生真菌Acremonium alternatum可以有效缓解感病拟南芥根肿病的发生,病情指数降低50%,侵染率降低20%。与正常发病植株相比,A.alternatum接种的宿主肿根小,含有的休眠孢子数少。Li等[21]通过化学诱变剂诱变生防菌株Bacillus subtilis XF-1,获得了4株防治根肿病效果更好的突变株。Zhou等[22]在白菜根际土壤中分离到3株防治根肿病效果良好的抗生素溶杆菌菌株 Lysobacter antibioticus。
众多研究表明,对发酵过程进行科学合理的优化,可以使目标产物的产量得到较大水平的提高。生防菌培养液组分以及培养条件优化后可显著提高菌株的防病效果、菌体生物量[23]以及抑菌活性物质的产量[2426], Kiers等[27]研究发现培养基的组成和配比对菌体生长、抗生素提炼工艺以及产品质量等都有相当大的影响。牛红杰[28]通过对黄瓜枯萎病生防放线菌HS57液体发酵产孢培养基和发酵工艺进行研究,获得适宜菌株 HS57 孢子产生的培养基。为提高B18的防效,本文以B18菌体生物量以及抑制根肿病菌休眠孢子萌发率为指标,对培养基成分和培养条件进行优化。单因素试验结果显示,不同培养基组分对B18抑菌效果以及生长影响显著,进一步采应用正交试验设计对最优培养基组分进行组合试验,得到了B18培养基组分的最佳组合为A3B1C3,即蔗糖20 g/L,大豆粉10 g/L,牛肉膏5 g/L,培养基组分优化后B18菌体生物量较NA培养基显著提高。
菌株的发酵水平还与pH、发酵时间、通气量、温度等因素有关。pH可影响菌体的生长和代谢产物的合成,尤其是产物的稳定性,杜连祥[29]研究发现放线菌生长的最适pH范围是6.0~8.0。温度对放线菌的生长亦有影响,Breidt等[30]的研究表明大多数放线菌的最适生长温度为23~37℃。发酵时间的长短也是发酵生产中一个非常重要的指标,直接影响代谢产物的产率和质量。本文通过单因素试验筛选B18的最佳发酵条件,结果显示pH、发酵温度和发酵时间对B18孢子萌发抑制率以及生长影响显著。初始接种量对B18孢子萌发抑制率影响显著,但对B18生长影响不大。B18在不同的转速和装液量条件下孢子萌发抑制率以及生长情况均差异不大,说明B18对pH、温度和发酵时间较敏感,其次初始接种量对B18孢子萌发抑制率有一定影响,最后得出B18最佳发酵条件为:在初始pH 7.0条件下,接种3%~7%种子液于150 mL(250 mL三角瓶)培养基中,在25~30℃,150~200 r/min下发酵3 d。故后续进行大量发酵过程中,需关注pH、发酵温度且严格把握发酵时间和初始接种量。
微生物的发酵是一个动态的生物学过程, 培养基pH、组分含量以及溶氧量等不断变化,这些变化会直接影响最终的发酵产物, 而在本文中仅考虑了最初的培养基组分以及培养条件,未监测发酵过程中各因素的动态变化。故在后续的研究中,应对发酵过程中各因素进行动态监测, 找到菌株发酵过程中各因素间更密切的联系,进一步提高菌株的生物量和孢子萌发抑制率。
生防菌发酵产物在各种环境条件下的稳定性是评价该放线菌是否有开发价值的重要指标之一。热稳定性和酸碱稳定性等也是生防菌次级代谢产物开发中重要的衡量依据。王婧[31]研究发现放线菌A316和A10发酵液在紫外线、酸性或中性条件下比较稳定,A316对热的稳定性较好,菌株A10在中低温条件下稳定。本文测定了B18发酵液的热稳定性,酸碱稳定性,紫外线稳定性和储藏稳定性,结果显示B18发酵液对40℃以上的高温以及强碱敏感,这与前面发酵条件的筛选结果一致。另外B18发酵液在常温条件下储藏稳定性差,故在后续的产品开发中需选择合适的剂型或添加合适的保护剂对菌株进行保护以延长货架期。B18发酵液对紫外线不敏感,这有利于B18田间施用后持续发挥抑菌作用。
后续还需要继续研究B18在田间的定殖菌量随时间的变化规律,确定B18的田间定殖能力,再结合本文的研究结果,以确定B18的开发与应用价值。
参考文献
[1] DIXON R. The occurrence and economic impact of Plasmodiophora brassicae and clubroot disease [J]. Journal of Plant Growth Regulation, 2009, 28(3): 194202.
[2] CHAI Ali, XIE Xuewen, SHI Yanxia, et al. Special issue: research status of clubroot (Plasmodiophora brassicae) on cruciferous crops in China [J]. Canadian Journal of Plant Pathology, 2014, 36(S1): 142153.
[3] 王靖, 黃云, 李小兰, 等. 十字花科根肿病研究进展[J]. 植物保护, 2011, 37(6): 153158.
[4] 柴阿丽, 朱发娣, 王惟萍, 等. 我国芸薹根肿菌遗传类群分化研究[J]. 华北农学报, 2015, 30(S1): 309315.
[5] WALLENHAMMAR A C. Prevalence of Plasmodiophora brassicae in a spring oilseed rape growing area in central Sweden and factors influencing soil infestation levels [J]. Plant Pathology, 1996, 45(4): 710719.
[6] 蒋 欢, 彭玉梅, 董代文, 等. 土壤酸碱度与榨菜根肿病的关系分析[J]. 南方农业学报, 2017, 48(9): 16171623.
[7] 蒋 欢, 彭玉梅, 闫玉芳, 等. 榨菜根肿病生防细菌的筛选、鉴定及评价[J]. 植物保护, 2018, 44(2): 104110.
[8] 熊国如, 郑建芬, 吴毅歆, 等. 板蓝根新病害[J]. 农业灾害研究, 2012, 2(2): 34.
[9] 李金萍, 柴阿丽, 孙日飞, 等. 十字花科蔬菜根肿病研究新进展[J]. 中国蔬菜, 2012(8): 14.
[10]LUDWIG-MLLER J, BENNETT R N, KIDDLE G, et al. The host range of Plasmodiophora brassicae and its relation-ship to endogenous glucosinolate content [J]. The New Phytologist, 1999, 144(3): 443458.
[11]王静. 十字花科抗根肿病种质的筛选及应用[D]. 杨凌:西北农林科技大学, 2019.
[12]常文程, 刘彬, 张陈文, 等. 应用非化学防治技术防控十字花科作物根肿病[J]. 上海蔬菜, 2019(5): 8688.
[13]陈秀, 张颂函, 张正炜, 等. 4种杀菌剂不同处理模式防治甘蓝根肿病田间药效评价[J]. 农药科学与管理, 2018, 39(4): 5154.
[14]LAHLALI R, MCGREGOR L, SONG Tao, et al. Heteroconium chaetospira induces resistance to clubroot via upregulation of host genes involved in jasmonic acid, ethylene, and auxin biosynthesis [J/OL]. PLoS ONE, 2014, 9(4): e94144.DOI:10.1371/journal.pone.0094144.
[15]FU Lina, LI Hanmei, WEI Lanfang, et al. Antifungal and biocontrol evaluation of four lysobacter strains against clubroot disease [J]. Indian Journal of Microbiology, 2018, 58(3): 353359.
[16]BAIK K S, LIM C H, PARK S C, et al. Zhihengliuella aestuarii sp. nov., isolated from tidal flat sediment [J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(7): 16711676.
[17]肖崇剛, 郭向华. 甘蓝根肿病菌的生物学特性研究[J]. 菌物系统, 2002, 21(4): 597603.
[18]郭向华. 甘蓝根肿病菌的生物学特性及致病研究[D]. 重庆: 西南农业大学, 2001.
[19]JASCHKE D, DUGASSA-GOBENA D, KARLOVSKY P, et al. Suppression of clubroot (Plasmodiophora brassicae)development in Arabidopsis thaliana by the endophytic fungus Acremonium alternatum [J]. Plant Pathology, 2010, 59: 100111.
[20]LEE S O, CHOI G J, CHOI Y H, et al. Isolation and characterization of endophytic actinomycetes from Chinese cabbage roots as antagonists to Plasmodiophora brassicae [J]. Journal of Microbiology and Biotechnology, 2008, 18(11): 17411746.
[21]LI Xingyu, YANG Jingjing, MAO Zichao, et al. Enhancement of biocontrol activities and cyclic lipopeptides production by chemical mutagenesis of Bacillus subtilis XF-1, a biocontrol agent of Plasmodiophora brassicae and Fusarium solani [J]. Indian Journal of Microbiology, 2014, 54(4): 476479.
[22]ZHOU Lihong, ZHANG Lihui, HE Yueqiu, et al. Isolation and characterization of bacterial isolates for biological control of clubroot on Chinese cabbage [J]. European Journal of Plant Pathology, 2014, 140(1): 159168.
[23]姜云, 黄丽丽, 陈长卿, 等. 一株拮抗番茄叶霉病菌的放线菌筛选、鉴定及发酵条件研究[J]. 微生物学报, 2007, 47(4): 622627.
[24]韩玉竹, 邓钊, 张宝, 等. 解淀粉芽孢杆菌 H15 产抗菌肽的发酵条件优化和提取方法比较研究[J]. 食品科学, 2015, 36(15): 135141.
[25]刘京兰, 薛雅蓉, 刘常宏. 内生解淀粉芽孢杆菌CC09产Iturin A摇瓶发酵条件优化[J]. 微生物学通报, 2014, 41(1): 7582.
[26]李威, 肖熙鸥, 李可, 等. 茄子青枯病拮抗放线菌XL-6的筛选、鉴定及发酵条件优化[J]. 微生物学通报, 2018, 45(2): 357367.
[27]KIERS J L, VAN LAEKEN A E A, ROMBOUTS F M, et al. In vitro digestibility of Bacillu fermented soya bean [J]. International Journal of Food Microbiology, 2000, 60(2/3): 163169.
[28]牛红杰. 黄瓜枯萎病生防放线菌的分离筛选及其发酵工艺研究[D]. 北京: 中国农业科学院, 2019.
[29]杜连祥. 工业微生物学实验技术[M]. 天津: 天津科学技术出版社, 1992.
[30]BREIDT F, CROWLEY K A, FLEMING H P. Controlling cabbage fermentations with nisin and nisin-resistant Leuconostoc mesenteroides [J]. Food Microbiology, 1995, 12: 109116.
[31]王婧. 十字花科根肿病生防放线菌研究[D]. 成都: 四川农业大学, 2011.
(责任编辑:杨明丽)

