铝同晶替代针铁矿对Cd2+吸附性能的影响研究
万 娟 薛 哲 张 舵
(四川大学建筑与环境学院,四川成都,610065)
1 前言
随着我国工农业的快速发展和人口的增长,大量农药以及肥料的使用,导致土壤板结、肥力下降,作物减产;而且大量含有重金属或有机污染物的废水、固废、废气排入环境,导致大面积的土壤受到污染。在各类污染物中,重金属由于其毒性及广泛分布倍受学者关注。在诸多重金属中,镉的毒性较强,其化合物均存在着一定的毒性,仅次于汞而排列第二[1]。根据任利民等[2]研究数据可知,成都平原浅层土壤中镉含量均值为0.23 mg/kg,远大于上述的全国土壤镉背景值0.097 mg/kg。造成成都平原土壤镉含量过高的主要输入途径是大气沉降、灌溉水和化肥,其中大气沉降占主要原因,约占86%[3]。刘红樱等[4]研究发现成都市区以及邛崃山东坡、龙门山和彭州等各区的土壤重金属镉超标。
针铁矿(α-FeOOH)是土壤、沉积物和水分中常见的组分,在地表中广泛存在,具有较大的比表面积和较强的吸附能力,对地表中的土壤重金属的迁移和沉淀有重要影响。在大多数自然环境中,针铁矿几乎不以纯铁相存在,而总是含有几个摩尔百分比的取代离子,如Al3+[5]。铝替代针铁矿后不仅仅改变了材料的微观结构,同时影响了材料的表面性质和对重金属的吸附过程。因此,为了更好地研究土壤中铝同晶替代对针铁矿吸附重金属的影响,本文通过制备不同Al替代量的针铁矿,通过吸附实验,并结合SEM和比表面积研究分析其吸附量随Al替代量变化而变化的情况。
2 材料与方法
2.1 铝同晶替代针铁矿的制备
按照Al替代量为0、10、20mol%的添加比例,称取不同摩尔量相对应质量的Al(NO3)3·9H2O和Fe(NO3)3·9H2O置于1L烧杯中,加入300 mL超纯水稀释溶解,然后用恒流泵以5mL/min的速度滴加约400 mL的 2.5 mol/L NaOH溶液,直至pH值=13.0±0.05,期间不停搅拌,使其充分混匀,最后加入超纯水使得反应体系的总体积为1L[6-7]。将悬浮液置于70 ℃下老化6天[7],老化完成之后,加入一定量2mol/L H2NO3调节悬浮液pH值变为中性(pH值=7.0-7.5),再用超纯水洗至上清液电导率小于20 μs/cm,离心分离得到最终产物,然后将沉淀物在60 ℃的烘箱中干燥并冷却至室温,并过100目筛,储存在塑料容器中于干燥器中备用。Al替代量为0、10、20mol%的样品分别命名为Fe1Al0、Fe0.9Al0.1和Fe0.8Al0.2。
2.2 实验方法
2.2.1 针铁矿化学组分测定
取0.01g铝同晶替代针铁矿分别置于100 mL锥形瓶中,加入20mL(6mol/L)HCl,并设置平行组,将上述锥形瓶放入70℃烘箱中,加热至固体全部溶解,转移至100mL容量瓶中定容,测定Fe和Al的浓度,计算样品的摩尔百分比Al/(Fe+Al)。
2.2.2 吸附动力学实验
取0.2 g 铝同晶替代针铁矿置于20mL初始浓度为100mg/L的镉溶液,(水土比1:100),0.01 mol/L NaNO3溶液为支持电解质,调节pH值为7.0±0.1,25 ℃下恒温震荡5 min、10 min、20 min、0.5 h、1 h、2 h、4 h、8 h、12 h、24 h、48 h,取样并过0.45 μm滤膜,记录悬浮液的最终pH值,并上机测定悬浮液Cd2+的含量,计算实际吸附量。
2.2.3 吸附热力学实验
取0.2 g铝同晶替代针铁矿置于20 mL不同浓度的镉溶液中(以0.01 mol/L NaNO3溶液为支持电解质,Cd2+浓度为0、20、50、100、200、500 mg/L)。调节溶液pH值为7.0±0.1,25 ℃恒温震荡24 h,其余实验操作如2.2(2.2.2)。
2.3 表征方法
2.3.1 Cd2+、Fe3+、Al3+元素
Cd2+、Fe3+、Al3+浓度需上机用电感耦合等离子发射光谱仪测定,浓度需在标曲范围以内,超过标曲范围则需要稀释,测试样品次数为3,取平均数作为最终浓度。
2.3.2 pH值
本实验中所有溶液pH值均直接使用pH计测定,由于本实验过程为固液混合,为确保测定pH值的准确性,测定过程需保证溶液处于流动状态。
2.3.3 XRD
采用X射线衍射仪分析所得的矿物相,测试条件:Cu阳极靶、电压40 kV、电流100 mA、扫描步长为0.026°、扫描范围5-80°。所得图谱用Highscores 3.0进行定性半定量分析。
2.3.4 BET
本实验中针铁矿比表面积使用比表面孔径分析仪进行测定,测定条件:样品在110 ℃下,处理3 h,相对压力(P/P0)≤ 1.0,BET法计算比表面积。
2.4 分析方法
固相上金属离子的吸附量根据吸附平衡前后溶液中溶质的变化计算所得:
式中,Qe为达到吸附平衡时固相上金属离子的吸附量(mg/g);C0为溶液初始浓度(mg/L);Ce为溶液平衡浓度(mg/L);V为加入溶液的体积(L);m为吸附剂质量(g)。
实验数据全部采用Excel 2012进行统计,采用Origin 8.5进行作图。
3 结果与讨论
3.1 样品XRD及化学组分分析
在老化3天后,产物的物相基本不会改变,随着老化时间越长,矿物结晶度越高,晶体结构越稳定。考虑时间、结晶度及结构稳定性,本实验用老化6天的样品进行XRD分析,发现Fe1Al0、Fe0.9Al0.1和Fe0.8Al0.2的XRD衍射峰与矿物标准卡片96-100-8768对比结果较好,成功合成不同铝替代量的针铁矿,且结晶度较高。由图1可得,Fe1Al0、Fe0.9Al0.1和Fe0.8Al0.2的XRD图谱包括了α-FeOOH相全角范围内的特征峰,衍射峰强度较高,且峰形对称,没有出现其他杂峰,Al成功掺杂在针铁矿晶格内,并未改变针铁矿的结构。随着针铁矿晶体结构中铝替代量的增加,针铁矿衍射向高衍射角移动,即d值变小,与李梦雪[6]的研究结果一致。由于Al3+离子在八面体中的配位半径 (0.535 nm)比Fe3+离子的(0.645 nm)约小17%,铁原子被铝原子取代后,形成的Al-O键长比Fe-O键长短,键能更稳定,因此,随着铝取代量的增加,针铁矿晶格间张力逐渐增加,导致晶格结构变化。

图1 铝同晶替代针铁矿样品的XRD谱图
将样品溶解后,用ICP测得Fe1Al0、Fe0.9Al0.1和Fe0.8Al0.2的铝同晶替代量分别为0 、8.63和17.19 mol%,化学测定结果显示,初始添加量越多,样品中Al的掺杂量越大,但矿物实际Al替代量与合成体系溶液中Al(Al+Fe)的初始比例没有明确的线性关系。
3.2 SEM和比表面积分析
由图2铝同晶替代针铁矿(Fe1Al0、Fe0.9Al0.1和Fe0.8Al0.2)的SEM谱图可得,三个样品随着铝替代量的增加,晶体表面形貌展现出不同的差异性,呈现出一定的变化趋势。随着铝含量的增加,针铁矿由针状转变为棒状,再转变为粒状,颗粒大小均一,Fe1Al0为微米结构随机聚集,Fe0.9Al0.1和Fe0.8Al0.2中有更多的非晶态微米颗粒,其结果与马明海等[8]的研究结果一致。针铁矿(Fe1Al0)的长度约为0.33 μm,铝同晶替代针铁矿样品(Fe0.9Al0.1和Fe0.8Al0.2)的长度分别约为0.16 μm和0.08 μm。由以上可得,随着铝含量的增加,针铁矿的粒径减小,这表明Al掺入对晶体生长的抑制作用。

A:Fe1Al0;B:Fe0.9Al0.1;C:Fe0.8Al0.2 图2 铝同晶替代针铁矿的SEM谱图

表1 铝同晶替代针铁矿中Al替代量及比表面积
不同合成方法针铁矿的比表面积不一样,本文针铁矿的比表面积为96.50 m2/g,相比李梦雪等[6]用类似方法获得针铁矿的比表面积(26-42 m2/g)和张佩获得的比表面积59.7 m2/g略大[9]。分析产生差异性的原因为老化的时间以及清洗的方式不同。产生差异性的原因如下:(1)老化时间。本实验针铁矿老化的时间为6天,相比其他实验老化的时间较短。老化的时间越短,产物的结晶度越低,减少了老化期间针铁矿的重结晶和晶体生长,导致样品的比表面积较高。(2)清洗方式。本实验采用HNO3进行清洗,洗掉反应合成过程生成的不稳定铁氧化物,导致本实验的比表面积较其他文献的值高。对于比表面积减少,进行以下推测,随着Al替代量增大,矿物表面化学计量和非化学计量的羟基含量增加,样品表面极性提高,比表面积测定时,非极性分子N2不容易吸附到样品表面,从而导致BET法测量得到的比表面积降低[10]。
3.3 样品对Cd2+的吸附研究
3.3.1 铝同晶替代针铁矿吸附Cd2+的吸附动力学
由图3不同铝同晶替代针铁矿对镉的吸附动力学曲线图可得,在吸附前30min内,Cd2+在不同铝同晶替代针铁矿上的吸附速度非常快,曲线呈现上升至一定的峰值,然后回落,并趋于平稳的趋势。反应4h后,Fe1Al0和Fe0.9Al0.1对Cd2+的吸附逐渐达到平衡,达到最大值;反应1h后,Fe0.8Al0.2对Cd2+的吸附逐渐达到平衡,并达到最大值,其吸附量大小顺序为Fe1Al0>Fe0.9Al0.1>Fe0.8Al0.2。

图3 不同铝同晶替代针铁矿对镉的吸附动力学曲线
3.3.2 铝同晶替代针铁矿吸附Cd2+的吸附热力学
不同铝同晶替代针铁矿对Cd的吸附热力学曲线如图4所示,随着Cd2+溶液的初始浓度增大,反应体系对Cd2+的吸附量不断上升,且不同Al替代量的针铁矿未出现饱和吸附点,一直呈现上升的趋势。随着Al替代量的增加,铝同晶替代针铁矿对Cd2+的吸附上升趋势逐渐趋于平缓,表明随着Al替代量的增加,针铁矿表面的活性吸附位点逐渐减少,导致对Cd2+的吸附量逐渐减少。但在不同的Cd2+浓度范围内,铝同晶替代针铁矿的趋势不一样:Cd2+浓度较低时(Ce<50mg/L),吸附速率大小顺序表现为:Fe1Al0>Fe0.9Al0.1≈Fe0.8Al0.2;Cd2+浓度较高时(Ce>50mg/L),吸附速率大小顺序表现为:Fe1Al0>Fe0.9Al0.1>Fe0.8Al0.2。在Cd2+浓度为500mg/L时,铝同晶替代针铁矿对Cd2+的吸附量顺序为Fe1Al0(6.6 mg/g)>Fe0.9Al0.1(3.9 mg/g)>Fe0.8Al0.2(2.65 mg/g),其吸附量与比表面积变化的结果(Fe1Al0(96.50 m2/g)>Fe0.9Al0.1(72.60 m2/g)>Fe0.8Al0.2(59.80 m2/g))一致。结果表明,铝替代量的增加对针铁矿吸附Cd2+有较强的抑制作用。
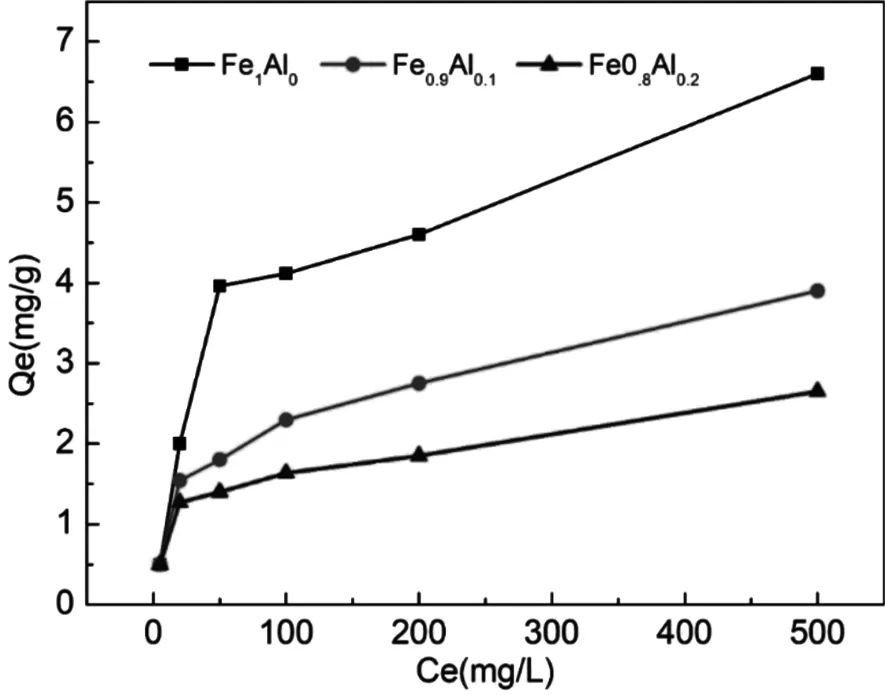
图4 不同铝同晶替代针铁矿对镉的吸附热力学曲线
4 结论
针铁矿具有较高的势能,且存在铝同晶替代现象,对针铁矿本身结构、形貌以及表面性质,对金属元素的在迁移和分布有影响。本文人工合成不同Al替代量针铁矿,通过一系列吸附实验,以及XRD和BET表征,探究铝同晶替代针铁矿对Cd2+的吸附,实验结果表明:随着Al替代量的增加,晶体表面性质发生变化,主要晶面间距减小,晶格间张力逐渐增加,晶格结构变化。Al替代量越大,比表面积越小,顺序大小为:Fe1Al0(96.50m2/g )> Fe0.9Al0.1(72.60m2/g)> Fe0.8Al0.2(59.80m2/g);铝同晶替代针铁矿其对Cd2+的吸附量随着Al替代量的增大而减小,其吸附量顺序大小为Fe1Al0(6.6 mg/g)>Fe0.9Al0.1(3.9 mg/g)>Fe0.8Al0.2(2.65 mg/g)。

