Duchenne型肌营养不良患者长期服用激素对白内障和眼压的影响
赵 爽,陈阿楠,王少霞,陈新宇,张 淑,赵 杰,吴士文
杜氏肌营养不良症(Duchenne muscular dystrophy,DMD)是一种X连锁隐性遗传的神经肌肉疾病,新生活产男婴发病率为1/5000~1/3500[1]。该病由编码抗肌萎缩蛋白的DMD基因突变所致,抗肌萎缩蛋白缺乏影响肌膜的完整性和稳定性,导致肌纤维坏死、再生,肌肉组织纤维化、脂肪化[2]。临床表现为进行性肌肉无力,大多在20岁左右因呼吸和心脏衰竭而死亡。
目前,对DMD的治疗主要以激素及对症支持治疗为主,其中激素是国际DMD标准治疗中最主要的推荐药物[3,4]。激素可改善运动功能,延缓丧失独立行走能力,有效改善心肺功能,降低脊柱侧凸风险,延长生存时间[5,6]。然而长时间使用激素,所带来的不良反应,也严重影响着激素的使用率。激素治疗的常见不良反应,既往已有较多的研究报道,近年来激素对DMD儿童眼睛的影响受到越来越多的重视,然而国内这方面未见报道。本研究旨在探讨长期服用激素对DMD患者白内障及眼压的影响,以及可能诱发白内障和高眼压的相关影响因素。
1 对象与方法
1.1 对象 连续性收集2018-08至2020-12就诊于解放军总医院第三医学中心神经内科DMD多学科联合门诊,具有详细眼科检查资料的DMD患者。入组标准:(1)确诊DMD,且年龄>4岁,符合全身应用激素治疗的条件;(2)既往无弱视、白内障、青光眼等眼科疾病的病史及家族史;(3)接受激素治疗者,激素均为每日口服,强的松剂量为每天0.3~0.75 mg/kg,地夫可特为每天0.9 mg/kg。排除标准:入组患者1年之内未更换激素种类,且就诊前3个月激素无停药超过3 d的记录。
1.2 方法
1.2.1 高眼压和白内障的诊断依据 高眼压诊断依据:(1)眼压>21 mmHg;(2)入组前排除原发性青光眼;(3)排除其他原因引发的继发性开角型青光眼;(4)除外角膜厚度因素所致的高眼压;(5)排除因不配合检查,造成的高眼压。白内障诊断依据:(1)散瞳后,裂隙灯下可见晶状体混浊(小点状、空泡状、条索状)且符合白内障诊断(依据2017版《眼科临床指南》标准);(2)排除引起晶状体混浊的其他眼内疾病。
1.2.2 分组 入组的158例患者根据长期是否服用激素,分为非激素组(n=31)和激素组(n=103),24例患者因服用激素时间小于6个月未纳入本次研究。激素组按照服用激素种类不同,分为地夫可特组(n=11)和泼尼松组(n=92)。
1.3 观察指标
1.3.1 一般资料 收集患者一般资料,包括年龄、性别、体重、身高、BMI、基因突变是否累及DP260及DP71及用药情况(开始服药时间、药物种类、持续服药时间)。
1.3.2 眼部临床资料 眼科检查均由眼科专科医师执行和出具诊断,使用非接触眼压计(NT-530P NIDEK)、免散瞳眼底照相机(CANON)、裂隙灯显微镜(TOPCON)、5 m距离标准对数视力表、电脑自动验光仪(KR-8800 TOPCON),观察并记录双眼眼压值、杯盘比(c/d)、晶状体变化情况、晶状体混浊部位。
2 结 果
2.1 一般情况 最终纳入分析患者134 例,均为男性,年龄4~15岁,平均(8.9±2.4)岁。其中,激素组年龄大于非激素组,差异有统计学意义。两组在dystrophin亚型DP71、DP260的累及上无差异。激素组BMI显著高于非激素组,差异有统计学意义(表1)。强的松组与地夫可特组平均年龄分别为(9.52±2.23)岁和(8.54±2.50)岁,BMI分别为(20.16±3.88)kg/m2和(18.78±3.24)kg/m2,两组比较差异无统计学意义,两组间在DP260、DP71累及上亦无统计学差异。
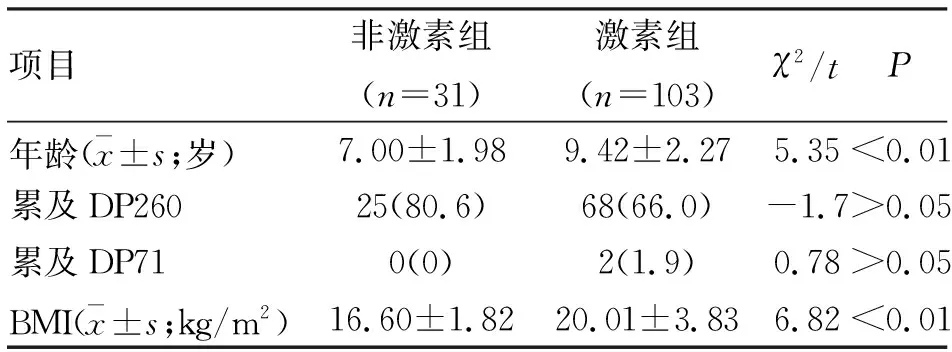
表1 两组Duchenne型肌营养不良(DMD)患者一般情况比较 (n;%)
2.2 晶状体及眼压变化 非激素组中,未发现晶状体混浊病例,眼压增高1例。激素组中,发生白内障13例(12.6%),其中双眼2例(15.4%),单眼11例(84.6%);发生高眼压24例(23.3%),其中双眼13例(54.2%),单眼11例(45.8%),高眼压最高为34 mmHg。激素组高眼压与白内障发生率均高于非激素组,差异有统计学意义(P<0.05)。
2.2.1 高眼压和白内障发病与激素服用时间的关系 激素组的服药时间为6~98个月,平均服药时长(32.09±19.65)个月;发现高眼压时,平均服用激素时间(25.17±14.81)个月,发现白内障时,平均服用激素时间(49.69±27.11)个月。高眼压和白内障的患病总数随着服用激素的时间延长而增多。相对而言,高眼压比白内障发生更早。在本组资料中,高眼压最早出现在服用激素6个月的时候,随后病例总数一直快速增多。而白内障最早发生在服用激素19个月,在19~34个月病例总数快速增加,之后增加相对放缓(图1)。
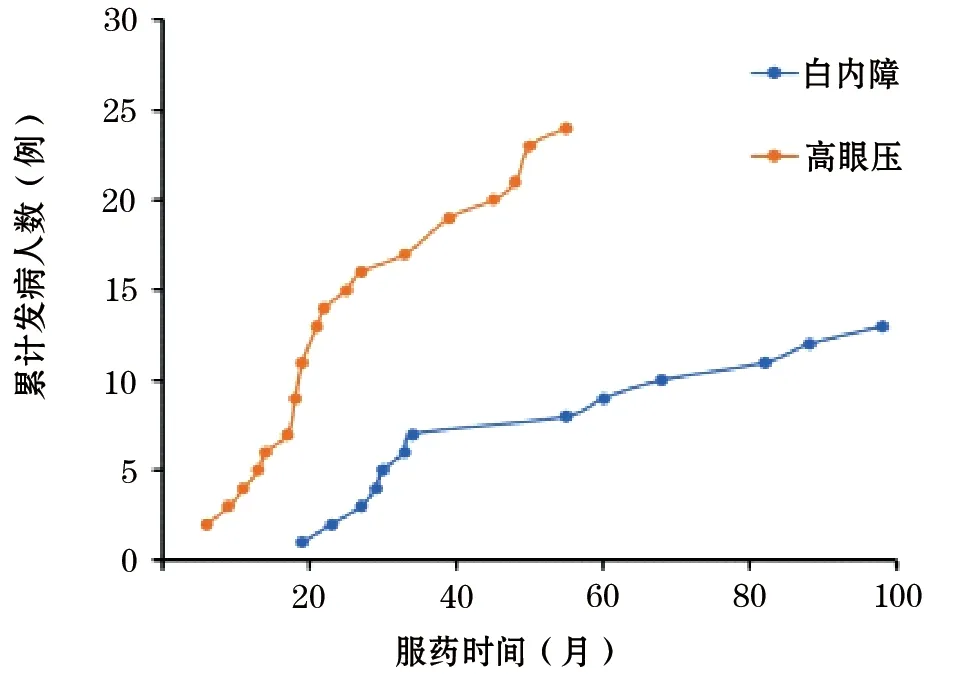
图1 Duchenne型肌营养不良(DMD)患者高眼压与白内障发生总数随服药时间(月)变化趋势
2.2.2 高眼压和白内障发病与激素类别的关系 地夫可特治疗的患者白内障发生率为27.3%(3/11),高眼压发生率为27.3%(3/11);接受泼尼松治疗的患者白内障发生率为10.9%(10/92),高眼压发生率为22.8%(21/92)。与泼尼松组相比,地夫可特组激素性白内障发生率显著增高(P<0.05),两组间在高眼压无统计学差异。本研究中,发生的白内障均为晶状体后囊下局限性混浊,裂隙灯下可见明显改变(图2)。
2.3 发生白内障或高眼压的多因素分析 通过Logistic回归分析年龄、激素种类、服用激素时间、基因类型(是否累及DP260/DP71)及BMI与白内障及高眼压是否相关。结果表明:白内障发生与激素的种类和服用激素时间长短有关,而与年龄、BMI、是否累及Dp260/Dp71无关。高眼压与年龄、服药时间、服用激素种类、BMI、是否累及Dp260/Dp71均无关(表3)。
3 讨 论
自1989年Drachman等[7]首先推荐激素治疗DMD以来,目前糖皮质激素已成为DMD的标准治疗药物。但是长期使用激素的不良反应不容小觑。除了常见的肥胖、骨质疏松、身材矮小等之外,近年来眼科的不良反应,特别是白内障可导致失明,严重影响患者生活质量,临床应该给予高度的重视。
3.1 激素对晶体及眼压的影响 既往大量研究已经证实,激素可引起眼压升高及晶体混浊[3,8-10]。激素造成的眼压增高机制,有研究认为是细胞外基质物质在小梁网内积聚而增加房水流出阻力所致[11],也有研究表明与基因遗传相关,特别可能与GPR158和HCG22基因的多态性有关[12-14]。目前认为真正可能的机制是糖皮质激素诱导的晶状体上皮细胞以及其他眼内或全身细胞的基因转录发生改变,各种细胞因子相互作用所致[15]。
对于激素所致的眼压增高的发生率,既往报道不完全一致。Behbehani等[16]报道一组中东哮喘儿童,间断使用吸入性激素时间1~3年,没有发生激素性白内障及高眼压。Rice等[17]在对一组以白种人为主的514例激素治疗的DMD观察性研究中发现,只有1例(1.1%)在使用激素时出现眼压升高。而日本的一项研究,45例肾病儿童患者长期接受激素治疗,其中9例(20%)在治疗期间眼压高于22 mmHg[18],皮质类固醇治疗的总剂量和持续时间与眼压升高无关。同样,韩国Lee 等[19]报道,在一组长期使用激素的儿童肾小球肾炎患儿中,39%出现眼压升高,研究同时还发现,特定儿童中,即使仅短期使用也出现眼压升高,有些儿童尽管长期使用也不出现眼压升高。本研究中,出现激素性高眼压高达23.3%,与同属于亚洲日本、韩国的数据相一致,与白种人及中东人存在很大差异,这可能与前述的激素引起眼压增高与基因遗传易感性有关[14],当然还有可能与给药方式及给药剂量有关,需要今后去深入研究。
对于激素引起白内障的发生率,总体报道相一致。Rice等[17]在对一组以白种人为主的DMD激素治疗的观察研究中发现,接受地夫可特治疗的患者白内障患病率为25.1%,而使用强的松的患者白内障患病率为12.6%,有7例(1.4%)需要进行白内障手术。这与我们研究完全一致,服用地夫可特者白内障发生率为27.3%,服用泼尼松的患者白内障发生率10.9%,1例已进行白内障手术治疗(1.0%)。前面提到的韩国和日本的两个长期接受激素治疗的儿童性研究中,白内障的发生率分别为31%和33.3%[18-19]。遗憾的是上述两项研究没有对激素种类进行比较,日本的这项研究同时发现皮质类固醇治疗的总剂量和持续时间与白内障形成有关,但与眼压升高无关,这一结果在我们的高眼压/白内障的多因素回归中,同样得到了证明。
3.2 激素的种类与白内障及眼压增高的关系 近年来对于DMD治疗,激素的选择一直是临床及研究的焦点。虽然激素治疗DMD的有效性得到肯定,但其不良反应一直制约着它的使用。强的松等激素的不良反应主要表现为体重增加、骨质疏松、身材矮小、毛发异常、青春期延迟、精神心理影响等[20-22]。近年来地夫可特,由于其增加体重的不良反应较小,而且其治疗DMD改善运动功能优于强的松,引起大家广泛关注与应用[23-25]。国内虽然没有批准上市,但是仍有部分患者通过各种渠道购买使用。地夫可特对于运动功能的改善,减少体重增加得到肯定,但是研究也表明其与普通激素相比,增加白内障和骨折的风险[23-25]。 最新的研究表明,新出现的温和激素Vamorolone,有常规激素同样的治疗作用,但少有激素的不良反应[26]。目前这个药物仍在三期临床试验中,值得期待。
在我们的研究中,也得出了相似的结果,同时本研究也证实地夫可特组与强的松组相比,显著增高白内障的发病率,而在高眼压方面,两组之间没有显著差异。在肥胖方面,地夫可特组的患者BMI低于强的松组,但没有出现统计学差异,考虑与地夫可特组样本量太少有关。体重的控制对于DMD的治疗尤为重要,体重增加可直接加速患者的运动功能下降。
3.3 DMD基因亚型与高眼压及白内障 DMD位于X染色体,具有79个外显子,是迄今为止已知的最大的基因。其有7种基因启动子和选择性剪接异构体,分别转录并翻译出7种抗肌萎缩蛋白亚型,DP427c、DP427m、 DP427p、DP260、DP140、DP116、DP71。目前研究表明DP260与DP71更多在视网膜表达,与视力异常相关。早期有研究表明位于基因远端突变的DMD/BMD患者,易出现异常暗适应视网膜电图(ERGs)[27]。后来Costa等[28]发现,基因远端更多累及DP260与DP71,更容易出现视异常,DMD外显子30下游缺失患者易出现红绿色色觉识别缺陷。缺失Dp71小鼠ERGs异常,通过基因治疗,恢复DP71,可以改变ERGs的异常[29]。既往的小鼠研究中,表明DMD基因与白内障可能存在一定的相关性[30,31],但在后期的动物实验以及人体的研究中均未得到证实。在本研究的多因素回归分析中,也未发现Dp260、Dp71与白内障及高眼压相关。当然,由于目前的样本量较小,希望后期有更大样本的研究来证实。
DMD在激素治疗过程中,有较高的白内障及高眼压发生率。本研究结果提示,白内障的发生与激素的种类和服用时间长短有关,而与年龄、BMI、是否累及基因Dp260/Dp71无关。本研究中服用地夫可特患者的白内障发生率高于服用泼尼松的患者,但由于本研究服用地夫可特的患者人数较少,存在一定的局限性,未来有待扩大样本量进行更深入的研究。建议DMD患者定期眼压监测及晶状体检查,及时处理眼科并发症。

