氨氮急性胁迫下二、三倍体雌性虹鳟应激耐受性比较
韩 英,蔺佳文,吕晓楠,薛淑群,韩 玥
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.北京市水产技术推广总站,北京 100176)
虹鳟(Oncorhynchus mykiss)属于鲑形目、鲑科、大麻哈鱼属,是联合国粮农组织(FAO)推荐的三大优良淡水养殖品种之一。与普通二倍体虹鳟相比,三倍体雌性虹鳟具有不育、个体大、生长快、肉质好等优良品性[1],在水产养殖业中被广泛应用,需求量与日俱增。水中总氨氮指离子氨(NH4+)和分子氨(NH3-N)两者含量总和,其中氨氮是水产养殖主要胁迫因子之一。集约化养殖过程中,水中氨氮过量累积,对鱼类造成不同程度影响,如改变体内能量代谢[2]、降低机体免疫力[3]、抑制生长[4]。高浓度氨氮胁迫可使大口黑鲈[5(]Mi⁃cropterus salmoides)、 牙 鲆[6](Paralichthys oliva⁃ceus)、黄颡鱼[7(]Pelteobagrus fulvidraco)、鲤[8(]Cyp⁃rinuscarpio)发生氧化应激及炎症反应、机体免疫力降低甚至导致死亡。
传统虹鳟养殖多采用流水养殖方式,近年来随网箱养殖及陆基养殖迅速发展,因水体交换率不足或循环水处理效果不佳,水体氨氮含量升高而造成损失时有发生。研究表明,三倍体鱼类对环境胁迫耐受性较差,辛苑茹等研究发现,三倍体虹鳟对高温环境更为敏感,需要消耗更多能量用于抵抗高温胁迫[9];Leal等发现三倍体高首鲟(Acipenser transmontanus)相比二倍体对环境胁迫有更高敏感性[10]。
三倍体鱼类较二倍体增加一套染色体,二者生物学特性上存在一定差异,了解这种差异对养殖生产十分必要,而目前有关三倍体雌性虹鳟对氨氮耐受性研究尚属空白。本研究采用组织学、生理学及分子生物学方法,通过观察氨氮急性胁迫下二、三倍体雌性虹鳟鳃组织病理学变化,测定血液生理生化指标和抗氧化指标变化,以及免疫与应激相关基因表达,比较分析二、三倍体雌性虹鳟(以下简称2n、3n)耐受性及抗应激能力的生理调控差异,以期为其养殖生产及应激保护提供理论依据。
1 材料与方法
1.1 实验动物
二、三倍体雌性虹鳟来源于哈尔滨市农业科学院水产分院,遗传背景相同,平均体重为(200±10)g。试验开始前在100 cm×50 cm×50 cm(有效水体体积为200 L)水族箱中暂养3周。试验水温(16.0±0.5)℃,溶解氧(7.8±0.2)mg·L-1,pH 7.85,氨氮(0.07±0.1)mg·L-1,光照周期为12 h∶12 h。暂养期间饱食投喂,每日在8:00、12:00和16:00定时投喂虹鳟商品饲料,试验开始前2 d停食。
1.2 主要仪器与试剂
仪器:紫外分光光度计(美国Thermo公司),PCR仪(美国Thermo公司),荧光定量PCR仪(美国Roche,Light Cycler 2.0),血细胞分析仪(日本NI⁃HONKOHDEN公司)。
试剂:SOD、CAT活力以及MDA和COR含量检测试剂盒(购自南京建城生物工程研究所);Bio⁃Fast®Simply P®Total RNA Extraction Kit试剂盒、BioRT®Master HiSensi®cDNA First Strand Synthesis kit试剂盒和BioEasy®Master Mix(SYBRGreen,High ROX)Real Time PCRKit试剂盒(购自杭州博日科技有限公司);其他常规药品及试剂均为国产。
1.3 96 h半致死浓度(96 h-LC50)
通过急性毒性效应预试验,确定急性氨氮胁迫适宜浓度。根据文献[11-12]对虹鳟氨氮胁迫研究,总氨氮(TAN)浓度等对数间距设定为16.42、24.32、36.06、53.82和80.09 mg·L-1,即非离子氨(NH3-N)浓度为0.40、0.59、0.88、1.31和1.96mg·L-1。每隔7 h通过预配NH4Cl母液校准试验水体氨氮浓度。总氨氮浓度测定采用纳氏试剂法[13]。统计2n、3n在不同氨氮浓度下96 h死亡率,得出96 h-LC50。
1.4 急性氨氮胁迫试验
以经充分曝气自来水为对照组,设置低、中、高3个氨氮处理组,其TAN浓度分别为16.42 mg·L-1(A组)、24.32 mg·L-(1B组)和36.06 mg·L-(1C组),NH3-N浓度分别为0.40 mg·L-(1A组)、0.59 mg·L-1(B组)和0.88 mg·L-(1C组)。每组设3个平行,每个平行20尾鱼。胁迫时间为96 h,试验期间停饲,每日更换1/3水,及时清理排泄物及死鱼,用NH4Cl储备液调节以稳定养殖水体氨氮浓度。
1.5 样本采集
24、48、72和96 h取样。为避免捕捞刺激造成二次应激,用250 mg·L-1MS-222将鱼麻醉后随机采样,每个平行取3尾(n=9)。将鱼置于无菌冰盘,采集鳃丝和肝组织,用4%多聚甲醛固定;尾静脉取血,全血样本置于抗凝管中4℃保存,2 d内检测血液生理指标;血样置于4℃静置24 h后,4℃、4 000 r·min-1离心15 min,制备血清,用于检测血液应激指标;采集36.06 mg·L-1组肝脏放于液氮中速冻并存储于-80℃,用于相关基因检测。
1.6 血液生理生化分析
采用全自动血细胞分析仪测量血液样品WBC、RBC及HGB含量。根据检测试剂盒说明检测血清中SOD、CAT活力以及MDA和COR含量。
1.7 组织病理学检查
将固定在4%多聚甲醛溶液中鳃组织通过系列梯度乙醇脱水,二甲苯透明处理,石蜡包埋、修整,切片厚度5~6 mm,置于37℃烘箱中烘烤过夜。切片经苏木精和伊红(H&E)染色,中性树脂胶封片,置于光学显微镜下观察并拍照记录。
1.8 免疫与应激相关基因表达
采用qRT-PCR方法检测36.06 mg·L-1组2n、3n肝脏基因表达水平。用BioFast®Simply P®Total RNA Extraction Kit试剂盒从肝脏中提取总RNA,用BioRT®Master HiSensi®cDNA First Strand Synthesis kit试剂盒将其反转录为cDNA。用BioEasy®Master Mix(SYBR Green,High ROX)Real Time PCR Kit,在LightCycler 2.0中实时定量PCR。具体引物(见表1)由生工公司(上海)合成。反应程序设置采用两步法:95℃预变性1 min;95℃15 s,60℃1 min,35个循环。融解曲线程序设置如下:95℃1 min;65℃1 min;95℃20 s;30℃1 min。以β-Actin作为内参基因,根据其表达量作标准化处理,采用相对定量2-ΔΔCt方法计算目的基因相对mRNA表达。

表1 引物序列Table 1 Primer sequences
1.9 统计分析
采用SPSS19.0双因素方差分析,用Duncan氏法作多重比较,统计结果用平均值±标准差(Mean±SD)表示。“*”代表同一时间2n、3n差异显著(P<0.05),“**”代表同一时间2n、3n差异极显著(P<0.01);不同字母表示同一倍性不同处理组不同时间点差异显著(P<0.05),其中小写字母代表2n,大写字母代表3n。
2 结果与分析
2.1 氨氮胁迫下二、三倍体雌性虹鳟96 h半致死浓度
通过加权回归分析,得到氨氮对2n、3n的TAN 96 h-LC50分别为38.176和33.864 mg·L-1,二、三倍体NH3-N 96 h-LC50分别为0.931和0.825 mg·L-1(见表2)。
2.2 氨氮胁迫下二、三倍体雌性虹鳟血细胞变化
A组2n的WBC含量在48 h显著高于对照组(P<0.05),3n的WBC含量在24 h显著升高,3n在24、72和96 h显著高于2n(P<0.05);B组2n、3n的WBC含量显著高于对照组(P<0.05),3n在24、48和72 h显著高于2n(P<0.05);C组2n、3n的WBC含量呈先升后降趋势,24 h达到峰值,显著高于对照组(P<0.05),3n在24 h显著高于2n(P<0.05,见图1A)。
对照组2n的RBC含量显著高于3n;A组2n、3n的RBC含量在72、96 h显著高于对照组(P<0.05),2n在96 h显著高于3n(P<0.05);B组2n、3n的RBC含量在24 h显著高于对照组(P<0.05),后呈下降趋势,96 h显著低于对照组(P<0.05),2n在24、96 h显著高于3n(P<0.05);C组2n、3n的RBC含量显著低于对照组(P<0.05),2n在96 h显著高于3n(P<0.05,见图1B)。
A组2n的HGB含量在72、96 h显著高于对照组(P<0.05),3n的HGB含量在48 h、72 h和96 h显著高于对照组(P<0.05),3n在72 h显著高于2n(P<0.05);B组2n、3n的HGB含量呈先升后降趋势,24 h达到峰值显著高于对照组(P<0.05),在96 h显著低于对照组(P<0.05),3n在24、48 h显著高于2n(P<0.05);C组2n、3n的HGB含量显著低于对照组(P<0.05),2n在24 h、48 h和72 h显著高于3n(P<0.05,见图1C)。

表2 96 h氨氮、非离子氨半致死浓度Table 2 96 h semi-lethal concentration of ammonia nitrogen and nonionic ammonia to 2n and 3n
2.3 氨氮胁迫下二、三倍体虹鳟血清COR及抗氧化指标变化
A、B组2n、3n的COR含量呈先升后降趋势(P<0.05),2n在48 h达到峰值,3n在72 h达到峰值。A组3n的COR含量在72、96 h显著高于2n(P<0.05),B组3n的COR含量在72 h显著高于2n(P<0.05)。C组2n、3n的COR含量显著高于对照组(P<0.05,见图2A)。
A组2n的SOD活性在24、48和72 h显著高于对照组(P<0.05),3n的SOD活性在48 h显著高于对照组(P<0.05),2n的SOD活性在24 h显著高于3n(P<0.05)。B组2n、3n的SOD活性呈显著上升趋势(P<0.05)。C组2n、3n的SOD活性显著高于对照组(P<0.05,见图2B)。
A组2n、3n的CAT活性呈先升后降趋势,与对照组差异显著(P<0.05);2n在24 h达到峰值,3n在48 h达到峰值,2n的CAT活性在24h显著高于3n(P<0.05),3n的CAT活性在96 h显著高于3n(P<0.05)。B、C组2n、3n的CAT活性显著高于对照组(P<0.05,见图2C)。
A组2n、3n的MDA含量呈先升后降趋势,与对照组差异显著(P<0.05),3n的MDA含量在24、48 h显著高于2n(P<0.05)。B、C组2n、3n的MDA含量显著高于对照组(P<0.05)。B组3n的MDA含量在24 h、72 h显著高于2n(P<0.05,见图2D)。
2.4 氨氮胁迫下二、三倍体雌性虹鳟鳃组织观察
对照组鳃组织未显示任何明显病理变化(见图3A、C)。氨氮胁迫下,2n鳃小片粘连,有较多炎性细胞聚集,细胞空泡化(见图3B)。3n氨氮组鳃丝中央静脉窦扩张,可见广泛性炎性细胞浸润,细胞空泡化严重,整体损伤变形程度较大(见图3D)。

图1 2n、3n雌性虹鳟血细胞变化Fig.1 2n,3n female rainbow trout blood cell levels
2.5 高浓度氨氮胁迫下二、三倍体雌性虹鳟肝脏促炎因子基因表达
与对照组相比,36.06 mg·L-1组2n、3n肝脏TNF-α,IL-1β,IL-6和IL-8 mRNA表达均显著升高(P<0.05)。3n肝脏TNF-αmRNA表达量在72 h和96 h显著高于2n(P<0.01,见图4A);3n肝脏IL-1βmRNA表达量在48 h显著高于2n(P<0.05),72 h和96 h极显著高于2n(P<0.01,见图4B);3n肝脏IL-6 mRNA表达量在48、72和96 h极显著高于2n(P<0.01,见图4C);3n肝脏IL-8 mRNA表达量在24、72和96 h极显著高于2n(P<0.01,见图4D)。
2.6 高浓度氨氮胁迫下二、三倍体雌性虹鳟肝脏热休克蛋白基因表达
36.06 mg·L-1组2n、3n肝脏HSP70 mRNA表达量24 h后显著高于对照组(P<0.05)。2n肝脏TNF-α mRNA表达量在96 h极显著高于3n(P<0.01,见图5A)。36.06 mg·L-1组2n、3n肝脏HSP90 mRNA表达量均在48 h后显著高于对照组(P<0.05);2n肝组织HSP90 mRNA表达量在72和96 h极显著高于3n(P<0.01,见图5B)。

图2 2n、3n雌性虹鳟血清COR、SOD、CAT、MDA含量变化Fig.2 Levels of COR,SOD,CAT and MDA in 2n and 3n female rainbow trout serum

图3 96 h氨氮胁迫后2n、3n雌性虹鳟鳃组织变化Fig.3 Tissue sections of 2n and 3n femalerainbow trout gill filaments under ammonia nitrogen stress for 96 h

图4 2n、3n雌性虹鳟肝脏中促炎因子基因表达Fig.4 2n,3n femalerainbow trout cell factor geneexpression in theliver
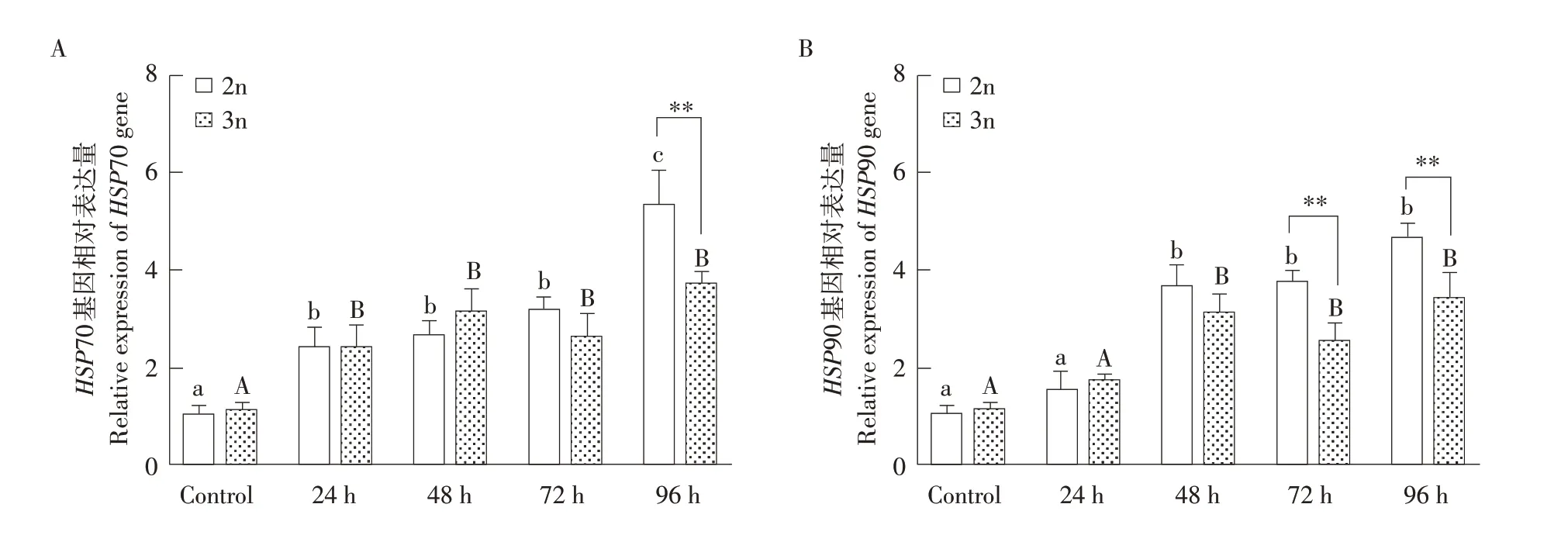
图5 2n、3n雌性虹鳟肝脏中HSP70、HSP90基因表达Fig.5 2n,3n female rainbow trout HSP70 and HSP90 gene expression in the liver
3 讨论
养殖生产过程中,水体氨氮超标,极易造成养殖鱼类大规模死亡。研究表明,氧化应激和炎症反应可能是导致鱼类氨中毒死亡重要因素之一[5]。3n的NH3-N 96 h-LC50低于2n,说明3n对氨氮耐受性差于2n。
水体中过量氨氮侵入鱼类体内降低其携氧能力,影响呼吸系统,损伤组织黏膜,破坏鳃丝结构,影响肝脏生理功能,引起体表及内脏充血、肿大,最终导致其昏迷甚至死亡[14]。对泥鳅(Mis⁃gurnus anguillicaudatus)[15]和青鱼(Mylopharyngodon piceus)[16]研究表明,长期或短期氨氮胁迫均导致鳃小片损伤、炎症细胞增多、细胞水肿甚至坏死,鳃组织无法行使正常生理功能。本研究中,在36.06 mg·L-1氨氮浓度下3n鳃组织损伤严重,出现大量炎性细胞浸润,细胞空泡化;2n亦观察到相似组织学变化,但损伤程度轻,说明氨氮胁迫对3n鳃组织损伤较2n更为严重。
血细胞是评估鱼类毒性影响重要指标[17]。Kim等研究表明,氨氮胁迫显著降低石斑鱼(Epinephelus coioides)红细胞压积和血红蛋白水平[18]。Yang等也提出,氨氮胁迫导致鲫(Carassiusauratus)血液RBC和HGB含量显著减少[19]。Hoseini等发现氨氮胁迫下,鲤(Cyprinus carpio)自由基累积,导致红细胞膜损伤,RBC数量降低[20]。本研究发现,随氨氮胁迫浓度升高,RBC、HGB含量先升后降,说明2n、3n通过提高RBC、HGB含量,抵御较低浓度氨氮胁迫;这种抗应激能力有一定限度,过高浓度氨氮胁迫对RBC造成损伤,使HGB降低,导致贫血。在高浓度(36.06 mg·L-1)氨氮胁迫下,2n的RBC、HGB含量显著高于3n(P<0.05),说明高浓度氨氮胁迫对于3n血液携氧能力影响较2n严重。
WBC是动物体内重要免疫细胞,鲢(Hypoph⁃thalmichthys molitrix)[21]受到环境胁迫影响时,RBC、HGB含量显著下降,WBC含量显著上升。本研究中,随氨氮胁迫浓度升高,2n、3n的WBC、RBC、HGB含量均呈先升后降。Kim等研究表明,当氨氮浓度过高,造成石斑鱼免疫抑制降低WBC含量,与本研究结果一致[18]。在低浓度(16.42 mg·L-1)、中浓度组(24.32 mg·L-1)2n最先到达峰值且低于3n,高浓度组(36.06 mg·L-1)3n的WBC含量下降速度快于2n,表明3n较2n对氨氮胁迫更敏感,应激反应更剧烈且持续时间更长。2n与3n的WBC变化趋势一致,3n显著高于2n,表明3n较2n对氨氮胁迫的应激反应更剧烈。
COR是鱼类抗应激反应主要途径HPI轴的主要介质,被认定为初级应激反应重要指标。当鱼体受到高浓度氨氮胁迫时,导致鱼体内COR含量上升,产生大量活性氧(ROS),抗氧化酶如SOD、CAT等可清除多余ROS,但清除效率受胁迫持续时间和强度影响。MDA作为脂质过氧化最终产物的一种,反映组织过氧化损伤程度[22-23]。Li等报道高浓度氨氮胁迫下黄颡鱼SOD、CAT活性先升高后逐渐降低结果一致,推测SOD、CAT活性下降与氧化反应最终产物MDA含量累积有关[24]。本试验结果表明,受到氨氮胁迫后,2n、3n血清SOD和CAT活性均呈先升后降趋势,2n、3n血清COR、MDA含量呈上升趋势且显著高于对照组(P<0.05)。此外,在黄颡鱼[7]、鲻(Mugil cephalus)[25]中MDA含量均有相同趋势。氨氮胁迫使3n血清SOD、CAT活性低于2n,MDA含量高于2n,说明在本试验条件下,2n抗氧化能力强于3n,且应对速度更快,MDA含量较低也表明其所受的氧化损伤较轻。
TNF-α是一种多效性促炎细胞因子,可激活NF-κB信号通路,诱导一系列IL-1β、IL-6、IL-8等炎症相关基因表达[26]。氨氮胁迫诱导黄颡鱼肝脏TNF-α、IL-1-β和IL-8基因mRNA高表达[7];氨氮胁迫诱导暗纹东方鲀(Takifugu obscurus)肝脏BAFF,TNF-α、IL-6和IL-12基因表达量上升[27]。本试验结果表明,氨氮胁迫下,2n、3n肝脏TNF-α、IL-1β、IL-6和IL-8的mRNA表达量显著升高,且随时间呈上升趋势,与上述研究结果一致。3n促炎因子相对表达量显著高于2n,推测相同氨氮浓度胁迫下,3n肝脏炎症反应较2n严重。
热休克蛋白(HSPs)作为避免生物体遭受氧化应激伤害的一种自我保护系统,具有抗氧化生物活性,当暴露于环境应激中,机体通过激活热休克基因合成HSPs。本研究发现,氨氮胁迫下2n、3n肝脏HSP70、HSP90基因的mRNA表达量呈显著上升趋势,表明HSP70、HSP90基因在高浓度氨氮胁迫下能够作出积极应答,与对暗纹东方鲀同类研究一致[27]。辛苑茹等对急性高温胁迫下虹鳟幼鱼HSP基因表达变化检测中也得到类似结果[9]。试验结果表明,氨氮胁迫下,2n肝脏HSP70、HSP90基因表达在72 h后显著高于3n,推测2n具有更强应激调节能力,对氨氮胁迫耐受程度强于3n。
综上所述,随氨氮浓度升高,与二倍体相比,三倍体雌性虹鳟血细胞变化波动更明显,应激标志物COR、脂质氧化最终产物MDA含量更高,抗氧化酶SOD、CAT酶活性较弱。在36.06 mg·L-1氨氮浓度下,三倍体雌性虹鳟鳃组织病理损伤严重,促炎因子表达量高,热休克蛋白基因表达量低。研究结果表明,与二倍体虹鳟相比,三倍体雌性虹鳟对氨氮胁迫更为敏感,氧化应激和炎症反应调节能力较弱,氨氮耐受性较差。

