巴斯德毕赤酵母SUT2和ATG26响应甲醇代谢机制
王鹏程,李 翔,赵天宇,战春君,2,3,白仲虎,2,3,杨艳坤,2,3*
(1.江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2.江南大学工业生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
嗜甲醇巴斯德毕赤酵母通过甲醇利用途径(Methanol utilization pathway,MUTpathway)代谢甲醇[1]。因其具有高效且严格调控的醇氧化酶1启动子(PAOX1)、培养条件简单、高密度发酵、蛋白翻译后修饰系统等优良特性,现已成为使用最广泛外源蛋白表达宿主之一[2]。其表达系统基于甲醇代谢通路,但涉及大量转录和信号因子,且具体分子机理尚不清楚[3]。为寻找甲醇代谢潜在信号因子,分析K.phaffii以甲醇为碳源及甘油为碳源转录组数据[4],发现被甘油抑制而被甲醇显著诱导的基因PAS_chr1-4_0516,通过蛋白序列比对,发现其与酿 酒 酵 母(Saccharomyces cerevisiae,S.cerevisiae)SUT2同源。而S.cerevisiae中SUT2为SUT1(Sterol up take 1,固醇摄取基因1)同源基因,可在厌氧条件下协同SUT1参与调控固醇摄取[5-7],故毕赤酵母中响应甲醇诱导的SUT2基因同样可能为固醇代谢潜在基因。
毕赤酵母细胞中麦角固醇是最主要固醇成分[8],也是过氧化物酶体膜重要组成[9]。过氧化物酶体是甲醇代谢主要细胞器[10-11]。因此,推测响应甲醇诱导的SUT2通过调控麦角固醇代谢,影响过氧化物酶体膜形成以及过氧化物酶体增生,进而参与甲醇代谢。
甲醇代谢时,过氧化物酶体量动态调节通过细胞器生物发生与自噬之间的平衡实现[11]。过氧化物酶体自噬时,自噬相关蛋白ATG26通过GRAM结构域(靶向过氧化物酶体自噬特异性膜突起)和PH结构域(具有脂质结合活性)与ATG30(Autopha⁃gy-related gene 30,自噬相关基因30)、ATG8(Au⁃tophagy-related gene 8,自噬相关基因8)、ATG11(Autophagy-related gene 11,自噬相关基因11)等蛋白协同作用,参与过氧化物酶体自噬,控制过氧化物酶体体积及总量[12]。此外,ATG26蛋白也具有甾醇葡萄糖基转移酶活性,可将麦角固醇转化为甾醇葡萄糖苷[13]。结合SUT2潜在功能,本文深入研究SUT2与ATG26对麦角固醇作用及参与甲醇代谢机理。
1 材料与方法
1.1 主要材料
菌株和质粒如表1所示。文中所需引物均由苏州金唯智公司合成;吡啶、氢氧化钾购自国药集团化学试剂有限公司,正己烷购自上海麦克林生化科技有限公司,N,O-双(三甲基硅基)三氟代乙酰胺购自北京索莱宝科技有限公司;气相色谱质谱联用仪GCMS-QP2020购自日本岛津公司;CO2培养箱3111购自赛默飞;其他材料、设备参照文献[14]。

表1 菌株和质粒Table 1 Strains and plasmids
1.2 质粒构建
1.2.1 sgRNA-ATG26敲除质粒
输入ATG26基因序列至在线网站(http://chop⁃chop.cbu.uib.no/),选择菌种Pichia pastoris,获得推荐的sgRNA序列;开展脱靶效应分析,选择特异性、评分较高且GC含量合适的sgRNA序列[15]。并根据sgRNA序列设计引物对sg-F/R,详细序列如表2所示。将上下游引物通过寡链退火形成重组片段,采用Golden Gate assembly方法将其和BsaⅠ线性化的sgRNA-Cas9质粒组装并转化至大肠杆菌JM109感受态,对阳性转化子抽提质粒并测序后获得阳性克隆(此CRISPR-Cas9基因编辑系统由实验室构建)。
1.2.2 pGAP-ATG26过表达质粒
利用表2所示引物对ATG26-F/R,以GS115野生型基因组为模板作PCR,得到ATG26基因片段。将pGAPZB质粒利用KpnⅠ、XhoⅠ双酶切得到载体片段。对片段和载体采用Gibson assembly,并转化至大肠杆菌JM109感受态,对阳性转化子抽提质粒,利用引物对26-YZ-F/R作PCR并测序后获得阳性克隆。
1.3 毕赤酵母感受态制作和转化
毕赤酵母感受态制作和转化(电击法)参考Invitrogen官方手册。
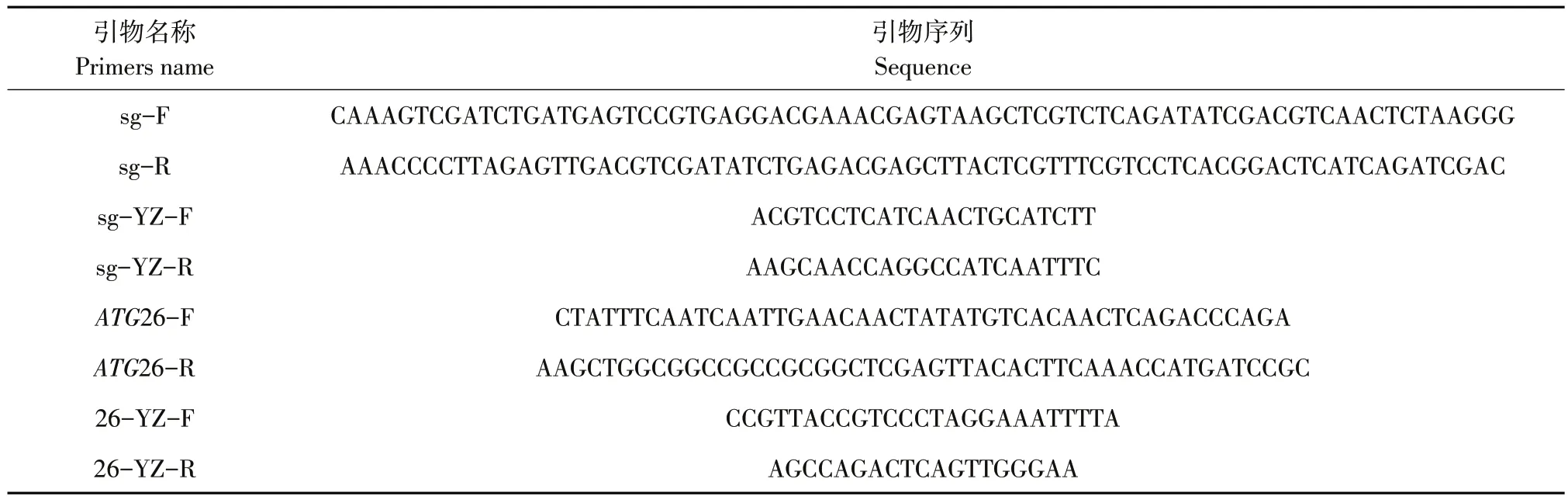
表2 研究所用引物Table 2 Primers in thisstudy
1.4 敲除菌株筛选及质粒丢失
将电转后酵母感受态涂布于博来霉素平板上,30℃培养3~5 d至形成单菌落,挑取转化子于博来霉素YPD培养基培养24 h后,提取酵母基因组DNA。利用表2所示引物对sg-YZ-F/R扩增目的片段并提交苏州金唯智公司测序验证。
将阳性转化子接种至无抗性MM培养基,用以丢失sgRNA质粒。30℃、220 r·min-1震荡培养24 h后于无抗性平板中划线分离,30℃培养3~5 d后,挑取单菌落至博来霉素YPD培养基和无抗性YPD培养基。30℃、220 r·min-1震荡培养24 h后,在无抗性YPD培养基中生长而抗性YPD培养基中无法生长的克隆,即为质粒丢失成功克隆,用于后续试验。
1.5 主要培养基及菌株培养条件
1.5.1 主要培养基
YPD培养基:1%酵母提取物、2%Peptone、2%葡萄糖。
MM培养基:1.34%YNB、0.5%生物素、1%甲醇。
MG培养基:1.34%YNB、0.5%生物素、0.5%甘油。
酵母培养时,若需添加抗生素,博来霉素和氨苄青霉素终浓度均为100μg·mL-1。
1.5.2 菌株培养条件
将各菌株以1%接种量接种至5 mL YPD培养基,30℃、220 r·min-1震荡培养,过夜活化。以OD600=0.5初始量分别转接至50 mL MM(1%甲醇)、MG(0.5%甘油)培养基,并用PBS清洗菌体2次。30℃、220 r·min-1震荡培养36 h时取样并补加1%甲醇,培养60 h时再次取样。
1.6 毕赤酵母胞内麦角固醇含量检测
取2 mL新鲜菌液,于5 000 r·min-1离心5 min收集菌体。收集细胞用500μL 20%氢氧化钾溶液(含50%乙醇)重悬,于沸水中煮沸10 min裂解细胞,室温冷却后加入500μL正己烷,涡旋震荡萃取5 min后静置分层,吸取上层正己烷相至新离心管;下层水相中加入250μL正己烷,重复萃取静置分层后再次吸取上层正己烷相与第一次萃取液合并。将离心管置于80℃金属浴挥发正己烷,挥发干净后加入50μL吡啶和100μL N,O-双(三甲基硅基)三氟代乙酰胺,80℃反应30 min后样品制备完成[16]。
采用气相色谱-质谱联用仪分析鉴定样品[17]。所用色谱仪为岛津气相色谱质谱联用仪GCMSQP2020,色谱柱为DB-5MS(Agilent,30 m×0.25 mm×0.25μm),FID检测器温度300℃,载气氦气流速为1.2 mL·min-1;进样口温度300℃,分流进样,进样量1μL,分流比30∶1;柱箱程序升温起始温度80℃,然后以20℃·min-1速度升温至280℃,保持15 min后以20℃·min-1速度升温至300℃,保持5 min;质谱扫描范围为40~450 m·z-1。
1.7 毕赤酵母AOX1酶活性检测
毕赤酵母AOX1酶活性检测方法参照文献[14]。
2 结果与分析
2.1 p GAP-ATG26过表达菌株构建
将目的基因PCR产物与双酶切后pGAPZB载体作Gibson assembly并转化至JM109感受态。涂布于博来霉素平板,挑取阳性转化子测序验证。验证正确后抽提质粒并单酶切线性化、电转至GS115野生型菌株,博来霉素平板筛选。挑取阳性转化子,提取基因组并PCR测序验证,琼脂糖凝胶电泳结果如图1所示。理论长度为812 bp,图中所示样品11~13均符合。

图1 ATG26过表达菌株PCR验证Fig.1 Confirmation of ATG26 overexpression strainsby PCR
2.2 敲除菌株筛选
将构建成功sgRNA-ATG26敲除质粒电转至GS115野生型菌株中,于博来霉素抗性平板中筛选阳性克隆,提取基因组DNA并PCR测序。比对结果如图2所示,相比于野生型菌株,敲除菌株将95 bp处碱基A成功敲除。

图2 敲除菌株序列比对结果Fig.2 Sequence alignment of mutant strains and wild typestrains
2.3 SUT2高低表达对胞内麦角固醇及AOX1酶活性的影响
按照1.5中培养及取样方法分别检测野生型、SUT2敲除和过表达菌株在常氧及低氧条件下胞内麦角固醇含量及AOX1酶活性。其中,常氧下检测结果如图3所示。甲醇培养基中,相比于野生型菌株(WT),过表达SUT2提高约21%胞内麦角固醇含量,而敲除SUT2降低约10%~15%胞内麦角固醇含量(见图3a)。因所用培养基为不含麦角固醇基本培养基,且胞外上清中均检测不出麦角固醇(数据未显示),故3株菌均无法从胞外摄取麦角固醇,也未分泌麦角固醇至胞外。因此本研究推测SUT2可能通过促进麦角固醇合成正向调节胞内麦角固醇含量。而甘油培养基中各菌株胞内麦角固醇含量无明显变化(见图3b),说明SUT2对麦角固醇合成的影响仅在甲醇诱导条件下存在,与SUT2在甲醇培养基中被诱导表达现象一致。
通过检测AOX1酶活性发现,相比于野生型菌株,SUT2过表达菌株(SUT2-OE)的AOX1酶活性提高约27%(见图3c),说明过表达SUT2对AOX1具有一定程度促进作用。因为,相比于甘油培养基,甲醇培养基中毕赤酵母过氧化物酶体显著增生[18],而麦角固醇是过氧化物酶体膜重要组成[9],所以甲醇培养基中过氧化物酶体与麦角固醇含量呈正相关;过氧化物酶体又是甲醇代谢主要细胞器[10-11]。结合上述试验结果,推测SUT2通过促进胞内麦角固醇合成并形成过氧化物酶体膜,促进过氧化物酶体增生,参与甲醇代谢并促进AOX1表达。
此外,SUT2敲除菌株(SUT2-KO)AOX1酶活性与野生型相近,但同样有所提高(见图3c)。可能因SUT2敲除后激活其他代谢通路导致。

图3 常氧条件下SUT2敲除、过表达及野生型菌株胞内麦角固醇含量及AOX1酶活性Fig.3 Intracellular ergosterol content and AOX1 enzymeactivity of SUT2 knockout,overexpression and wild typestrainsunder normoxia
因S.cerevisiae中SUT2为厌氧条件下与SUT1协同发挥作用基因[5-7],故本研究给予近似培养条件进一步研究,在1.5培养方法上作调整,实现低氧条件:静置于低氧培养箱(CO2∶空气=1∶4)中培养,同时将三角瓶瓶口用封口膜多次缠绕封闭。
低氧条件下检测结果如图4所示。相比于野生型,SUT2过表达对胞内麦角固醇含量无明显影响,敲除SUT2降低约9%~13%胞内麦角固醇含量(见图4a)。同时,SUT2过表达菌株AOX1酶活性具有一定程度提高,SUT2敲除菌株AOX1酶活性与野生型相似(见图4b)。因为甲醇代谢为耗氧过程,低氧条件下甲醇代谢减弱[19],AOX1和SUT2蛋白活性减弱,导致对胞内麦角固醇合成以及AOX1酶活性促进作用均不明显;若达到完全厌氧条件,改变SUT2表达量可能对胞内麦角固醇含量及AOX1酶活性均无明显作用。
通过在不同氧含量、碳源条件下对毕赤酵母SUT2基因敲除、过表达研究,发现相比于S.cerevisiae,毕赤酵母SUT2基因具有不同功能:常氧条件下,甲醇培养基中毕赤酵母SUT2通过促进胞内麦角固醇合成,形成过氧化物酶体膜,促进过氧化物酶体增生,从而参与甲醇代谢。
2.4 ATG26高低表达对胞内麦角固醇及AOX1酶活性的影响
将构建成功的ATG26敲除、过表达菌株同样按照1.5方法培养及取样,结果如图5所示。甘油培养基中各菌株胞内麦角固醇含量无明显变化(见图5b)。而甲醇培养基中,相比于野生型菌株(WT),ATG26过表达菌株(ATG26-OE)胞内麦角固醇含量下降约18%,AOX1酶活性下降约14%~20%;而ATG26敲除菌株(ATG26-KO)胞内麦角固醇含量提高约9%,AOX1酶活性提高约8%(见图5a、c)。即ATG26对胞内麦角固醇含量以及AOX1酶活性均具有反向调控作用。又因甲醇培养基中过氧化物酶体与麦角固醇含量呈正相关,故ATG26通过改变胞内麦角固醇含量影响过氧化物酶体含量实现对AOX1酶活性反向调控作用。该调控作用源自ATG26具有的甾醇葡萄糖基转移酶活性,可促进麦角固醇转化为甾醇葡萄糖苷[11],减少过氧化物酶体膜形成,进而减少过氧化物酶体增生以及AOX1酶活性。此外,ATG26还可与ATG30、ATG8、ATG11等蛋白协同作用,参与过氧化物酶体自噬,调控过氧化物酶体总量及体积[10]。
2.5 巴斯德毕赤酵母SUT2与ATG26调节过氧化物酶体含量初步模型
基于上述试验结果和已知调控通路,总结得到巴斯德毕赤酵母SUT2与ATG26调节过氧化物酶体含量初步模型,如图6所示。

图4 低氧条件下胞内麦角固醇含量及AOX1酶活性Fig.4 Intracellular ergosterol content and AOX1 enzymeactivity under hypoxia conditions
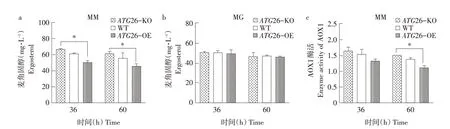
图5 常氧条件下ATG26敲除、过表达及野生型菌株胞内麦角固醇含量及AOX1酶活性Fig.5 Intracellular ergosterol content and AOX1 enzymeactivity of ATG26 knockout,overexpression and wild type strains under normoxia
与酿酒酵母SUT2参与厌氧条件下胞外麦角固醇摄取不同,毕赤酵母SUT2受甲醇显著诱导,虽然其具体诱导机制尚不清楚[4],但诱导表达的SUT2蛋白可能通过促进胞内麦角固醇合成并形成过氧化物酶体膜,进而促进过氧化物酶体增生并提高AOX1酶活,以此参与甲醇代谢。而同时存在ATG26蛋白一方面发挥甾醇葡萄糖基转移酶活性促进麦角固醇转化为甾醇葡萄糖苷,减少胞内麦角固醇含量,进而减少过氧化物酶体形成;另一方面作为自噬相关蛋白,与ATG30、ATG8、ATG11等协同作用,参与过氧化物酶体自噬。
因此,SUT2促进麦角固醇合成,ATG26将麦角固醇转化为甾醇葡萄糖苷,两者动态调节胞内麦角固醇含量及过氧化物酶体含量,进而调控甲醇代谢。
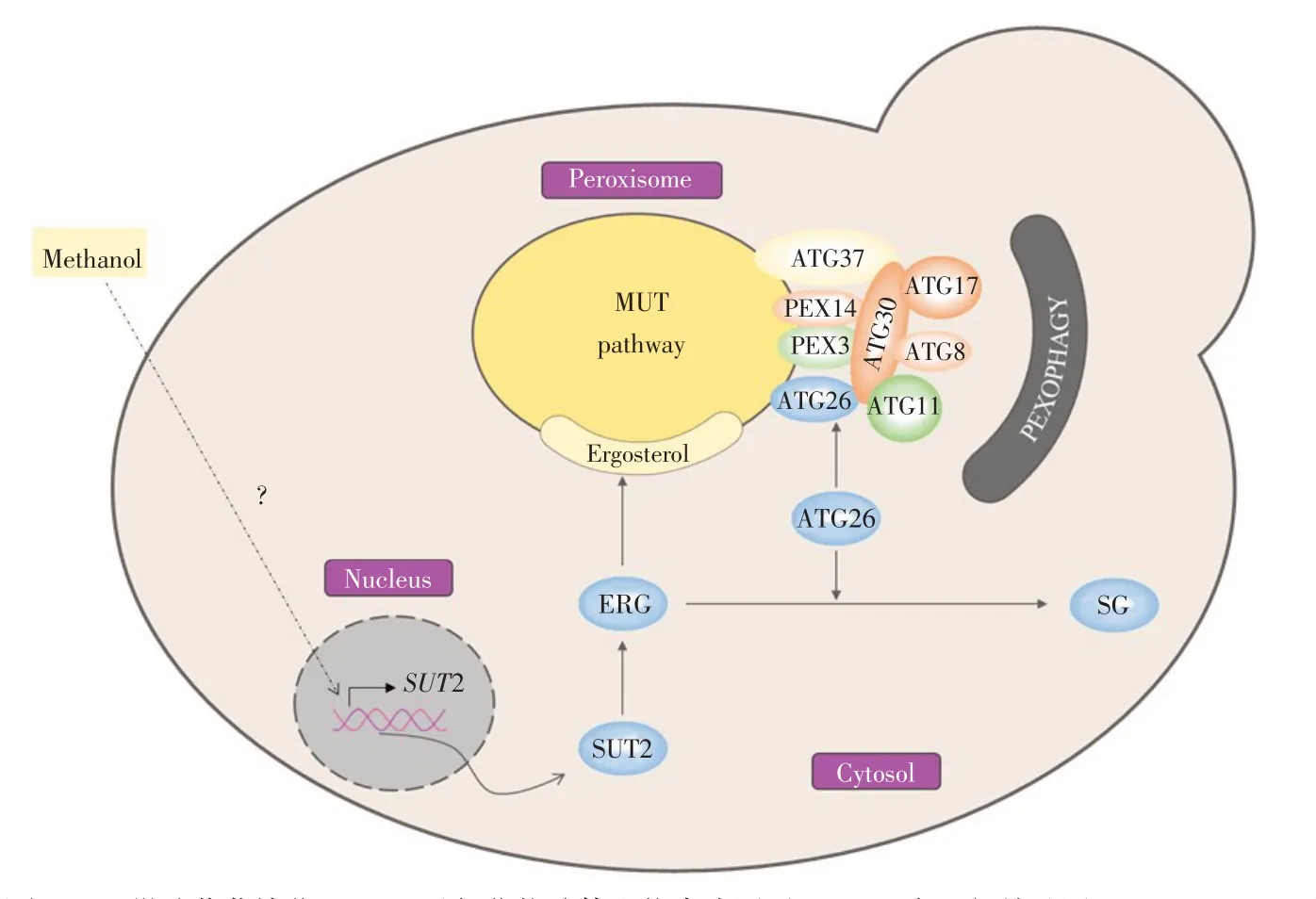
图6 巴斯德毕赤酵母SUT2与ATG26调节过氧化物酶体含量模型Fig.6 Model of K.phaffii SUT2 and ATG26 regulating peroxisomecontent
3 讨论与结论
受甲醇严格诱导的毕赤酵母PAOX1表达系统是目前应用最广泛表达系统之一,该系统基于甲醇利用途径,涉及较多潜在信号因子。本研究通过转录组数据分析发现,此前在K.phaffii中未被表征和深入研究的甲醇相关潜在因子SUT2,其具体功能机制尚不清楚。在S.cerevisiae中,SUT2响应于厌氧条件,协同SUT1参与固醇摄取[5-7];在植物细胞中,SUT2为糖转运蛋白,参与蔗糖代谢[20]。本研究结合酿酒酵母SUT2功能,合理推断毕赤酵母SUT2功能并验证。最终发现毕赤酵母SUT2具有不同于酿酒酵母和植物细胞SUT2的全新功能,毕赤酵母SUT2响应于有氧条件下甲醇代谢,促进麦角固醇合成并形成过氧化物酶体膜,促进过氧化物酶体增生,参与甲醇代谢。
毕赤酵母胞内过氧化物酶体含量动态调节通过生物发生和自噬降解之间平衡实现[11],生物发生时PEX11(Peroxisomal protein 11,过氧化物酶体膜蛋白11)等蛋白从头合成过氧化物酶体,胞内麦角固醇含量对过氧化物酶体增生具有重要作用。此前研究报道中,一般通过改变PEX11等过氧化物酶体膜蛋白表达量调节过氧化物酶体含量[21],尚未见利用胞内麦角固醇含量调节过氧化物酶体含量方法。本研究结合ATG26和SUT2全新功能,通过调节胞内麦角固醇含量,动态调节过氧化物酶体含量,调控甲醇代谢全新模型。该模型中,SUT2促进麦角固醇合成,进而促进过氧化物酶体增生和甲醇代谢;而ATG26将麦角固醇转化为甾醇葡萄糖苷,减少胞内麦角固醇含量和过氧化物酶体增生,减弱甲醇代谢。该模型建立丰富K.phaffii甲醇代谢机理研究,有助于进一步完善毕赤酵母甲醇调控网络。此外,过表达SUT2和敲除ATG26均有利于提高AOX1酶活;即通过改造该模型,有利于增强基于甲醇利用途径的PAOX1表达系统,为工业上应用PAOX1表达系统提供一种新思路。
本研究SUT2受甲醇诱导具体机制尚不清楚,仍需后续进一步研究,发现新信号因子,进一步阐明K.phaffii甲醇代谢调控机理。

