山西省大同市早播饲用燕麦叶部真菌病害病原鉴定及影响因素分析
高鹏,魏江铭,李瑶,张丽红,赵祥,杜利霞,韩伟
(1.山西农业大学草业学院,山西 太谷030801;2.大同千叶牧草科技有限公司,山西 天镇038200)
饲用燕麦(Avena sativa)亦称皮燕麦,是重要的禾本科牧草,包括我国在内的40多个国家和地区均有种植[1]。山西省大同市位于雁门关农牧交错带,是我国饲用燕麦的主产区之一,且种植面积逐年增加[2],但病害问题也愈发突出,成为限制其生产的主要因素之一。据李春杰等[3]的统计,截至2017年,全世界共报道了33种燕麦病害,其中25种为真菌引致的病害,我国已报道的有18种。2018-2019年,笔者通过对大同市饲用燕麦病害普查发现,叶部真菌病害也是导致牧草产量和品质下降的主要病害。目前,我国河北[4]和甘肃[5]等地区已有关于饲用燕麦叶部真菌病害研究的报道,但在山西尚属空白,因此迫切需要明确该地区真菌病害种类及病原。
长期以来,植物病理学家以形态学特征为依据,对病害病原进行鉴定,但由于特定时期对微生物认识的局限性,病原的分类地位可能被不断进行修订[6-7]。随着分子生物学技术的发展,越来越多的植物病害病原鉴定采用了形态学特征结合特殊基因序列比对分析的方法,极大提高了病原鉴定的准确性[8-9]。但GenBank、欧洲分子生物学实验室(European Molecular Biology Laboratory)和日本DNA数据库(DNA Data Bank of Japan)等仅对提交的微生物基因位点序列进行审核,而缺乏基于形态学特征鉴定病原准确性的专业审查,导致数据库的可靠性逐渐降低,研究结果也日益受到微生物分类学家的质疑[10]。植物病害病原形态的识别需要具备较强的专业性,并辅助结合致病性测定等手段对病原进行准确鉴定,虽然过程复杂、耗时较长,但仍是基础和可靠的方法。
病害发生流行分析是解析牧草病害成灾机理的重要依据,亦是制定有效防治措施的前提。国内外已有关于燕麦病害发生流行分析的报道,如Motovilin[11]初步证实了降水和温度是影响燕麦叶斑病发生的主要因素,但相关研究仍严重不足。对栽培草地植物而言,不同时间尺度上影响病害发生强度的因素及作用机制存在差异,气候特征是影响年际间病害发生和流行的主要驱动因素;年际间,寄主密度、群落郁闭度以及灌溉施肥等田间管理措施可直接或间接地通过对病原菌、寄主和环境的影响调控病害的发生[12]。
饲用燕麦为冷凉性作物,在我国一般一年种植一季。大同市千叶牧草科技有限公司于2018年开始试种早播燕麦,收获后复种第二季,并取得成功。初侵染源数量是植物病害发生的前提条件,并随着植物种植时间的延长逐渐累积,增加复种植物病害发生和流行的风险[12]。鉴于目前尚不清楚大同市早播饲用燕麦病害种类、病原、发生程度及致病因素,本研究采用形态学特征结合致病性测定,对该市天镇县大面积种植的早播饲用燕麦叶部真菌病害进行鉴定,同时调查了收获期不同病害的病情指数,收集了影响病害流行因素的基础数据,并对病情指数与病害影响因素之间的相关性进行初步分析,以期探明影响病害发生程度的主要因素,为多季生产饲用燕麦的叶部真菌病害的防控提供科学依据,保证雁门关农牧交错带燕麦产业的健康、可持续发展。
1 材料与方法
1.1 研究区概况
研究区位于山西省大同市天镇县千叶牧草有限公司的牧草种植田(E 113.95°,N 40.40°,海拔989~1008 m),面积2200 hm2,其中单播饲用燕麦面积510 hm2,饲用燕麦和箭筈豌豆(Vicia sativa)混播面积220 hm2,其余为单播苜蓿(Medicago sativa)。播种饲用燕麦为进口品种“贝勒”,箭筈豌豆为“兰箭1号”。种植田于2020年3月1日至2日播种,播种量为187.5 kg·hm-2,混播田饲用燕麦与箭筈豌豆种子重量比为7∶3,行间距均为15 cm。播种前,以180 kg·hm-2硝酸磷肥(PH4NO3)和120 kg·hm-2磷酸一铵(NH4H2PO4)作为底肥,分蘖期和拔节期分别追施180和270 kg·hm-2的尿素(H2NCONH2)。单播饲用燕麦田采用漫灌和自走式喷灌2种灌溉方式,混播田均采用漫灌方式,每月灌溉一次,6月25日开始收获(图1)。

图1 山西省大同市不同种植和管理方式的早播饲用燕麦种植田Fig.1 Field of early sowing oats under different planting and management patterns from Datong in Shanxi
1.2 材料
供试植物及培养基:盆栽饲用燕麦种子由千叶牧草科技有限公司提供。马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g、葡萄糖20 g、琼脂粉17 g,蒸馏水定容到1 L;V 8培养基:V 8果汁(美国Campbell Soup公司)200 mL、CaCO30.3 g、琼脂粉17 g,蒸馏水定容到1 L;水琼脂培养基:琼脂粉5 g、苯并咪唑60 mg、蒸馏水1000 mL。
供试仪器:试剂均为国产分析纯,Olympus BX50F-3光学显微镜、Olympus SZX7解剖镜,日本Olympus公司;SW-CJ-2FD超净工作台,中国苏州净化公司;MJ-250-I霉菌培养箱,中国上海一恒公司。
1.3 方法
1.3.1 饲用燕麦病害样本采集及病原物分离2020年5月中旬,按“Z”形对所有连片种植的饲用燕麦田进行病害普查,观察病害类型并拍照。收集不同病害类型的病叶,装入底部盛有干燥剂,中部用脱脂棉隔离的离心管,装入冷藏箱带回实验室,4℃保存用于病原鉴定。选择不同病害类型的典型病叶,采用常规组织分离法进行分离和纯化。将纯化的代表菌株,置于PDA和V 8培养基上,于20℃,荧光和紫外混合光下,光暗交替12 h培养。
1.3.2 分离物的致病性测定及再分离 离体接种:将燕麦种子用5%NaClO溶液消毒5 min,蒸馏水漂洗3次后在人工气候室用营养钵种植,每钵留苗5株,培养期间每钵浇灌20 mL Hoagland’s全营养液。当长至3~4叶期时,取平整叶片用75%酒精消毒5 s,无菌水冲洗3次,灭菌滤纸吸干叶片上的水后剪取叶片中部5 cm长的叶段,叶背向上放置在水琼脂培养基上。在培养14 d的代表菌株培养基中加入少量无菌水,用灭菌毛笔轻轻刮取菌落,然后用2层纱布过滤;锈菌直接刮取夏孢子堆,分别置于盛有100 mL无菌水的三角瓶中,使用血球计数器调整孢子浓度为1×106个·L-1,制得孢子悬浮液。用100μL移液枪吸取孢子悬浮液,轻轻转动容量调整阀,将枪头形成的菌悬液附着于叶片上(图2a)。每皿放3片叶段,每片叶段附着3滴孢子悬浮液。每种菌株重复4次,以接种无菌水作为对照。于23~25℃,光照强度6000 lx,光暗交替各12 h,培养24 h后,观察记录叶段发病情况。
活体接种:在离体接种配置的孢子悬浮液加入1滴吐温-20,使用喷雾法均匀喷洒至人工气候室培养的植株叶片背面,至叶片表面形成水滴为止。接种植物用有机玻璃罩保湿(图2b)。叶枯病和条斑病病原在23~25℃,锈病病原在15~18℃,光照强度6000 lx,光暗交替各12 h环境下培养24 h,保湿培养结束后揭去玻璃罩继续培养,环境湿度50%~55%。每种菌株重复4次,以接种无菌水做对照,逐日观察并记录发病情况。

图2 病原的离体(a)和活体(b)接种和培养装置Fig.2 Inoculating device of pathogenic fungi i n vitro(a)and vivo(b)
病原再分离:对接种发病的燕麦叶片病原再分离,将分离物和第1次分离得到的菌株按照1.3.1的方法从培养性状和形态特征上进行比较。
1.3.3 病原形态观察 确定不同类型病害对应代表菌株后,逐日观察培养性状,测量培养第7天的菌落直径,并在光学显微镜下观察、测量培养第10天的形态特征[6]。用接种针挑取叶枯病分生孢子盘和锈病孢子观察并测量其形态特征[7]。另外采用“液滴法”[6]将叶枯病病叶刮取的分生孢子悬浮液置于载玻片上,于23℃,光暗交替各12 h的培养箱中孵化24 h,观察和测量附着孢形态。每种病原选取25个孢子测量其大小,每个菌株取3皿或3片叶测量。
1.3.4 饲用燕麦病害调查2020年6月15日至6月17日,对收获时期的饲用燕麦病害进行调查。选择漫灌和喷灌的单播燕麦田以及漫灌的箭筈豌豆和燕麦混播田,每种田块选择4个具有典型代表性的独立重复小区,面积600 m2。采用“对角线法”调查饲用燕麦病害发生情况,每条对角线随机选择100株燕麦,每株分下部(0~30 cm)和上部(>30 cm)随机选择2片叶,采用“目视法”分别判读不同类型病害的严重度,每个小区共调查400片叶。病害严重度分级标准为:0级,无症状;1级,0.1%~5.0%;2级,5.1%~25.0%;3级,25.1%~50.0%;4级,50.1%~75.0%;5级,75.1%~100.0%。记录发病叶片数并计算病情指数,病情指数=Σ(各级病叶数×各级代表值)/(调查总叶数×最高级代表值)×100。
1.3.5 饲用燕麦密度、群落盖度及土壤养分含量测定 每个病害调查小区采用“5点取样法”设置样方,统计每个样方内的燕麦株数,计算密度。3人分别采用“目视法”从垂直样方上方估测植被覆盖百分比,以均值代表该样方的群落盖度。使用土钻钻取0~20 cm土层土壤,5个样方的取样土壤混匀后过2 mm筛,分别采用“碱解扩散法”“NaHCO3浸提-钼锑抗比色法”和“火焰光度计法”测定速效氮、有效磷和速效钾的含量[13]。
1.4 数据分析
采用Origin 20.0统计软件绘制病情指数、燕麦密度、群落盖度和土壤养分的箱型图,使用Fisher LSD进行差异显著性检验,并对上述指标进行Spearman相关性分析。
2 结果与分析
2.1 饲用燕麦病害症状及病原形态学特征
山西大同市的早播饲用燕麦田共发现3种叶部真菌病害,分别为叶枯病、条斑病和秆锈病。
叶枯病病原菌可侵染叶片和叶鞘(图3A-a,c)。病斑初期呈水渍状,浅黄色;后期沿叶脉扩展形成梭形病斑且中央干枯撕裂,叶片尖端或边缘病斑呈不规则形,黄褐色至焦褐色,病斑两面可见小黑点,即病菌的分生孢子盘(图3A-b,d)。发病严重时部分病斑相互融合,导致病叶快速枯死。
条斑病病原菌主要侵染叶片(图3B-a),少数也可侵染叶鞘(图3B-c)。病斑初期呈水渍状,黄色至紫褐色;后期形成条形或长椭圆形病斑,中央灰白色至深褐色,边缘有黄晕(图3B-b,d)。
秆锈病病原菌初期侵染叶片,随着病情发展,大量叶鞘被侵染。夏孢子堆呈长条形,后期表皮破裂并外翻,产生大量橘黄色夏孢子(图3C-a,b),部分夏孢子堆周围可见黑褐色冬孢子堆(图3C-c)。

图3 山西省大同市早播饲用燕麦病害田间症状Fig.3 Disease symptoms of oat leaves in cultivate field from Datong in Shanxi
叶枯病病原菌可在PDA培养基上培养,气生菌丝棉絮状,中部稍隆起,培养7 d的菌落直径为5.5~6.4 cm,后期菌落颜色由白色逐渐转为灰褐色(图4A-a,b)。分生孢子盘炭质,具刚毛(图4A-c)。分生孢子的产孢位点在产孢细胞顶端(图4A-d)。分生孢子盘产生的分生孢子镰刀形(图4A-e),分离培养物产生的分生孢子部分变直(图4A-f),均为单细胞,无色,大小为(19.7~30.1)μm×(2.2~3.0)μm。菌丝生附着胞灰褐色至黑褐色,椭圆形或近圆形,大小为(9.9~15.2)μm×(9.1~11.0)μm(图4A-g);分生孢子萌发的附着胞黑褐色,卵圆形或近圆形,轻微裂瓣状,大小为(7.8~11.4)μm×(6.0~8.5)μm(图4A-h)。
条斑病病原菌在PDA培养基上极少产生分生孢子,在V 8培养基上可产生较多分生孢子。V 8培养基中培养7 d的菌落直径为7.1~7.5 cm,菌落白色绒毛状,后期表面产生明显高于菌落表面的菌丛,背面中央呈灰绿色(图4B-a,b)。分生孢子单生,圆柱形,两端圆,浅黄褐色至深褐色,横膈膜3~6个少有2~9个,大小为(40.2~122.4)μm×(9.0~19.1)μm(图4B-c);分生孢子梗呈屈膝状,少数直,深褐色(图4B-d)。分生孢子脐点和分生孢子梗产孢位点明显,均内凹。
秆锈菌夏孢子堆橙黄色,具粉状夏孢子,在其周围产生冬孢子堆,黑色蜡质(图4C-a,b);冬孢子双胞,具柄,大小为(30.7~34.4)μm×(167.1~183.0)μm(图4C-c);夏孢子椭球形,表面具疣刺,大小为(23.3~38.1)μm×(12.8~21.2)μm(图4C-d);夏孢子和冬孢子均为橙黄色。
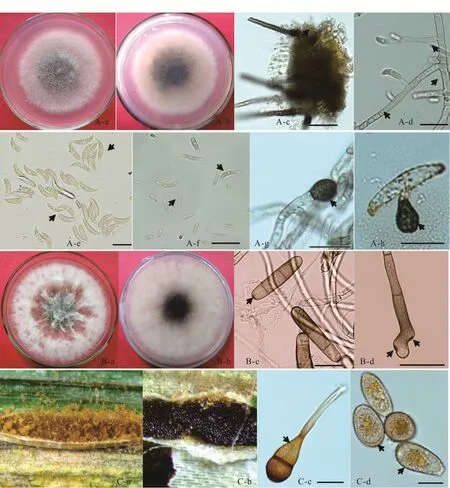
图4 饲用燕麦叶枯病、条斑病和秆锈病病原形态特征Fig.4 Mor phological characteristics of the pathogen of oat disease fr om Datong in Shanxi
2.2 病原接种症状
叶枯病病原菌接种离体叶片的发病率为96%,接种后5~7 d显症,病斑水渍状,后期逐渐形成黄褐色梭形枯斑,接种7~10 d,大部分病斑表面出现小黑点,解剖镜下可见分生孢子盘和刚毛(图5a)。
条斑病病原菌接种离体叶片的发病率为90%,接种2~5 d后显症,病斑较小,随后逐渐扩展并相互融合,形成不规则形,部分条形的枯斑,周围有黄晕,7~10 d后病斑中央呈黑褐色,解剖镜下表现为叶片细胞组织坏死变色,表面有黑色霉层(图5b)。
秆锈病病原菌接种离体叶片的发病率为56%,接种后7~10 d开始出现夏孢子堆,未见冬孢子堆(图5c)。上述接种无菌蒸馏水的对照均未发病(图5d)。

图5 饲用燕麦叶枯病(a)、条斑病(b)和秆锈病(c)病原离体接种及对照(d)叶片症状Fig.5 Symptoms of oat leaf spot(a),leaf streak(b),stem rust(c)and control(d)by inoculating isolate on detached oat leaves
离体接种病原分别接种活体植株,叶枯病发病率为74%,5~7 d显症(图6a);条斑病发病率为83%,2~5 d显症(图6b);秆锈病发病率为37%,7~10 d显症(图6c)。上述病原接种症状与田间和离体接种症状一致。接种无菌蒸馏水对照均未发病(图6d)。

图6 饲用燕麦叶枯病(a)、条斑病(b)和秆锈病(c)病原活体植株接种症状及对照(d)Fig.6 Symptoms of oat leaf spot(a),leaf streak(b),stem rust(c)and control(d)by inoculating isolate on living plants
结合形态学特征和致病性测定结果,通过与文献[14-16]比对,分别将叶枯病、条斑病和秆锈病病原菌确定为禾谷炭疽菌(Colletotrichum cereale),燕麦内脐孺孢(Drechslera avenacea)和禾柄锈菌燕麦转化型(Puccinia graminisf.sp.avenae)。
2.3 饲用燕麦收获期叶部病害的发生强度
如图7所示,饲用燕麦收获期,叶枯病、条斑病和秆锈病均有不同程度发生,病情指数均值分别在1.9~5.6、1.0~6.2和0~0.9。不同种植和管理模式下,3种病害的发病强度存在差异,其中单播漫灌和单播喷灌的叶枯病病情指数较高,且显著高于混播漫灌(P=0.005,P=0.033);单播喷灌的条斑病和秆锈病的病情指数均最高,且显著高于单播漫灌和混播漫灌(P<0.0001),而后两者之间均无显著差异(P>0.05)。3种病害在不同种植和管理模式下,重复小区的病情指数分散程度不同,其中叶枯病均明显大于条斑病和秆锈病;3种病害中单播喷灌的叶枯病分散程度最大,条斑病次之,秆锈病分散程度不明显。
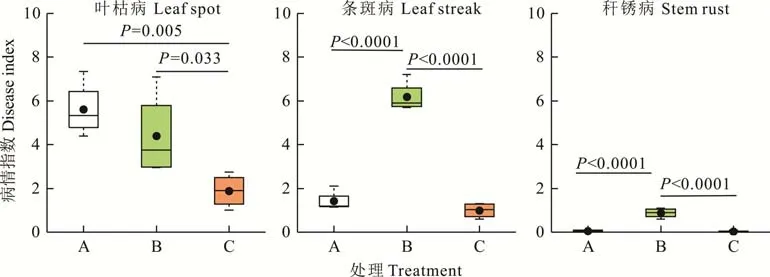
图7 山西省大同市单播漫灌(A)、单播喷灌(B)和混播漫灌(C)下早播饲用燕麦收获期叶枯病、条斑病和秆锈病的病情指数Fig.7 Disease index of leaf spot,leaf str eak and stem rust under monocultur e and flooding ir r igation(A),monoculture and sprinkling irrigation(B),mixture and flooding irrigation(C),respectively,from Datong in Shanxi
2.4 种植田燕麦密度、群落盖度及土壤养分特征
如图8所示,燕麦密度、群落盖度、土壤速效N、土壤有效P和土壤速效K的含量分别为293~516株·m-2、66%~87%、79~98 mg·kg-1、24~39 mg·kg-1和123~165 mg·kg-1。单播漫灌和单播喷灌的燕麦密度均较高,且显著高于混播漫灌(P=0.005,P=0.015),群落盖度和土壤养分含量在不同种植和管理模式之间无显著差异(P>0.05)。在不同种植和管理模式下,重复小区之间的燕麦密度、群落盖度和土壤养分指标均有不同程度的分散,其中土壤速效K的分散最为明显。
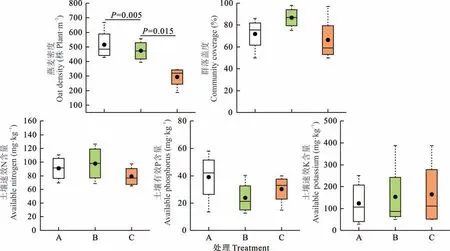
图8 山西省大同市单播漫灌(A)、单播喷灌(B)和混播漫灌(C)的早播饲用燕麦种植田燕麦密度、群落盖度和土壤养分特征Fig.8 Density of oat,community coverage and soil nutrient of monoculture and flooding irrigation(A),monoculture and sprinkling ir r igation(B),mixtur e and flooding ir r igation(C),r espectively,fr om Datong in Shanxi
2.5 燕麦叶部病害发生强度与环境因素之间的关系
如表1所示,3种病害的病情指数与燕麦密度、群落盖度和土壤养分含量之间存在不同程度的相关性。叶枯病病情指数与燕麦密度呈显著正相关(r=0.9231,P<0.05),与土壤速效K含量呈显著负相关(r=-0.5594,P<0.05)。条斑病和秆锈病的病情指数与喷灌均存在显著正相关(r=0.8194,P<0.05;r=0.8547,P<0.05),叶枯病和秆锈病的病情指数与土壤速效N含量之间存在显著正相关(r=0.6294,P<0.05;r=0.7024,P<0.05)。此外,燕麦密度与群落盖度之间亦有显著正相关关系(r=0.5604,P<0.05)。
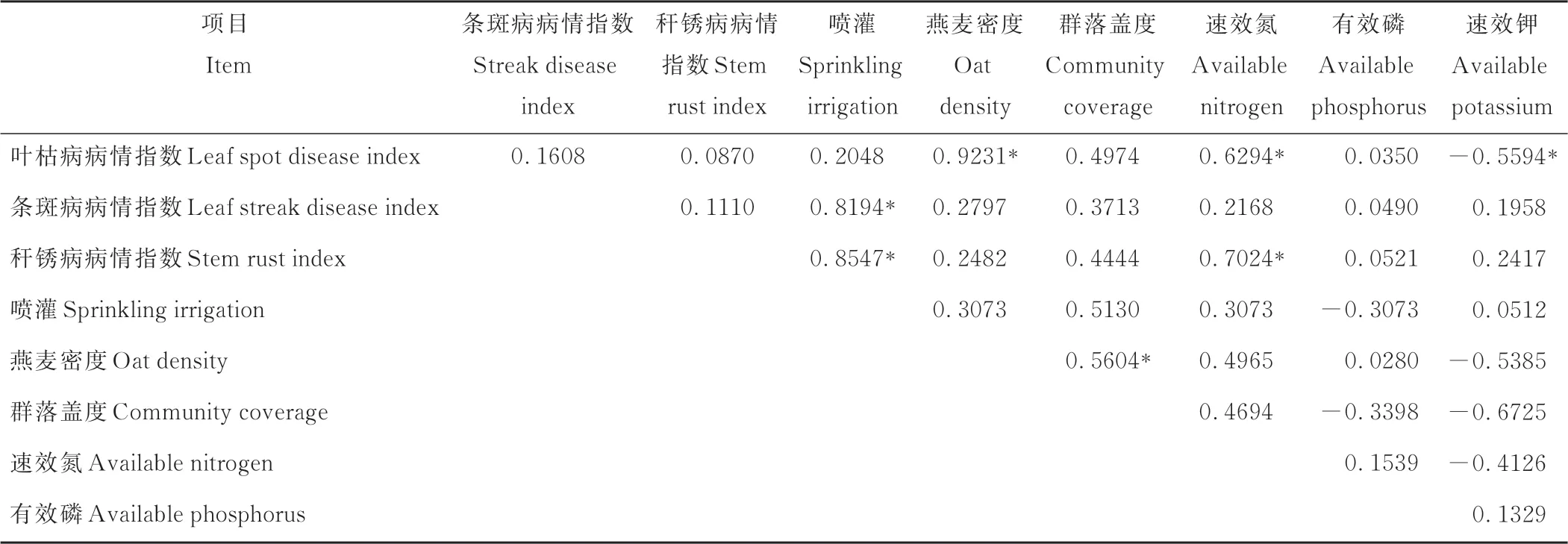
表1 山西省大同市早播饲用燕麦叶枯病、条斑病和秆锈病病情指数与燕麦密度、群落盖度和土壤养分含量之间的相关矩阵Table 1 Spearman’s rank correlation matrix between the disease index and oat density,community coverage and soil nutrient from Datong in Shanxi
3 讨论
据南志标等[14]和李春杰等[3]的统计,由禾谷炭疽菌引致的叶枯病在美国、巴西和加拿大等3国以及我国的内蒙古、甘肃和山西等7个地区均有报道,燕麦内脐孺孢引致的条斑病的发生范围则更广,包括加拿大等7国和我国的青海、新疆和山西等10个地区,而禾柄锈菌燕麦转化型引致的秆锈病为世界性病害,在所有燕麦种植地区均有报道。其中,叶枯病在内蒙古[15],条斑病在吉林、江苏、四川[16]、内蒙古、河北[17]和甘肃[5],秆锈病在河北有明确的形态描述,其余均以目录方式记载。本研究首次提供了山西燕麦上发现的禾谷炭疽菌、燕麦内脐孺孢和禾柄锈菌燕麦转化型的详细形态描述,丰富了我国饲用燕麦病害研究的基础资料。
1909年,Selby等[18]根据分生孢子盘、分生孢子和分生孢子梗的形态特征首次发现并命名了禾谷炭疽菌,该种的寄主包括燕麦属(Avena)、黑麦属(Secale)和大麦属(Hordeum)等多种禾草植物[19]。1914年,以地理种群为依据,Fragoso[20]将欧洲地区Avena sulcata上发现的禾谷炭疽菌建立了亚种C.cerealef.avenae-sulcatae。炭疽菌属(Colletotrichum)的有性态为子囊菌门(Ascomycota)小丛壳科(Glomerellaceae)小丛壳属(Glomerella)的真菌,但目前禾谷炭疽菌的有性态尚不清楚,因此该种的分类地位一直存在争议[21]。1980年,Sutton[22]在原有形态学特征基础上,依据附着胞形态确立了禾谷炭疽菌种稳定的分类地位,后来Crouch等[23]和Jayawardena等[24]利用多位点基因系统发育分析进一步将该种归为禾生炭疽复合种(Colletotrichum graminicolaspecies complex)。2015年,何苏琴等[15]在我国内蒙古燕麦的叶枯病病斑上发现并鉴定了禾谷炭疽菌,除分生孢子大小略有差异,与本研究形态特征基本一致。此外,本研究在病叶分生孢子盘中观察到的均为弯孢子,而分离培养的禾谷炭疽菌产生的分生孢子部分变直,这类直孢子主要是由初生孢子直接萌发形成的次生孢子[25],在菌种鉴定时,要避免对结果产生干扰。
1809年,Link首次建立长蠕孢属(Helminthosporium),其特征为分生孢子形似蠕虫,随后在1891年,Eidam在燕麦属(Avena)植物上发现并命名燕麦长蠕孢[16]。1930年,Ito[26]将长蠕孢属中有性态为核腔菌属(Pyrenophora)的真菌另立为内脐孺孢属(Drechslera),燕麦长蠕孢也被修订为燕麦内脐孺孢,其有性态为燕麦核腔菌(P.avenae)。由于该种具有很强的转化型,目前仅发现可侵染燕麦,其分类地位未发生变化。燕麦内脐孺孢的形态特征包括分生孢子形状和大小、隔膜数、顶端细胞和脐点等。在已报道的文献中,分生孢子形状、顶端细胞和脐点的形态相似,但分生孢子大小和隔膜数的差异较大,如聂秀美等[5]在甘肃燕麦上分离到的燕麦内脐孺孢的分生孢子大小为(10.5~32.5)μm×(3.2~9.6)μm,明显小于张笑宇等[17]在内蒙古和河北发现的燕麦内脐孺孢,而本研究分离的燕麦内脐孺孢的分生孢子大小与后者相近,但隔膜数与上述研究均有差异,暗示该种在我国可能发生了地理种群的分化。
1794年,Roemer[27]首次记载了Persoon根据具柄冬孢子建立的禾柄锈菌,1894年,Erikss等[28]根据锈菌专性寄生特性,将燕麦属植物上发现的柄锈菌命名为燕麦转化型,后来发现该菌的寄主范围扩展至鸭茅属(Dactylis)、雀麦属(Bromus)、早熟禾属(Poa)等冷季型草坪植物[29]。作为一种世界性病害,对燕麦锈病病原的识别相对其他半知菌要容易,但其具有较强的变异性可能导致出现新的生理小种,给病害防控带来严峻挑战,需要牧草种植者高度关注。
山西大同地区早播饲用燕麦叶部真菌病害的发生强度相对较轻,病情指数最高不超过8,明显低于山西、内蒙古和河北等地已报道的7-8月相同燕麦病害的发病程度[17]。植物病害的发生需要有适宜的温度和湿度条件,山西大同属冷凉地区,3-6月的温度有利于燕麦病害的发生,但这段时期我国北方地区普遍干旱多风[15],限制了病害的流行。研究表明,内脐孺孢和锈菌孢子的萌发需要100%的相对湿度或叶片存在自由水[30],因此喷灌条件下条斑病和锈病的发生强度显著高于漫灌。炭疽菌和锈菌侵染燕麦均能产生大量无性孢子,反复侵染造成病害流行,条斑病则很少产生分生孢子。喷灌持续形成的水滴具有沉降孢子的作用[31],这可能是导致本研究中叶枯病和锈病的发生强度低于条斑病的原因之一。
3种病害中,混播条件下的发病强度均显著低于单播植物,表明其有助于减轻燕麦病害的发生,该结论已在不同抗性小麦(Triticum aestivum)品种混播[32]以及豆禾牧草混播[33]实验中得到证实。研究表明,物理隔离和稀释感病寄主密度是导致病害发生强度降低的主要机制[11]。此外,土壤养分也是植物病害发生的重要影响因素,尤其是活体寄生真菌对寄主植物的养分状况更为敏感,如过量施氮能增强植物对氮素的同化进而提高锈菌的活力[34],而增施K可以降低包括真菌病害在内的大多数作物病害的严重程度[35]。本研究中,叶枯病和锈病与土壤N含量呈显著正相关,叶枯病还与土壤K含量呈显著负相关,这与前人研究结果一致,表明禾谷炭疽菌和禾柄锈菌对寄主活体植物的养分状况较为敏感,燕麦种植过程中不宜过量施氮;相反,土壤养分含量对条斑病的影响不明显,燕麦内脐孺孢的致病性测定也发现,该菌接种后第2天即表现出明显症状,导致病叶部分快速腐烂,表明其具有较强的腐生性。
总之,山西大同地区饲用燕麦叶部真菌病害的发生程度虽然较轻,但这类病害产生的孢子均能在病株残体和土壤上留存,作为病害发生的初始菌源,增加了病害流行的风险。牧草种植者应及时对早播饲用燕麦病害进行监测,采用合理的灌溉和施肥模式,推广牧草混播、轮作等种植技术,降低病害发生风险,并对发病初期的田块使用低毒高效杀菌剂进行病害防治,保证燕麦产业的可持续发展。
4 结论
本研究通过识别形态学特征,明确了山西大同市早播饲用燕麦叶部真菌病害的病原,并且分析探讨了收获期病情指数和病害影响因素之间的关系。本研究明确叶枯病的病原为禾谷炭疽菌(C.cereale),条斑病的病原为燕麦内脐孺孢(D.avenacea),秆锈病的病原为禾柄锈菌燕麦专化型(P.graminisf.sp.avenae),均可侵染叶片和叶鞘。灌溉、施肥和混播对3种病害的发生强度产生了影响,其中,喷灌是导致条斑病发病严重的主要因素,豆禾混播能减轻饲用燕麦叶枯病的发生。过量施N以及土壤速效K含量偏低也能加重叶枯病和秆锈病的发生。

