κ-阿片受体信号通路介导针刺抗缺血性心律失常的机制*
陈安莉,王圆圆,周 晨,陆风燕,辛娟娟,刘 群,赵玉雪,张雯晰,高俊虹,喻晓春
(中国中医科学院针灸研究所,北京 100700)
缺血性心脏病一直是全球范围内致死的第一位原因,同时也是导致长期致残的最主要原因[1],在中国该病的患病率和死亡率仍处于上升阶段[2]。临床上心肌缺血因个体化差异多表现为不同程度的心前区疼痛、不适、心律失常和心功能不全,而缺血性心律失常尤其是心室颤动,是引发大多数心源性猝死的主要原因[3]。目前治疗心律失常的药物、电复律以及各种消融方法均不能收到理想效果,为此亟待寻找一种预防此类疾病发生与降低不良愈后损害的新治疗策略。
心律失常属于中医学“心悸”“怔忡”范畴。针刺治疗本病由来已久,在我国古代文献中即有关于针刺改善心律失常的记载。如《针灸大成 · 卷二玉龙赋》云:“心悸虚烦刺三里,时疫痎疟寻后溪。[4]”《针灸甲乙经 · 卷九足厥阴脉动喜怒不时发疝遗溺癃第十一》言:“狐疝惊悸少气,巨阙主之。[5]”近年来,大量临床研究及动物实验同样证实,针刺具有改善心律失常的作用[6-7]。另一方面,现代医学研究表明,κ-阿片受体(kappa opoid receptor,κ-OR)系统在心脏疾病的发生发展中具有重要的病理生理学意义,为临床治疗心脏疾病提供了新的靶点[8]。大量的针刺镇痛研究表明,针刺可以调节阿片受体表达、激活阿片受体系统[9-10],然而阿片受体系统在针刺改善缺血性心律失常效应机制中是否存在特异性的介导作用尚不清楚。随着对阿片受体以及针刺作用机制的深入研究,提示针刺极有可能通过作用于κ-OR系统,再经 κ-OR 及其受体后信号传导通路,参与介导改善缺血性心律失常的保护作用。本文从缺血性心律失常的病理机制、κ-OR信号传导通路在心律失常病理机制中的作用、κ-OR信号传导通路介导针刺改善缺血性心律失常的可能及其研究意义等方面,探讨κ-OR信号传导系统介导针刺抗缺血性心律失常的作用机制,试图为κ-OR介导针刺改善缺血性心律失常提供研究思路。
1 缺血性心律失常病理机制及κ-OR信号传导通路在其中的作用
1.1 钙超载与缺血性心律失常
Ca2+在维持心脏的正常节律中起着重要作用。生理情况下,细胞外游离Ca2+是细胞内游离Ca2+的5000倍[11]。心肌缺血再灌注时,一方面引起心肌肌膜损伤,Na+/Ca2+交换逆转,细胞内流入大量Ca2+造成心肌细胞内钙超载;另一方面肌质网钙泵功能受损,肌质网对Ca2+的摄取减少或加重细胞内钙超载[12]。当钙离子超载时,会出现钙蛋白酶活化、心肌细胞间钙离子动荡、线粒体钙超载、ATP耗竭等一系列变化[13-14],使心肌细胞功能障碍最终细胞死亡。另有研究表明,通过升高心肌细胞内钙离子浓度能模拟心肌缺血预处理保护心肌的作用,同时L-型钙离子阻滞剂能减弱心肌缺血预处理保护心脏的作用[15],进而表明钙离子在激活细胞内途径产生保护作用中的重要地位。可见,细胞内钙浓度异常变化是导致心肌功能障碍的关键因素之一,控制钙超载对心肌的保护至关重要。
当细胞钙稳态失衡时会引发心律失常,其机制可能有以下几个方面。一是在心缺血再灌注早期,缺血心肌有短暂的钙超载,细胞内的PH值降低,H+/Na+交换增强,进入细胞的Na+增多;心肌缺血时ATP减少使得Na+//Κ+泵功能的降低,细胞内Na+超负荷,短暂地抑制Na+/Ca2+交换。由于再灌注时期ATP的恢复,Na+/Ca2+交换也被激活。再灌注引代谢使细胞内H+进一步增多,通过Na+/H+交换,细胞内Na+增多,通过Na+/Ca2+交换最终造成心肌细胞内钙超载[16],钙超载致使心肌细胞除极化加速,心肌自律性增高;二是心肌细胞内Ca2+的增加可影响Κ+浓度,使心脏有效不应期缩短,从而引起室性心律失常;三是肌浆网对钙离子的释放和回摄异常会使膜电位发生震荡除极,产生一连串的异位搏动,形成触发性心动过速。由此可见,钙超载与缺血性心律失常的发生密切相关。
1.2 κ-OR信号传导通路与缺血性心律失常
阿片受体广泛存在于中枢神经系统及外周组织[17]中。其有3种亚型即κ-阿片受体、 δ 阿片受体和μ 阿片受体,这3种受体均为G蛋白偶联受体[18],是由α、β、γ 3种多肽亚基组成的一种三聚体。其中α亚基为最大亚单位,包含Gi/o 家族、Gq/11家族、Gs 家族[19]、G12/13 四大家族。在心血管系统中κ-OR为主要亚型[20-21];κ-OR 活化后,细胞内G蛋白偶联受体和下游效应器被激活,而后通过第二信使调节细胞的离子通道进行细胞内信号传导。κ-OR可通过直接[22]和间接两条路径介导参与心肌细胞内钙调节及心肌功能保护。研究表明,κ-OR激动剂能通过调节心肌细胞内钙离子来稳定间隙连接蛋白-43,从而起到抗心律失常的作用[23-24];另有研究显示,κ-OR对心肌缺血大鼠不仅能发挥抗心律失常[25]、减小心肌梗死面积[26]、改善心功能、抗凋亡作用,而且κ-OR激动剂能耗竭细胞内储存钙离子[27],同时其抗心律失常的作用亦可被选择性κ-OR体阻滞剂Nor-BNI所拮抗[28],提示κ-OR与心肌保护密切相关。
1.2.1 κ-OR 参与心肌细胞内钙调节的直接介导途径 当κ-OR与G蛋白偶联,进而活化磷脂酶C(phospholipase C,PLC),使4,5-双磷酸磷脂酰肌醇水解为三磷酸肌醇(inositol 1,4,5-triphosphate,IP3)和二酰甘油(diacyl glycerol,DAG);另一方面,κ-OR-Gq 蛋白-PLC-DAG途径可激活蛋白激酶C(protein kinase C,PKC),启动信号传导。其中PLC是一种水解磷脂的酶类,迄今为止在哺乳动物身上发现了6种亚型13种PLC同工酶,在心脏组织中发现了高表达量的PLC-ε mRNA。研究显示,PLC-ε对于心脏功能发挥有影响[29]。PLC发挥作用的主要方式是调控IP3与DAG。 IP3分子与IP3受体结合后,IP3受体的化学结构发生变化,钙离子通道开放,细胞主动转运钙离子,并促进心肌细胞内肌浆网和线粒体钙离子的释放,其与钙离子浓度变化以及心律失常的发生密切相关;DAG可以激活的主要靶蛋白是PKC,经κ-OR-Gq 蛋白-PLC-DAG途径可刺激PKC活性。PKC由1组钙/磷依赖的丝氨酸/苏氨酸蛋白激酶组成,是细胞内信号传导通路的主要介质,能调节细胞内钙离子回摄。目前根据PKC的分子结构和功能差异将其分为多种亚型,即PΚC-α、PΚC-β1、PΚC-β2、PΚC-ε、PΚC-η、PΚC-θ、PΚC-δ、PΚC-ζ、PΚC-ι/λ、PΚC-γ。研究表明,PΚC-α、PΚC-β、PΚC-δ、 PΚC-ε、PΚC-ι/λ和PΚC-ζ存在于心脏组织中[30]。在缺血时PKC表达量增加,PKC异常活动时即会导致心律失常的发生。
1.2.2 κ-OR 参与心肌细胞内钙调节的间接介导途径 众所周知,心肌组织中存在多个受体调控系统,其中β1-肾上腺受体是调节心脏活动的主要受体。Gs-腺苷酸环化酶-环磷酸腺苷-蛋白激酶A-L-型钙离子通道是β1-肾上腺受体调节心脏活动的经典途径。当交感神经递质与β1-肾上腺受体结合后,G蛋白将信号传导到腺苷酸环化酶,进而影响第二信使环磷酸腺苷以及心肌细胞反应。其中,腺苷酸环化酶位于心肌细胞膜上,它可以将ATP转变为环磷酸腺苷进而使细胞产生信号应答。环磷酸腺苷是体内常见的第二信使,具有扩张血管、调节细胞生长分化、离子通道传递等作用。环磷酸腺苷对细胞的主要调节方式是通过激活蛋白激酶A来实现。研究表明,心肌细胞内的环磷酸腺苷/蛋白激酶A信号途径参与调节心率并与心律失常相关[31]。此外,蛋白激酶A能影响L-型钙离子通道的磷酸化[32]。在L-型钙离子通道的磷酸化后,将增大心肌细胞膜对钙离子的通透性,使钙离子内流增加, 肌浆网上钙离子释放增多,使第三信使-胞质溶液中钙的水平发生变化,从而完成细胞信号传导进而调节心脏功能[33]。研究表明,κ-OR的选择性激动剂U50488在生理状态下能抑制β1-肾上腺受体带来的正性肌力作用,此种作用随着心脏状态变化而变化。心肌缺血时引起交感神经紧张性活动的过度增加,进一步使得交感-肾上腺髓质系统激活,心肌细胞内钙超载。而激活心肌细胞κ-OR可以对心肌细胞β1-肾上腺受体带来正性频率、正性肌力作用进行负性调节,达到保护心肌组织的目的。这种调节作用通过降低钙瞬变幅度得以实现[34]。因此当心肌缺血、心肌β1-肾上腺受体过度激动引发钙超载、导致心功能损害时,κ-OR的负性调节尤为重要。
心肌缺血时引起的心肌细胞钙超载与缺血性心律失常的发生关系密切,因此防止钙超载是减轻心律失常的有效举措。κ-OR信号传导的直接通路或者间接通路可能是通过调节心肌细胞内钙,从而介导缺血性心律失常发生及参与抗心律失常的保护。
2 κ-OR信号传导通路介导针刺改善缺血性心律失常机制研究的新思路
以往关于针刺对阿片受体调节的研究主要集中在针刺镇痛效应及机制研究方面。相关研究表明,针刺可以增加阿片类物质[35],改变阿片受体的表达,激活体内的阿片受体[8,36];对于κ-OR而言,针刺可以促进κ-OR表达,并明显增强其mRNA的表达[38];另有研究显示,针刺对于κ-OR信号传导的直接通路相关站点,如IP3、DAG、PLC、PKC等均有调节作用[37,39]。如前所述,κ-OR对于心肌功能的调节越来越受到关注。综合针刺镇痛及κ-OR对细胞内钙调节的相关研究,提示针刺极有可能通过调节心脏κ-OR,经由其直接信号传导通路调整心肌细胞内钙,从而改善缺血性心律失常。
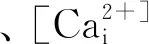
综上所述,心律失常的发生与细胞内钙超载和κ-OR后信号传导系统的调节密切相关。目前缺血性心律失常的治疗主要采用药物治疗如阿托品、异丙肾上腺素等和非药物治疗如电除颤、心脏起搏器、电消融等,均不能收到满意疗效。如上所述,以往诸多研究显示,针刺能改善缺血性心律失常;而针刺镇痛的研究表明,阿片受体可被针刺激活,且阿片系统的激活被证明可以直接和间接作用介导参与对心肌缺血性损伤的保护作用。因此针刺极有可能通过作用于心脏阿片受体系统而起到改善缺血性心律失常的作用。
有鉴于此,通过结扎大鼠冠状动脉左前降支法制备心肌缺血/再灌注造成的心律失常模型,采用电生理学、分子生物学、单个细胞内钙瞬变和单个细胞收缩同步检测等技术方法,深入阐明心脏中主要的阿片受体之一 κ-OR 及其受体后信号传导通路在介导电针预处理改善缺血性心律失常中的作用,详细分析该信号传导系统中哪个或哪些信号成分在介导上述针效中发挥作用(包括直接作用和间接作用机制)。阐明上述机制,不仅有助于为今后临床针刺防治缺血性心律失常提供治疗思路,还将为缺血性心律失常提供科学证据。

